Введение
Пурпурные бактерии являются ценными объектами биотехнологии, так как они обладают высокой скоростью роста и способны к деградации широкого спектра отходов различных производств [3]. Предполагается, что штаммы пурпурных бактерий с пониженным синтезом пигментов могут быть перспективными для получения водорода, в частности, в условиях лимитирования светом [4]. Однако не все мутантные штаммы способны к устойчивому росту. В нашей предыдущей работе показано, что штамм Rhodobacter sphaeroides pRK puf DD13, не имеющий периферийного светособирающего антенного комплекса, отличается низкой скоростью роста (0,02 ч-1) и нестабильностью при непрерывном фотогетеротрофном культивировании [1]. Целью представленных исследований было выяснить особенности непрерывного культивирования другого штамма Rba. sphaeroides DBCΩ с редуцированной периферической светособирающей антенной [2].
Материал и методы
Штамм Rba. sphaeroides DBCΩ характеризуется нарушенной сборкой пигмент-белкового комплекса периферической светособирающей антенны (LH2), так как в puc-оперон, ответственный за синтез белков периферической светособирающей антенны, вставлена кассета устойчивости к антибиотику стрептомицину, что делает невозможной нормальную экспрессию белков периферического светособирающего комплекса. Родительским для этого мутантного штамма является штамм Rba. sphaeroides 2.4.1 ATCC [2], который использовался нами в качестве контрольного. Штаммы были любезно предоставлены лабораторией молекулярной биологии и биотехнологии университета г. Шеффилд (Великобритания). Рекомбинантные штаммы с модифицированным фотосинтетическим аппаратом pRK puf DD13 и pRK puf ΔLM1, также использованные в этой работе, подробно описаны ранее [1].
Культивирование инокулята осуществлялось в стеклянных сосудах объемом 250 мл. Для инокулята использовалась среда Ормеруда с добавлением молочной кислоты 30 мМ, а также дрожжевого экстракта 1,0 гл, начальный рН 6,8-7,0. Культивирование проводили фотогетеротрофно анаэробно при 28°С в присутствии антибиотиков (мкгмл): для штамма pRK puf ΔLM1 – тетрациклин (5), канамицин (30); для штамма pRK puf DD13 – тетрациклин (1), канамицин (5) и стрептомицин (5); для штамма DBCΩ – стрептомицин (5). В некоторых экспериментах штаммы культивировали без антибиотиков, когда селективным маркером, препятствующим элиминации плазмид из клетки, являлась способность к фотогетеротрофному росту.
Непрерывное культивирование штаммов DBCΩ и 2.4.1 осуществляли на свету в фотобиореакторе (ФБР) на основе коаксиальных цилиндров [5] в режиме хемостата с лимитированием аммонием (2-4 мМ NH4+, скорость протока 0,02 ч–1, рН 7,0). Культивирование проводили на среде Ормеруда с 50 мМ молочной кислотой и дрожжевым экстрактом (0,1 гл). Для обеспечения анаэробных условий в реактор непрерывно подавали аргон (20,0 млмин). После посева инокулята в ФБР осуществлялось периодическое культивирование в течение 24 ч с поддержанием рН 7,0, затем включался режим хемостат. В результате разбавления оптическая плотность культуры начинала падать до тех пор, пока культура не достигала состояния динамического равновесия, при котором скорость роста равна скорости протока. Непрерывное культивирование в режиме турбидостата проводилось при заданной оптической плотности (ОП) 0,2 для обоих штаммов на среде Ормеруда. В каждом режиме для обеспечения анаэробных условий в реактор непрерывно подавали аргон (20 млмин). Рабочий объем составлял 0,75 л.
Количество бактериохлорофилла а (БХл а) в клетках определяли спектрофотометрически (спектрофотометр Shimadzu, Япония) при λ=772 нм в ацетон-метанольном экстракте [1].
Определение абсолютно сухого веса (АСВ) клеток проводили, как описано ранее [1].
Определение оптической плотности суспензии проводилось датчиком в ФБР (длина оптического пути 3 мм), а также спектрофотометрически (спектрофотометр Shimadzu, Япония) при λ=650 нм и длине оптического пути 1 мм.
3. Результаты исследования и их обсуждение
Исследования показали, что при культивировании в ФБР в режиме хемостат при скорости протока 0,02 ч-1 штамм Rba. sphaeroides DBCΩ через 8-12 дней выходит в состояние динамического равновесия, которое характеризуется постоянной концентрацией БХл а и клеток (АСВ и оптическая плотность культуры не изменяются) (Рис. 1). В отличие от ранее изученного штамма Rba. sphaeroides pRK puf DD13, штамм DBCΩ имел устойчивый рост, что позволило далее провести исследования в режиме турбидостата.
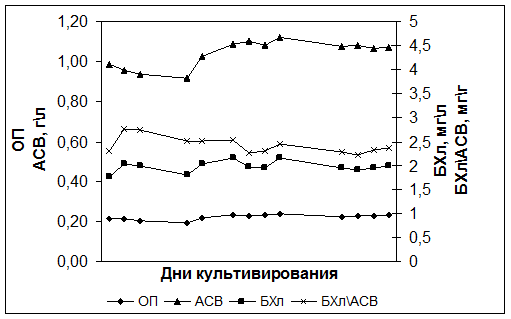
Рис. 1. Культивирование штамма Rba. sphaeroides DBCΩ в режиме хемостат с лимитированием аммонием (4 мМ NH4+) при скорости протока 0,02 ч-1.
Культивирование в режиме турбидостат при заданной ОП=0,2 (АСВ=0,55 г/л) показало, что скорость роста возрастала до 0,1 ч-1 с увеличением интенсивности света от 8 до 14 Вт/м2, не изменяясь при дальнейшем увеличении интенсивности (рис. 2). При этом снижалось содержание БХл а, как абсолютное, так и относительное (БХлАСВ). Максимальное относительное содержание составило 2,3 мг/г при 14 Вт/м2. При высоких интенсивностях света относительное содержание БХл а снижалось до 1,3 мг/г.
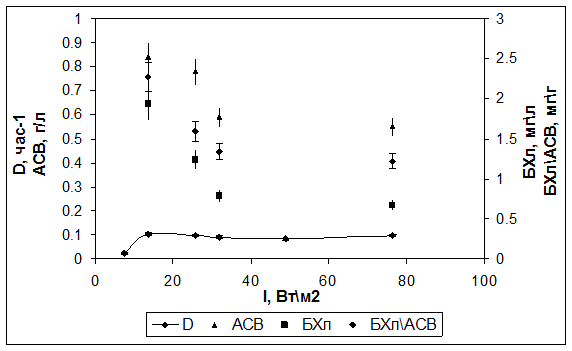
Рис. 2. Зависимость скорости роста (D), содержания БХл а и АСВ от интенсивности падающего света для штамма Rba. sphaeroides DBCΩ в режиме турбидостат.
Для сравнения были проведены аналогичные эксперименты с родительским штаммом Rba. sphaeroides 2.4.1. В режиме хемостат (при скорости протока 0,02 ч-1) культура также характеризовалась стабильным ростом. В режиме турбидостат при ОП=0,2 (АСВ=0,43 г/л) скорость роста возрастала до 0,2 ч-1 с увеличением интенсивности света от 4 до 32 Вт/м2 (рис. 3).
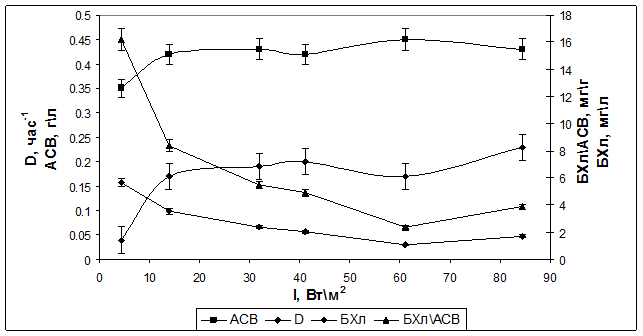
Рис. 3. Зависимость скорости роста (D), содержания БХл а и АСВ у штамма Rba. sphaeroides 2.4.1 от интенсивности падающего света в режиме турбидостат.
Относительное содержание Бхл а при этом снижалось. Однако максимальная величина этого показателя была гораздо выше (16,2 мгг) по сравнению с мутантным штаммом при низкой интенсивности, и эта величина уменьшалась до 4 мг/г при высокой интенсивности. Таким образом, штамм с нарушенным синтезом антенны имел более низкое содержание Бхл а в расчете на сухой вес, как при высоких, так и при низких интенсивностях света, а также более низкую скорость роста, чем родительский штамм, в условиях турбидостата. У описанного ранее рекомбинантного штамма с модифицированным фотосинтетическим аппаратом Rba. sphaeroides pRK puf DD13 влияние интенсивности света (в области высоких значений) на содержание БХл а изучали в режиме хемостат при разных концентрациях аммония. Как видно из Табл. 1, и абсолютное, и относительное содержание Бхл а уменьшалось с увеличением интенсивности падающего света, независимо от концентрации аммония. Однако при одной и той же интенсивности падающего света относительное содержание БХл а было выше при меньшей концентрации клеток (2 мМ NH4+), хотя средняя интенсивность света в ФБР, в этом случае должна быть выше.
Таблица 1. Влияние интенсивности света на содержание БХл у штамма Rba. sphaeroides pRK puf DD13 при росте в режиме хемостат с лимитированием аммонием. Концентрация АСВ была 0,47±0,005 и 1,05±0,07 г/л при 2 и 4 мМ аммония соответственно.
|
Интенсивность света, Вт/м2 |
Содержание БХл, мг/л |
Относительное содержание БХл, мг/г АСВ |
||
|
2 мМ NH4 |
4 мМ NH4 |
2 мМ NH4 |
4 мМ NH4 |
|
|
41,0 |
1,66±0,09 |
1,84±0,19 |
3,50 |
1,8 |
|
61,0 |
1,38±0,07 |
2,04±0,03 |
2,95 |
1,9 |
|
84,5 |
0,67±0,09 |
1,41±0,03 |
1,40 |
1,3 |
Для сравнения данные по изученным штаммам Rba. sphaeroides с нарушенным синтезом пигментов при выращивании в режиме хемостат представлены в табл. 2.
Таблица 2. Содержание АСВ, БХл, БХл/АСВ и экономический коэффициент использования аммония (Yамм) для некоторых штаммов Rba. sphaeroides при росте в хемостате (0,02 ч-1) с лимитированием аммонием (интенсивность света 25-41 Вт/м2).
|
Штамм |
NH4, мМ |
БХл, мг/л |
АСВ, г/л |
БХл/АСВ, мг/г |
Yамм, г/моль |
|
DBCΩ |
4 |
1,94 |
0,85 |
2,28 |
212 |
|
2.4.1 |
2 |
1,88 |
0,43 |
4,40 |
215 |
|
pRK puf DD13 |
2 |
1,66 |
0,45 |
3,69 |
225 |
|
4 |
1,84 |
1,05 |
1,75 |
263 |
|
|
pRK puf ΔLM1 |
2 |
6,14 |
0,31 |
19,8 |
155 |
Как в случае DBCΩ, так и в случае pRK puf DD13 относительное содержание Бхл a было выше у родительских штаммов (соответственно, 2.4.1 и pRK puf ΔLM1) по сравнению с мутантными. На основании величин АСВ был рассчитан экономический коэффициент использования аммония в режиме хемостат. Между мутантом DBCΩ и родительским штаммом 2.4.1 достоверных различий обнаружено не было. Таким образом, нарушение синтеза пигментов не сказалось на азотном обмене бактерий. У родительского штамма pRK puf ΔLM1 обнаружен пониженный экономический коэффициент использования аммония и аномально высокие значения концентрации БХл а, что может косвенно указывать на компенсаторные механизмы, включающиеся при разобщении фотосинтетического аппарата, так как у этого штамма гены, кодирующие синтез реакционного центра и коровой светособирающей антенны, находятся на плазмиде.
Заключение
Как показывают приведенные нами исследования, штамм DBCΩ с редуцированным фотосинтетическим аппаратом способен к устойчивому росту при непрерывном культивировании, в отличие от ранее исследованного штамма pRK puf DD13. Зависимость скорости роста от интенсивности света носит сходный характер у штамма DBCΩ и дикого типа 2.4.1, хотя скорость роста у последнего выше в 2 раза.
У штаммов с редуцированным фотосинтетическим аппаратом (DBCΩ и pRK puf DD13) накопление пигментов снижается с увеличением интенсивности света, что сходно с родительскими штаммами. При этом максимальное относительное содержание БХл а достигало 20 мг/г у родительского штамма pRK puf ΔLM1.
Полученные данные позволяют рекомендовать штамм Rba. sphaeroides DBCΩ для дальнейших исследований с использованием непрерывного культивирования с целью получения водорода, а штамм pRK puf ΔLM1 – в качестве продуцента БХл.
Рецензенты:
Гудков С.В., д.б.н., ведущий научный сотрудник, Федеральное бюджетное учреждение науки Институт Теоретической и Экспериментальной Биофизики РАН (ИТЭБ РАН), г. Пущино.
Белова Н.А., д.б.н., ведущий научный сотрудник, Федеральное бюджетное учреждение науки Институт Теоретической и Экспериментальной Биофизики РАН (ИТЭБ РАН), г. Пущино.



