Введение
Кинетическое моделирование технологических процессов имеет большое значение и широко используется для оптимизации технологических режимов, в алгоритмах управления и при исследовании механизмов химических взаимодействий. В полной мере такой подход распространяется на процесс декомпозиции алюминатных растворов глиноземного производства, что стало мотивом для целого ряда исследований посвященных его моделированию.
Цель исследования
Физико-химический анализ, показывает существенное влияние калия на свойства растворов в системе Na2O-K2O-Al2O3-H2O [1]. При разложении алюминатных растворов глинозёмного производства эти особенности необходимо учитывать, особенно для растворов от переработки нефелиновых руд и концентратов, а, в некоторых случаях, и бокситового сырья, содержащего заметные количества калиевых алюмосиликатов. Из производственной практики и ряда публикаций известно, что присутствие калия оказывает существенное влияние на показатели декомпозиции алюминатных растворов, но количественная оценка этого влияния отсутствует до настоящего времени, несмотря на то, что отдельные аспекты данного вопроса подлежали научной проработке [1,4]. В связи с этим, представляет значительный интерес получение экспериментальных данных о кинетике разложения алюминатных растворов содержащих различные мольные доли Na2О и K2O.
Аналитическая база
Наиболее простой и распространенный взгляд на кинетическую модель процессов осаждения из раствора связан с использованием следующего эмпирического уравнения:
dm/dτF = K(C - C0)n,
где m и F – соответственно масса и поверхность кристаллизующегося вещества; τ – время; K - константа; n – кинетический параметр, не совпадающий с порядком химической реакции; C, C0 – концентрация пересыщенного и равновесного растворов по кристаллизующейся фазе.
Уравнение такого вида широко используется для описания процессов массовой кристаллизации [3]. Применительно к декомпозиции алюминатных растворов было показано, что оно позволяет дать адекватное математическое описание данного процесса, и имеет второй порядок по показателю n [5]. Это позволило использовать данное уравнение в алгоритмах управления производственным процессом разложения алюминатных растворов на Российских глиноземных предприятиях. Уточненный вид эмпирического уравнения был предложен зарубежными специалистами [7]:
dm/dτF =K((C - C0)/( Nк - 0,0078С))2,
где Nк - концентрация каустической щёлочи в растворе в пересчёте на Na2O.
В предложенное кинетическое уравнение внесены уточняющие коэффициенты, при сохранении второго порядка относительно осаждаемого компонента.
Первая модель, предложенная нами, учитывала известные стехиометрические соотношения и возможную стадийность химических процессов, которая описывается следующей схемой [6]:
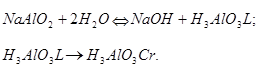
Это позволило вычислить необходимые кинетические параметры и показать возможность использования полученной модели для адекватного описания кинетики декомпозиции и роста кристаллической фазы. В то же время, в этой модели не учтен ряд факторов, значимых с позиции лимитирующей стадии химического осаждения. К таким факторам относятся второй порядок определяющей стадии прямой и обратной реакции, а также, необходимость участия в этом взаимодействии мономеров гидроксида алюминия как элементов системы, обладающих наибольшей симметрией и позволяющих на этой основе выстроить любые структурные элементы, включая гиббсит, обладающие более низкой симметрией [2]. С учетом высказанных соображений, нами предложена следующая стехиометрия лимитирующей стадии процесса декомпозиции:
![]() .
.
Использование известных подходов, учитывающих скорость обратимых взаимодействий, позволило выполнить преобразования, приводящие к выражению скорости разложения алюминатных растворов через традиционные величины принятые в производстве глинозёма и доступные для определения. Для принятой стехиометрии обратимого процесса поток взаимодействия запишется в следующем виде:
![]() ,
,
где j = dm/dτF – поток кристаллизации; ![]() ,
, ![]() – соответственно константы скорости прямой и обратной реакции;
– соответственно константы скорости прямой и обратной реакции; ![]() и
и ![]() – концентрации компонентов жидкой фазы.
– концентрации компонентов жидкой фазы.
С учётом, что константа равновесия может быть выражена через константы скоростей прямого и обратного процесса, получаем:
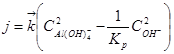 ,
,
где KP – константа равновесия, имеющая следующий вид при пересчёте равновесных концентраций участников взаимодействия на оксиды, т.е. традиционную форму представления состава алюминатных растворов принятую в России
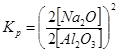 ,
,
где [Na2O] и [Al2O3] – концентрации каустической щелочи и гидроксида алюминия в растворе.
Тогда, выразив текущую концентрацию каустической щёлочи в растворе через её начальную величину и, используя понятие каустического модуля, получаем следующее кинетическое уравнение декомпозиции алюминатных растворов:
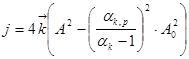 ,
,
где αк – каустический модуль раствора, равный молярному отношению количества (концентрации) каустической щёлочи в растворе в пересчёте на Na2O к количеству (концентрации) оксида алюминия; A, A0 – соответственно текущая и равновесная концентрация Al2O3 .
Эмпирическое уравнение, приведенное ранее, после ряда преобразований принимает вид, близкий к полученной нами модели, что говорит об их структурной идентичности и учете в математическом приближении параметров физической модели:
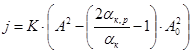 .
.
Для расчёта констант, входящих в кинетические уравнения (модели) и оценки их адекватности, необходимо использование экспериментальных данных о процессе декомпозиции.
Результаты исследований
Собственные исследования совместно с сотрудниками химического факультета Санкт-Петербургского государственного университета позволили не только дать широкомасштабное описание процесса разложения алюминатных растворов в лабораторных условиях, но и смоделировать изменение крупности материала в ходе осаждения гидроксида алюминия. Во всех перечисленных случаях было применено математическое моделирование, не учитывающее реальный механизм процесса декомпозиции алюминатных растворов.
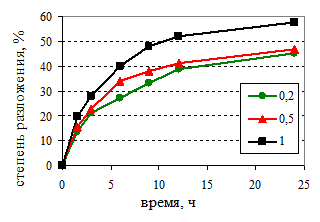
Физическое моделирование этой технологии выполнялось нами в лабораторном масштабе. При этом значительный интерес с производственных позиций представляет осаждение гидроксида алюминия из щелочных алюминатных растворов с различной мольной долей К2О. Комплекс проведённых исследований выполнялся в однотипных условиях по режиму технологических процессов и использованному оборудованию, которые обеспечивали приготовление алюминатного раствора и затравочного гидроксида алюминия требуемого состава, а также воспроизведение условий декомпозиции. Химический анализ растворов на содержание каустической щёлочи и оксида алюминия выполнялся титрометрическим методом. Кинетические кривые разложения алюминатных растворов на затравке гиббсита приведены на рис.1.
 |
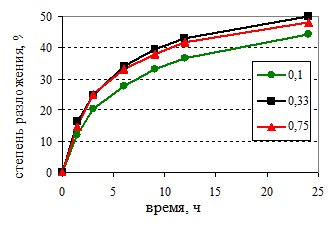 |
Рис.1. Кинетика декомпозиции алюминатных растворов с различной мольной долей К2O
Морфологические исследования проводились с использованием оптического микроскопа OLYMPUS, полученные микрофотографии (для части проб) представлены на рис.2.
|
1 |
2 |
3 |
4 |
|
|
|
|
|
Рис.2. Микро фотографии затравочного гидроксида алюминия и продуктов осаждения из растворов с различной мольной долью К2О.
1 - затравочный гидрат, 2 - мольная доля К2О = 1, 3 - мольная доля К2О = 0,5, 4 - мольная доля К2О = 0
Полученные результаты устанавливают ряд новообразований по сравнению с затравочным гидроксидом алюминия, но основное количество частиц сохраняет исходную морфологию, что говорит об их устойчивом росте. Лишь для образцов, полученных при nK = 1,0, т.е. в системе К2О-Al2O3-H2O, наблюдается значительная перекристаллизация твёрдой фазы с измельчением по отношению к исходной затравке.
Определение среднего диаметра частиц гидроксида алюминия методом лазерного рассеяния позволяет провести сопоставление этого показателя со степенью разложения раствора. Полученные зависимости для декомпозиции растворов с затравкой байеровского типа приведены на рисунке 3. Здесь наблюдается отчетливая корреляция роста среднего диаметра частиц с уменьшением степени разложения и наоборот. При этом, характерной особенностью данной зависимости является нелинейный характер изменения показателей декомпозиции в широком диапазоне nK с отчётливым максимумом степени разложения при nK = 0,33.
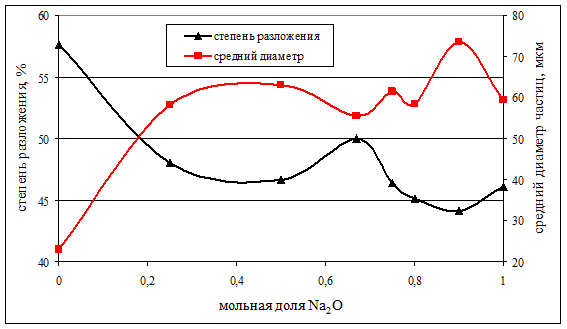
Рисунок 3 - Корреляция среднего медианного диаметра части гидроксида алюминия и степени осаждения Al2O3 при декомпозиции алюминатных растворов на затравке байеровского типа для длительности процесса 24 часа
Решение задачи расчёта постоянных величин и оценки адекватности модели выполнялось с использованием специализированного программного комплекса ReactOp, предназначенного для задач разработки и решения уравнений математических моделей технологических объектов. Расхождение результатов моделирования с экспериментальными данными составило не более 2%.
Выводы
- Соотношение щелочных компонентов в алюминатном растворе представляет собой существенный фактор их декомпозиции, оказывающий влияние на степень разложения и фракционный состав осадка независимо от типа используемой затравки.
- Для широкого диапазона составов алюминатных растворов в системе Na2O-К2О-Al2O3-H2O с nK от 0 до 0,75 морфология осадков достаточно стабильна. Существенные изменения формы кристаллических индивидов гиббсита наблюдаются только при его осаждении из растворов с nK = 1.
- Наименьшая мольная доля K2O в алюминатном растворе, обеспечивающая увеличение степени его разложения, составляет 0,33, а во всём диапазоне составов наблюдаются два максимума по степени разложения. Первый максимум в растворах с мольной долей K2O 0,33, а второй в растворах с nK = 1,0, т.е. в системе К2О-Al2O3-H2O, со степенями разложения соответственно 50 и 58 %.
- современные программные комплексы обеспечивают численное решение уравнений математической модели декомпозиции алюминатных растворов, что делает возможным адекватное описание кинетики этого процесса с помощью двух последовательных стадий осаждения гидроксида алюминия.
Рецензенты:
Иванов С.Л., д.т.н., профессор кафедры Машиностроения, Федеральное государственное бюджетное образовательное учреждение высшего профессионального образования «Национальный минерально-сырьевой университет «Горный», г. Санкт-Петербург.
Дубовиков О.А., д.т.н., доцент кафедры Печных технологий и переработки энергоносителей, Федеральное государственное бюджетное образовательное учреждение высшего профессионального образования «Национальный минерально-сырьевой университет «Горный», г. Санкт-Петербург.







