Введение
Совместный водный раствор аммиака и хлорида аммония эффективно экстрагирует соединения переходных металлов, образующих растворимые аммиачные комплексы (медь, цинк и др.), из отвалов рудников и отходов цветной металлургии [2, 4]. Переработка в качестве вторичного сырья техногенных отходов имеет значение для экономики и актуальна с точки зрения уменьшения загрязнения окружающей среды солями тяжёлых металлов. Для выделения соединений металлов из экстракта аммиак отгоняют, что разрушает аммиачные комплексы и приводит к осаждению оксидов и гидроксидов извлекаемых металлов.
Для определения условий извлечения соединений переходных металлов аммонийно-аммиачным раствором и минимизации потерь аммиака при его отгонке необходимо знание зависимости парциального давления аммиака (PNH3) над этим раствором от его состава. Значения давления аммиака над аммиачной водой, не содержащей солей, табулированы [6], однако в литературе нет алгоритма расчёта PNH3 по составу, позволяющего вычислить PNH3 при концентрации аммиака, не включённой в справочные таблицы.
Фрагментарные данные для аммонийно-аммиачных растворов [7] позволяют считать, что при близких к насыщению концентрациях NH4СI равновесная моляльность аммиака в растворе растёт в изобарно-изотермических условиях с ростом концентрации NH4СI. Это соответствует редко наблюдаемому в системе: «Вода, растворённый газ, соль» всаливанию газа». Известно [2, 3] PNH3 над аммонийно-аммиачными растворами в ограниченном интервале концентраций NH4СI и NH3, но отсутствует методика расчёта PNH3 над раствором по данным о его составе без измерения давления аммиака над раствором заданной концентрации.
Влияние концентрации соли на растворимость газов в водном растворе электролита в изобарно-изотермических условиях адекватно описывает уравнение Сеченова [1]:
lgC = lgC0 – k C2 (1)
В уравнении (1) С − растворимость газа; индекс 1 относится к водно-солевому раствору, индекс 0 – к воде; k − коэффициент Сеченова; C2 − концентрация соли, обычно уменьшающей растворимость газа. Концентрации компонентов целесообразно выражать через их моляльность [1]. Коэффициент Сеченова для раствора NH3 и NH4Cl в воде неизвестен; в тоже время его значения индивидуальны для каждой системы «Вода, растворённый газ, соль» и не могут быть определены априорно.
Цель работы
Изучение зависимости парциального давления аммиака над совместным водным раствором аммиака и хлорида аммония от концентрации его компонентов и разработка методики расчета численных значений PNH3 по составу и температуре раствора, применимого в интервале концентраций аммиака и хлорида аммония до 15% масс.
Методика исследования
Равновесное давление аммиака над совместными растворами в воде аммиака и хлорида аммония определяли динамическим методом, аналогично ранее проведённым исследованиям [2, 3] при концентрациях: аммиака до 10, NH4Cl до 3,5 моль/1000 г воды. Растворы для исследования готовили, растворяя в аммиачной воде, содержащей 5, 10, 15 % масс. аммиака, точно известные навески хлорида аммония. Отклонения содержания аммиака в аммиачной воде от указанных концентраций в отдельных пробах не превосходили ±0,3%. Хлорид аммония вносили навесками по 2, 5, 10 г на 100 мл раствора. Указанные массы навесок хлорида аммония выдерживали с отклонениями не более ±0,1 г. Для расчета C0 − равновесного содержания аммиака в аммиачной воде по величине PNH3 статистически обработаны данные [6, 8] по давлению аммиака над аммиачной водой.
Зависимость C0 от PNH3 аппроксимирована уравнениями:
С0-1 = А1 + B1 PNH3-1 (2)
lgB1 = А2 + B2 T-1 (3)
В уравнениях (2) и (3) С0 выражено в моль/1000г воды, PNH3 − в кПа, температура в К. При известных по данным опыта значениям температуры, PNH3, концентраций хлорида аммония и аммиака вычисляли последовательным решением уравнений (3), (2) и (1) коэффициент k в уравнении Сеченова.
Результаты исследования
В таблице 1 частично представлено сопоставление литературных данных [6, 8] по равновесным концентрациям аммиака (СNH3(Э)) и расчетным значениям СNH3(Р), найденными решением уравнений (2) и (3) для указанных в литературе величин РNH3 над аммиачной водой. Значение ∆ равно относительному отклонению величин СNH3(Р) от опытных данных.
Таблица 1. Экспериментальные и расчетные значения содержания аммиака в аммиачной воде
|
Темпе-ратура, К |
РNH3, кПа |
Растворимость NH3, моль/1000 г Н2О |
∆, % |
Темпе-ратура, К |
РNH3, кПа |
Растворимость NH3, моль/1000 г Н2О |
∆, % |
||
|
экспери- мент |
расчет |
экспери- мент |
расчет |
||||||
|
273 |
1,520 |
2,914 |
2,889 |
–0,84 |
313 |
3,213 |
0,938 |
0,956 |
+1,98 |
|
3,306 |
5,924 |
5,811 |
–1,91 |
8,106 |
2,349 |
2,332 |
–0,72 |
||
|
8,530 |
11,790 |
12,080 |
+2,47 |
17,730 |
4,673 |
4,780 |
+2,38 |
||
|
10,990 |
14,350 |
14,590 |
+1,66 |
36,400 |
8,790 |
8,761 |
–0,33 |
||
|
15,330 |
17,470 |
17,870 |
+2,33 |
53,660 |
11,790 |
11,590 |
–1,74 |
||
|
25,530 |
23,560 |
23,160 |
–1,70 |
77,060 |
15,490 |
15,020 |
–3,06 |
||
|
293 |
1,600 |
1,176 |
1,150 |
–2,19 |
333 |
18,250 |
2,360 |
2,404 |
+1,74 |
|
3,320 |
2,349 |
2,318 |
–1,33 |
28,780 |
3,600 |
3,668 |
+1,90 |
||
|
7,493 |
4,920 |
4,889 |
–0,63 |
40,050 |
4,962 |
4,933 |
–0,58 |
||
|
15,200 |
8,790 |
8,850 |
+0,68 |
50,080 |
6,082 |
5,990 |
–1,36 |
||
|
22,130 |
11,790 |
11,750 |
–0,34 |
77,730 |
8,790 |
8,616 |
–1,98 |
||
|
30,260 |
14,700 |
14,550 |
–1,02 |
111,20 |
11,740 |
11,318 |
–3,59 |
||
Таблица 2 содержит коэффициенты А1, А2 и B2, определённые по методу наименьших квадратов. Данные таблицы 1 доказывают адекватность описания зависимости равновесной концентрации аммиака в растворе от его парциального давления с помощью уравнений (2) и (3). Средняя ошибка расчёта СNH3(Р) по отношению к опытным значениям составляет 1,7%.
Таблица 2. Численные значения коэффициентов регрессии в уравнениях (2) и (3)
|
Наименование коэффициента регрессии |
А1 |
А2 |
B2 |
|
Численная величина коэффициента регрессии |
0,024 |
6,15432 |
−1764,8 |
Из приводимых в таблице 3 результатов, выполненных в настоящей работе измерений PNH3 над совместными растворами аммиака и хлорида аммония в воде, видно, что с ростом моляльности NH4Cl при близких по величине концентрациях аммиака PNH3 возрастает. Таким образом, в изученной системе в области умеренных концентраций наблюдается эффект высаливания. Отметим, что коэффициент Сеченова, вычисленный по опытным данным, закономерно уменьшается с ростом содержания в растворе хлорида аммония.
Таблица 3 . Давление аммиака и значения коэффициента Сеченова для изученных водных растворов аммиака и хлорида аммония
|
№ опыта |
Моляльность NH4Cl |
PNH3, кПа |
Коэффициент Сеченова |
|||
|
NH3 |
NH4Cl |
экспе-римент |
расчёт |
экспе-римент |
расчёт |
|
|
1 |
3,148 |
0,202 |
5,179 |
5,204 |
0,232 |
0,2415 |
|
2 |
3,098 |
0,403 |
5,452 |
5,545 |
0,184 |
0,2006 |
|
3 |
3,064 |
1,006 |
6,093 |
6,211 |
0,122 |
0,1295 |
|
4 |
3,005 |
2,011 |
6,020 |
5,642 |
0,0629 |
0,05920 |
|
5 |
3,101 |
3,003 |
4,921 |
4,899 |
0,0110 |
0,0104 |
|
6 |
6, 580 |
0,426 |
13,21 |
13,35 |
0,188 |
0,1968 |
|
7 |
6,539 |
1,091 |
15,79 |
12,55 |
0,130 |
0,1220 |
|
8 |
6,508 |
2,189 |
14,40 |
14,14 |
0,0525 |
0,0494 |
|
9 |
6,505 |
3,208 |
10,61 |
10,598 |
0,0020 |
0,0018 |
|
10 |
10,40 |
0,222 |
21,705 |
22,10 |
0,211 |
0,2365 |
|
11 |
10,38 |
0,433 |
24,98 |
24,47 |
0,210 |
0,1957 |
|
12 |
10,21 |
1,190 |
28,99 |
28,3 3 |
0,1192 |
0,1139 |
|
13 |
10,16 |
2,35 |
24,25 |
24,66 |
0,0425 |
0,0410 |
|
14 |
10,09 |
3,473 |
16,22 |
16,41 |
−0,010 |
−0,0089 |
Из рисунка 1, иллюстрирующего зависимость коэффициента Сеченова от mNH4Cl , видно асимптотическое приближение величины этого коэффициента к нулю с ростом концентрации NH4Cl.
Зависимость k от m NH4Cl отвечает уравнению:
lg k = 0,4 − 0,27 (mNH4Cl)0,333 (4)
Данные таблицы 3 показывают удовлетворительную сходимость величин коэффициентов Сеченова, вычисленных по данным опытов и рассчитанных по уравнению (4). Еще меньше относительная разница между опытными и расчетными значениями давления аммиака над аммонийно-аммиачным раствором. Величина PNH3 в этом случае вычислена по расчетным значениям коэффициента Сеченова, приведенным в таблице 3 последовательным решением уравнений (1), (3) и (2).
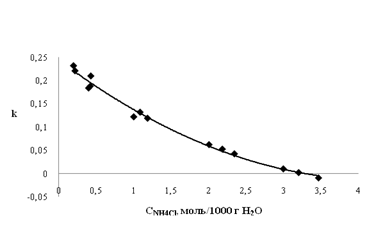
Рисунок 1. Зависимость коэффициента Сеченова от концентрации NH4Cl в растворе
Система уравнений (1) − (4) может быть решена как по отношению к равновесному содержанию аммиака в растворе по известной или заданной величине РNH3, так и по отношению к величине равновесного парциального давления аммиака над изученными растворами, если концентрации аммиака и NH4Cl моль/1000г воды известны. Среднее отклонение расчётных величин РNH3, вычисленных по уравнениям (1) − (4), от опытных данных равно ±1,7% при отсутствии расчётных ошибок, более чем вдвое превышающих среднюю величину.
Представленные уравнения обеспечивают точность расчёта парциального давления аммиака над совместными водными растворами аммиака и хлорида аммония достаточную для определения возможных потерь аммиака при его отгонке из раствора, использованного для извлечения цветных металлов из техногенных отходов.
Зависимость коэффициента Сеченова от моляльности NH4Cl связано с существенными отличиями системы: «Вода, хлорид аммония, аммиак» от других водно-солевых систем, в которых растворён газ. Во-первых, мольная доля аммиака в данной системе при изученных концентрациях достигает 0,145, в то время как в типичных системах, на основании изучения которых выведено уравнение Сеченова, мольная доля растворённого газа не превышает 10-4 – 10-3. В изучаемой системе структура воды заметно нарушена растворением аммиака, и влияние хлорида аммония на деструктуризацию воды не может не уменьшаться с ростом его концентрации. Во-вторых, известна способность аммиака к нестойкой связи с ионом аммония, проявляющаяся в уменьшении РNH3 над раствором нитрата аммония в жидком аммиаке по сравнению с давлением над жидким аммиаком [7]. Названные факторы ведут к уменьшению влияния NH4Cl на растворимость аммиака в воде по мере роста моляльности соли.
Анализ литературных данных по системе: «Вода, аммиак, хлорид аммония» [6] при давлении аммиака 101,325 кПа показывает, что моляльные концентрации аммиака и хлорида аммония в совместных аммонийно-аммиачных растворах существенно выше, чем в соответствующих бинарных системах. Так, моляльная концентрация NH4Cl в насыщенном водном растворе составляет при 293 К 11,07 моль/1000г воды, а в насыщенном аммонийно-аммиачном растворе достигает 20,05 моль/1000г воды, моляльная концентрация аммиака при той же температуре и РNH3 равном 101,325 кПа в аммиачной воде составляет 35 моль, а в насыщенных по NH4Cl, лежит в интервале 37−54,1 моль/1000г воды. Вычисленные нами по данным [6] коэффициенты Сеченова лежат в интервале минус 0,01 − 0,011. Таким образом, данные, полученные ранее для растворов, насыщенных по хлориду аммония, при РNH3, равном 101,325 кПа, подтверждают рост равновесной концентрации аммиака в расчёте на 1000 г воды в совместном растворе аммиака и хлорида аммония с ростом его моляльности по NH4Cl. Следует отметить, что расчёт по уравнению (4) даёт существенно большие по модулю значения коэффициента Сеченова. Можно предполагать, что расхождения по численной величине коэффициента Сеченова связаны с тем, что концентрации аммиака и NH4Cl в растворах, данные по которым приведены в литературе [7], лежат далеко за границей полной гидратации, в то время как нами исследованы растворы, представляющие практический интерес, в которых мольная доля воды существенно больше 50%.
Выводы
- Изучена зависимость парциального давления аммиака над совместным водным раствором аммиака и хлорида аммония при концентрациях неводных компонентов раствора до 15% масс.
- Установлено наличие при мольных концентрациях хлорида аммония до 3,3 моль/1000г воды эффекта высаливания аммиака хлоридом аммония, проявляющееся в увеличении парциального давления аммиака над совместным раствором аммиака и хлорида аммония по сравнению с изоконцентрационной по аммиаку аммиачной водой.
- Представлены расчётные уравнения, обеспечивающие расчёт парциального давления ммиака над не содержащей растворённых солей аммиачной водой и совместным раствором аммиака и хлорида аммония.
- Установлено уменьшение численной величины коэффициента Сеченова для совместного раствора аммиака и хлорида аммония с ростом моляльности NH4Cl.
Рецензенты:
Ульянов В.М., д.т.н., профессор кафедры «Машины и аппараты химических и пищевых производств» ДПИ НГТУ им. Р.Е. Алексеева, г. Дзержинск.
Когтев С.Е., д.т.н., профессор, директор по развитию производства ООО «Синтез–ПКЖ», г.Дзержинск.



