Актуальность
Острые гнойно-деструктивные заболевания легких (ОГДЛ) являются одной из сложных проблем торакальной хирургии [3, 8]. До настоящего времени не отмечено тенденции к уменьшению частоты острых абсцессов легких, а, наоборот, многие авторы констатируют увеличение случаев тяжелого и осложненного течения заболевания [5, 6, 10, 11, 12]. Удельный вес абсцессов легких, осложненных пиопневмотораксом, кровотечением, сепсисом, вырос за последние годы с 15,8% до 43,6% [7, 11, 13]. Несмотря на успехи в лечении легочных деструкций, летальность при них варьирует от 1,6% до 15,6%, а при осложненных формах возрастает до 54% [5, 11].
Комплексное лечение, по данным разных авторов, позволяет достигнуть полного выздоровления у 13,7-70% больных, клинического излечения с образованием остаточной тонкостенной полости у 22-49% [14]. Необходимость дальнейших поисков новых подходов к лечению острых абсцессов и гангрены легкого диктуется неудовлетворительными результатами, относительно высокой летальностью при хирургическом лечении.
На большом количестве клинических наблюдений была разработана схема лечения острых абсцессов и гангрены легкого (рис. 1). Она включает три этапа: интенсивную терапию и реанимацию, консервативное лечение, реабилитацию.
Интенсивная терапия и реанимация направлены на восстановление основных гемодинамических параметров, их стабилизации, восстановление микроциркуляции (плазмаферез, криоплазменно-антифермантная терапия), антибиотикотерапию, дренирование гнойников, устранение нарушений функции сердца, легких, печени, почек, тканевой гипоксии, детоксикацию и т.д.
Консервативное лечение включало антибиотикотерапию, дренирование гнойников, санацию бронхиального дерева, устранение анемии и т.д.
Показания к операции возникали на разных этапах лечения.
С целью оптимизации технологии лечения больных острыми абсцессами и гангреной легких разработан ступенчато-блоковый метод их ведения. Суть метода заключается в определении ключевого блока патогенетических проблем на каждом этапе ведения больного и применении оптимального комплекса методов лечения соответствующих этому блоку, т.е. ступени лечения.
Выделены следующие блоки проблем:
- индукция инфекционно-воспалительного процесса, формирование гнойной полости;
- естественное дренирование гнойных полостей;
- системная интоксикация, системные нарушения витальных функций;
- органные нарушения морфологии и функции, полиорганная недостаточность;
- блок проблем репарации, перехода воспалительного процесса в хронический;
- определение показаний к хирургическому лечению.
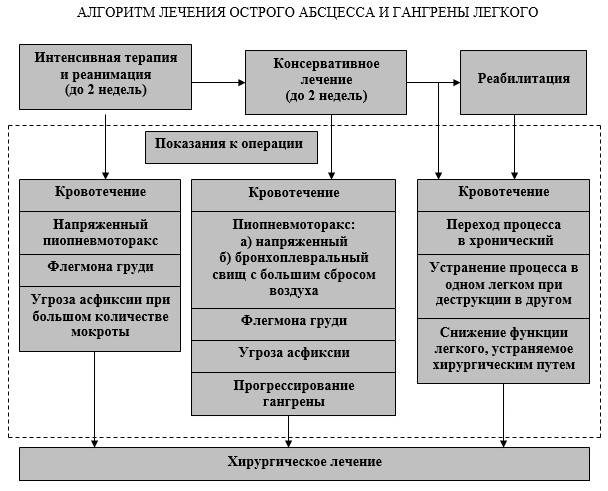
Рис. 1. Алгоритм лечения острого абсцесса и гангрены легкого
Предложены методы обследования, позволяющие получать дополнительные диагностические критерии ведущего блока проблем и оценивать риск "применения-неприменения" методов лечения соответствующей ступени. К таким методам, в частности, относятся количественное определение СРБ, D-Димера, ферритина, фолата плазмы крови и агрегационной активности тромбоцитов [21]. Структурированный подход к диагностике и лечению позволяет оптимизировать технологию ведения данных больных.
При исследовании кровотока в пораженном и пограничных участках легкого у всех больных было установлено снижение его интенсивности. На сканограмма легких у всех больных наблюдалось уменьшение интенсивности микроциркуляции в зоне деструкции легкого. При этом у 92% больных зона снижения изотопа в легком значительно превышала размеры рентгенологически выявляемого затемнения. Не вызывает сомнения то обстоятельство, что нарушения микроциркуляции в пораженном легком являются серьезным препятствием для поступления в очаг поражения антибиотиков.
Становится очевидным, что прогресс в лечении острых гнойно-деструктивных заболеваний легких может быть достигнут, если добиться существенного улучшения микроциркуляции вокруг патологического очага. Для разработки патогенетически рациональной терапии необходимо более глубокое изучение механизмов, приводящих к нарушению микроциркуляции. Основной причиной нарушения микроциркуляции вокруг патологического очага являются развитие ДВС-синдрома и блокада микрососудов тромбами и агрегатами клеток крови. В связи с этим при исследовании генеза блокады микроциркуляции существенное внимание было уделено патологии коагуляции и фибринолиза.
Развивающийся инфекционно-воспалительный процесс вначале сопровождается локальным обратимым блоком микроциркуляции, который может перейти в локальный микротромбоз (рис. 2). Его диагностическим критерием является тромбинемия (Ха-активность). Дальнейшее прогрессирование процесса связано с ДВС-синдромом.
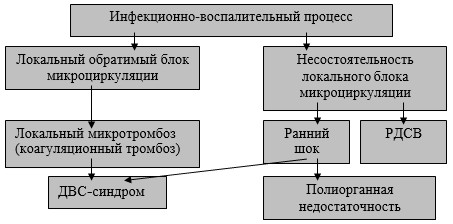
Рис. 2. Нарушения микроциркуляции при гнойно-деструктивных процессах в легком (I)
При нем коагуляционная тромбинемия (активация фактора IIа) сочетается с агрегацией тромбоцитов.
Если в начале развития инфекционно-воспалительного процесса в легком имеет место несостоятельность локального блока микроциркуляции, то развивается ранний шок или РДСВ. Развившийся шок также может привести к ДВС-синдрому или полиорганной недостаточности.
ДВС-синдром может проявляться преимущественно локальным блоком легочной микроцикуляции или диффузным ее блоком (рис. 3).
Этот сопутствующий гнойно-деструктивным процессам ДВС-синдром проявляется не только взрывом протеолиза в крови, но и блокадой микроциркуляции в органах, в том числе и в легких, развитием в них гипоксии, нарушением диффузионной способности легких и тканевой дезорганизации, нарушением диффузионной способности легких: нарастанием гипоксии и общей интоксикации [2, 9].
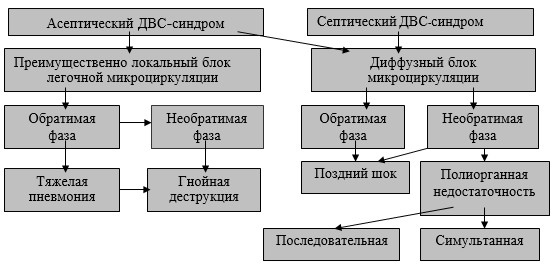
Рис. 3. Нарушения микроциркуляции при гнойно-деструктивных процессах в легком (II).
Для обеспечения поступления лекарственных препаратов в очаг легочной деструкции в период превалирования тромбинемии (Ха-активность) необходимо сочетать антибиотикотерапию с противотромботической терапией (низкомолекулярными гепаринами: нордапарином, клексаном, фрагмином).
Сочетание коагуляционной тромбинемии (активация фактора IIа) с активацией агрегации тромбоцитов требует антикоагулянтного и антитромбоцитарного воздействия (анти-IIа активность).
При развитии ДВС-синдрома у больных острым абсцессом и гангреной легкого представилось целесообразным испытать при острых инфекционных деструктивных заболеваниях легких, примененные ранее при терапии тромбофилий [2], трансфузии свежезамороженной плазмы в качестве донатора всех необходимых проферментов и их естественных ингибиторов, в том числе антитромбина III, плазминогена и его активаторов, в сочетании с антипротеазами: гепарином и контрикалом (гордоксом) в достаточно больших дозах. При этом преследовалась цель добиться не только купирования ДВС-синдрома с ослаблением гипоксии органов и интоксикации, но и возможно более быстрого деблокирования микроциркуляции в легких, восстановления их дыхательной функции, повышение доступности очагов инфекционной деструкции по отношению к антибиотикам, купирование протеолиза в тканях.
Свежезамороженная плазма переливалась нами в объеме от 250 до 600 мл в сутки. Гепарин вводился по 2500-5000 ед. в подкожную клетчатку параумбиликальной зоны через 6 часов, а контрикал - по 100000 ед. в сутки. У особо тяжелых больных доза контрикала и увеличивалась до 200000 ед. в сутки Указанные дозы препаратов вводились в течение 3-10 дней. В последующем осуществлялось переливание свежезамороженной плазмы 2-3 раза в неделю по 250-600 мл и вводился гепарин.
Антипротеазы в больших дозах целесообразно применять при превалировании гипокоагуляции, гиперфибринолизе и геморрагии, а не ишемических проявлений.
С целью улучшения исходов заболевания у больных с абсцессом и гангреной легкого, наряду с криоплазменно-антиферментным комплексом, на фоне традиционной терапии применен лечебный плазмаферез.
Сеансы лечебного плазмафереза проводились ежедневно до улучшения общего состояния и его стабилизации, устранения или резкого уменьшения интоксикации.
Относительным противопоказанием для проведения плазмафереза являлись выраженная гиповолемия, нестабильность гемодинамики, тромбоцитопения, гипопротеинемия.
Ликвидация ДВС-синдрома и деблокирование микроциркуляции с помощью переливания массивных доз свежезамороженной плазмы (СЗП), гепарина и введение ингибиторов протеаз [10] резко снизили летальность и значительно улучшили исходы лечения острого абсцесса и гангрены легкого.
Фоновое состояние организма, т.е. состояние, предшествующее развитию острой гнойной деструкции легких, обычно остается неизвестным врачу, хотя оказывает значительное влияние на клинику острого воспалительного процесса. Существует аспект проблемы, с одной стороны, хорошо известный, с другой стороны, мало изученный - это анемия развивающаяся у больных с тяжелой интоксикацией инфекционно-воспалительного генеза. Длительность жизни эритроцита, в среднем 120 дней, позволяет сформировать некоторую ретроспективу состояния больного. Изучая морфо-функциональные особенности эритроцита, врач получает важную информацию, отражающую не только настоящий статус, но и состояние, имевшее место в предшествующий промежуток времени.
Наиболее изученной является анемия воспалительных заболеваний, обусловленная железодефицитом перераспределительного характера. Незначительная часть больных острыми абсцессами легких поступает с анемией микроцитарно-гипохромного типа, что позволяет предполагать наличие железодефицита у этих больных, имевшего место, как минимум в течение нескольких месяцев, предшествующих заболеванию. Но для большинства больных присущ умеренный и выраженный анизо- и пойкилоцитоз, не всегда сопровождающийся гипохромией. Этого достаточно для того, чтобы усомниться в ведущей роли железодефицита у больных острой гнойной деструкцией легких.
Анемия оказывает непосредственное влияние на состояние иммунной системы, в связи с чем нами была предпринята попытка углубленного обследования больных острыми абсцессами и гангреной легких, позволяющего расширить представления о характере анемии. Независимо от уровня гемоглобина исследовалось содержание в плазме крови больных ферритина, фолата и витамина В12, объемные показатели эритроцита, содержание и распределение в нем гемоглобина [1, 4]. Исследование выполнено с помощью автоматического анализатора Е1ехуs 2010, реагенты "Roche" и гематологического анализатора МЕК 6400.
У всех больных снижался RBC и концентрация HGB, что указывает на уменьшение кислородной емкости крови. Уровень гемоглобина -в группе из 102 человек при поступлении был менее 120 мг/л у 81% больных, средний уровень (М) составил 107,8 мг/л. Ферритин плазмы крови (n-87) был в пределах нормы, медиана (Ме) и интерквартильный размах (IQ) составили 179,6 нг/мл (от 104,0 до 268,8 нг/мл). Диапазон нормальных значений от 13,0 до 400,0 нг/мл. Фолат плазмы крови (n-57) имел значительно более низкие значения, чем в группе условно здоровых доноров (М-2,67 нг/мл, s-0,87 против М-7,70 нг/мл, s-3,2, р<0,001). Выраженный дефицит витамина В-12 (менее 20 пг/мл) наблюдался только у 2 пациентов из 50 (n). Ме-561,2 пг/мл; IQ - от 397,5 до 1117,0 пг/мл (норма от 240 до 900 пг/мл).
По результатам исследования можно предположить, что железодефицит, хотя и наблюдается у части больных ОГДЛ, но не имеет ведущего значения, тогда как дефицит фолатов может играть критически важную роль в развитии анемии и патогенезе ОГДЛ.
В течение 1980-2007 годов в Алтайском краевом пульмонологическом центре находилось на лечении 2801 больных острым абсцессом и гангреной легкого. У 2397 (85,6%) из них были абсцессы легких без секвестрации, у 178 (6,3%) с секвестрацией. Гангрена легких была у 226 (8,1%) пациентов.
Наиболее частыми осложнениями были пиопневмоторакс и эмпиема плевры, отмеченные у 15,4% и 12,1% больных соответственно. Несколько реже наблюдались легочные кровотечения (у 3,7% больных) и легочные кровохарканья (у 1,5% больных), флегмона грудной стенки (у 3,6% больных).
Среди анализируемых больных было 88,3% мужчин и 11,7% женщин. Больные острым абсцессом и гангреной легкого были в возрасте от 17 до 82 лет.
Более половины больных поступила в клинику через 2-4 недели от начала заболевания.
У 94,9% больных было одностороннее поражение легких, а у 5,1% - двустороннее. У большинства больных было заболевание правого легкого. В правом легком превалировали поражения верхней доли, в левом - нижней. Поражение всего правого легкого отмечалось чаще, чем поражение двух долей левого легкого.
У 51,1% больных течение заболевания характеризовалось средней степенью тяжести, у 34,7% - тяжелой, у 6,8% - крайне тяжелой. Удовлетворительным состояние было у 7,3% больных. Поступили в клинику в сопорозном состоянии 28 пациентов.
Крайне тяжелое состояние отмечено, прежде всего, у больных гангреной легкого и при двусторонних поражениях.
Сопутствующие заболевания и состояния наблюдались у 314 (11,2%) из 2801 больного острым абсцессом и гангреной лёгкого. Среди них на уровне 1,8-1,9% отмечены бронхиальная астма и ХОБЛ, сахарный диабет, ИБС. Другие заболевания имели частоту менее 1%.
У больных были проведены 234(8,4%.) оперативных вмешательств: лобэктомия - у 90(38,5%) больных, пневмонэктомия - у 43(18,4%), плевропневмонэктомия - у 24(10,3%), билобэктомия - у 13(5,5%), сегментэктомия - у 7(3,0%), декортикация легкого с субтотальной париетальной плеврэктомией - у 23(9,8%), плевролобэктомия - у 5(2,1%), декортикация легкого с атипической резекцией легкого - 24(10,3%), пневмотомия - у 3 (1,3%), абсцессэктомия - у 1(0,4%).
У 44 (18,8%) больных в послеоперационном периоде были осложнения. Характер осложнений был следующий: бронхоплевральный свищ с эмпиемой плевры - у 17(7,7%) больных, нагноение шва с развитием флегмоны грудной стенки - у 1(0,4%), разрыв диафрагмы во время операции - 1(0,4%), послеоперационное внутриплевральное кровотечение у - 5(2,1%), эмпиема плевры - у 6(2,6%), пневмония контрлатеральная - у 10(4,3%), хондроостеомиелит ребра - у 1(0,4%), асфиксия после операции - у 1(0,4%), нагноение послеоперационного шва - у 1(0,4%), ТЭЛА - у 1(0,4%).
После проведенного комплексного консервативного и оперативного лечения полное и клиническое выздоровление было достигнуто у 70,6% больных (табл. 1). Летальность составила 3,7%. Переход процесса в хронический отмечен у 22,7% пациентов.
Исходы лечения больных острым абсцессом и гангреной легкого зависели от применения методов лечения (табл. 2). При консервативном методе лечения больных острым абсцессом и гангреной легкого полное выздоровление наступило у 34,7% больных, клиническое выздоровление - у 34,8% пициентов, переход процесса в хронический - у 27,9% больных. Летальность оставила 3,0%. При комплексном лечении, включавшем оперативный метод, полное выздоровление наступило у 81, 1% больных, клиническое выздоровление у 6,0% пациентов, переход процесса в хронический - у 2,1% больных. Летальность составила 10,7%. Операция, проведенная после отсутствия эффекта от консервативного лечения, позволила увеличить число больных с полным выздоровлением на 46,8% (р<0,001), но при этом возросла летальность на 7,7% (р<0,01).
Таблица 1
Исходы лечения у больных острыми абсцессами и гангренами легких
|
Исходы лечения |
Абс. число |
% |
|
Полное выздоровление |
1072 |
38,3 |
|
Клиническое выздоровление |
905 |
32,3 |
|
Хронизация процесса |
721 |
25,7 |
|
Умерли |
103 |
3,7 |
Таблица 2
Исходы лечения больных острым абсцессом и гангреной легкого в зависимости от метода лечения (n - 2801)
|
Исходы лечения |
Всего |
Методы комплексного лечения |
|
||||||
|
консервативный |
хирургический |
Р |
|
||||||
|
абс. число |
% |
абс. число |
% |
абс. число |
% |
|
|||
|
Полное выздоровление |
1071 |
38,2 |
882 |
34,3 |
189 |
81,1 |
<0,001 |
|
|
|
Клиническое выздоровление |
906 |
32,3 |
892 |
34,7 |
14 |
6,0 |
<0,001 |
|
|
|
Переход процесса в хронический |
721 |
25,7 |
716 |
27,9 |
5 |
2,1 |
<0,001 |
|
|
|
Умерли |
103 |
3,7 |
78 |
3,0 |
25 |
10,7 |
<0,01 |
|
|
|
Всего |
2801 |
100,0 |
2568 |
100,0 |
233 |
100,0 |
|
|
|
Таким образом, комплексное лечение острого абсцесса и гангрены легкого с применением криоплазменно-антиферментной терапии, методов местного лечения, внедрение метода ступенчато-блокового ведения больных уменьшает летальность и улучшает непосредственные и отдаленные результаты заболевания.
Рецензенты:
Лубянский В.Г., д.м.н., профессор, зав. кафедрой госпитальной хирургии, ГБОУ ВПО АГМУ Минздрава России, г. Барнаул.
Цеймах Е.А., д.м.н., профессор, зав. кафедрой оперативной хирургии и топографической анатомии, ГБОУ ВПО АГМУ Минздрава России, г. Барнаул.



