В течение длительного времени внимание многих исследователей приковано к проблеме возникновения жизни и к эволюционной теории [1]. Принято считать, что одним из важных элементов для понимания процессов зарождения и развития жизни на Земле является тщательное изучение взаимодействия молекулы с инертными материалами [2].
Обычно биометаллы локализованы в активном центре ферментных систем и, по-видимому, одним из факторов зарождения жизни около 3,5 млрд.лет назад (начало биологической эволюции) было образование хиральной молекулы при взаимодействии биометалла непеременной валентности с относительно инертным ионом из активного центра с ахиральным субстратом. В качестве модели изучения субстрата с ионом инертного металла нами изучено электрохимическое поведение цис-плоскоквадратного комплекса цинка (Zn2+) c хинолином (qu). Комплексы этого типа 2qu * ZnCl2, 2qu * Zn(OH)2 и qu * ZnCl2 полученны по методике [3].
Механизм стереоспицифического действия ионов металлов из активного центра металлоферментов с субстратом недостаточно тщательно изучены. хотя это направление является одним из важнейших в современной биоорганической химии и химии координационных соединений.
Материалы и методы
Циклические вольтамперограммы (ЦВА) снимали на патенциометре П-5827 М с источником треугольных импульсов и самописцем ПДП-4 [4,5-7]. Отчистку растворителей (диметилформамид и ацетонитрил) проводили по стандартным методикам. Фоновым электролитом служил перхлорат тетрабутиламмоний, электродом сравнения – водный насыщенный каломельный электрод с асбестовой перегородкой, содержащий гидрооксид алюминия. Концентрация диполяризатора в ЦВА 5x10-3 моль/л, фона – 0,1 моль/л и соединений I-V при записи вольтамперограмм составила 5 10-4 М. ЦВА снимали в атмосфере аргона.
Число электронов элементарных стадий определяли по принципу соотнесения величин предельных токов (1) веществ I и II с таковыми для III и для стандартных исходных соединений, механизм электровосстановления которых хорошо изучен и число электронов для которых равно n1 = 1 и n1 = 2 [5-7].
Исходную навеску комплекса нагревали при 120° до постоянного веса. Одну часть навески сухого остатка подщелачивали 10%-ным водным NaOH до рН 10 и экстрагировали эфиром (5x20), эфирные вытяжки высушивали, отгоняли растворитель и далее остаток анализировали количественно на содержание хинолина газожидкостной хроматографией. Содержание цинка анализировали весовым методом. На основании этих данных исследуемые комплексы I- III отвечали составу ZnCl2 2qu (I) , Zn(OH)2 2qu (II) и ZnCl2 qu (III). Исследуемые комплексные соединения инертны до 1800, выше которого цис-комплексы изомеризуются в транс-комформацию (> 2500 С ∆Н~ 10 кДЖ/моль) [8].
Другую часть сухого остатка весом 0,2445 г (мол.вес 394,3), подвергали термогравиометрическому анализу на приборе ДТА системы Ф. Паули при непрерывном нагревании по стандартной методике[3]. Характеристика прибора: t-200, гелий 20лч, напряжении 80В, программа II ряда, Т-5000, ДТА -1/5 и DTG - 1/10.
Результаты и обсуждение
Комплексы состава I и II, электрохимически восстанавливаются в пределах чувствительности прибора (патенциостата и самописца) в две стадии: первая и вторая формально в одну двухэлектронные (2е). В этих же условиях комплекс состава qu ZnCl2 II) восстанавливается в одноэлектронную стадию (1е).
Первые 2е-потенциалы для I и II частично обратимы (-∆Епк=0,68 В и -∆Епк=0,58 В соответственно),а 1е -потенциал (III) практически необратим (-∆Епк= 0,50 В) и, по-видимому, относятся к заряженным формам хинолина, так как этот показатель почти совпадает с потенциалом соли бромистого N этилхинолиния (V) - ∆Епк= 0,56 В (iпк = 1 5 мкА).
Вторые 2е-стадии восстановления соответствуют нейтральной форме хинолина в комплексах I и II, что следует из совпадения экспериментального значения ∆Епк=2,2В с литературными: хинолин в ДМФА дает две последовательные 1е-ступени в интервале ∆Епк= 2,0-2,6В [4]. При этом для комплекса III выявлено малое значение предельного тока этой полностью необратимой величины, что свидетельствует о малой устойчивости восстановленных незаряженных форм (табл. и рис. 1).
Потенциал ∆Епк=1,74В (табл.) относится к хлориду цинка, что предварительно доказано из отнесения ∆Епк=0,94В для хлорида цинка от концентрации qu
Методом рентгеновской дифракции ранее было показано [9], что лиганды [L] в комплексе упаковываются в плоскости скользящего отражения на расстоянии в 3,48А0, достаточного для проявления сильного электростатического напряжения, так и через 3,84 А0, для которого это действие проявляется незначительно. При термическом воздействии на комплексы I и II от 260 до 3500происходит полное отщепление одного из 2-х лиганд [3]. В тех же условиях лиганд (qu) из комплекса состава qu ZnCl2 (III) не отщепляется, что указывает на не эквивалентный характер связи 2qu с ионом цинка в I и II.
Из приведенных выше экспериментальных результатов (табл. 1 и рис. 1), можно было заключить, что 2-х электронные потенциалы восстановления относятся к каждой ионизированной лиганде в комплексах состава I и II (например, L1).Тогда вторые 2-е стадии восстановления должны соответствовать нейтральной форме L2 в этих же комплексах.
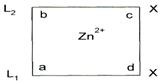
Цис-плоскоквадратный комплекс (А). ( L1 и L2-хинолин (qu); Х=Cl,OH)
Однако подобный вывод не находит экспериментального обоснования, так как хинолин в комплексе состава qu ZnCl2 (III) электрохимически восстанавливается практически только в 1-е стадию. Это касается и солей N- замещенных азинов [10].
Разный характер искажения координиционно-связанных двух даже одинаковых лигандов с центральным ионом металла может быть причиной образования по меньшей мере двух конформационных энантиомеров B и С.
Следовательно, цис-плоскоквадрат-ный комплекс А представляет собой суперпозиционную (рацемическую) молекулу, состоящую из заряженного лиганда L1а в конформационном изомере С и лиганда L2в в B соответственно.
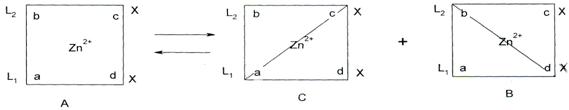
В качестве дополнительного доказательства расщепления рацемической молекулы А на энантиомеры С и B можно привести ассиметричный синтез хирального цинкого комплекса из ахирального
4-сульфо-8-оксихинолина
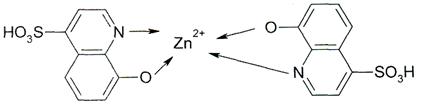
и многочисленные другие факторы оптической активности координационных соединений [8].
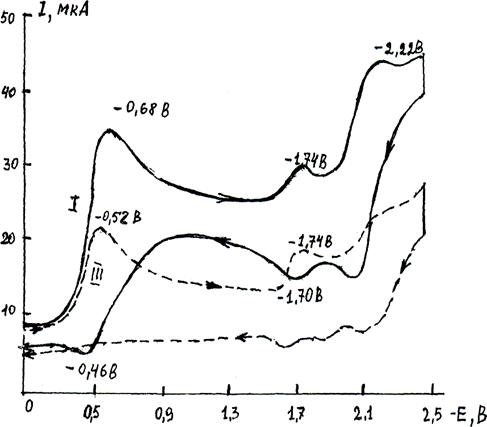
Рис. 1. Циклическая вольтамперограмма восстановления комплексов хинолина с хлоридом цинка состава 2qu * ZnCl2 (I) - сплошная линия и состава qu * ZnCl2 (III) - пунктирная линия
Таблица 1
Электрохимическое восстановление соединений (I— V) методом ЦВА на платиновом дисковом электроде (n-результаты расчета числа электронов,Епк - потенциал восстановления, Епа - потенциал окисления, i - предельный ток)
|
Соединения |
|
Катодная кривая |
Анодная кривая |
|
||
|
№№ |
n |
|
|
∆Епак,В |
||
|
|
|
-Епк,В |
i пк,мкА |
-Епа, В |
i па, мкА |
|
|
|
2,6
|
0,68
|
25,0 |
0,46 |
4,0 |
0,22 |
|
I |
|
1,74 |
3,5 |
1,70 |
1,5 |
0,04 |
|
|
1,65 |
2,22 |
16,0 |
- |
1,5 |
- |
|
II |
2,2 |
0,58 1,74 |
21,5 3,0
|
0,5 1,72 |
12,5 4,0 |
0,08 0,02 |
|
|
1,9 |
2,20 |
18,5 |
-
|
- |
- |
|
III |
1,2 |
0,52 1,74 |
13,0 6,0 |
- -
|
- - --- |
- -
|
|
|
0,5 |
2,16 |
5,5 |
- -- |
- |
- |
|
IV |
0,3 |
0,94 |
3,8 |
- |
7,7 |
- |
|
V |
0,97 |
0,56 |
15,0 |
- |
- |
- |
СПИСОК ЛИТЕРАТУРЫ
1. Галимов Э.М. Феномен жизни. Между равновесием и нелинейностью. Происхождение и принципы эволюции. – М., Едиториал УРСС, 2001.
2. Нанотехнология в ближайшем десятилетии. Прогноз направления исследований / под ред. М.К. Роко. – М.: Мир, 2002.
3. Лохова С.С. Дисерт. канд. хим. наук. – Институт химии АН СССР,1991.
4. Майрановский С.Г., Страдынь Я.П., Безуглый В.Д. Полярография в органической химии – Л.: Химия, 1975.
5. Шейнкман А.К., Скоробогатова З.М., Лукьяненко Л.В. Химия гетероциклических соединений. №3, 367-370 (1982).
6. Сосонкин И.И., Шейнкман А.К., Скоробогатова З.М., Строгов Г.Н., Ихтер Т.П. Химия гетероциклических соединений. №3, 361-366 (1982).
7. Субботка В.А., Сосонкин И.М., Федяйнов Н.В., Куманцов В.И. Химия гетероциклических сокдинений №4, 516 (1978).
8. Кукушкин Ю.Н. Реакционная способность координационных соединений. – Л.: Химия, 1975.
9. Соколова Ю.А., Атомян Л.О., Порай-Кошиц М.А. Журнал структурной химии. Т.7, №6, 856-859 (1966).
10. Страдынь Я.П.,Кадыш В.П., Гиллер С.А. Химия гетероциклических соединений. №12, 1587-1603 (1973).



