Введение
Субстанция 3,3'-дииндолилметан (DIM), благодаря мультитаргетному механизму действия, является широко признанным терапевтическим агентом. Одним из наиболее важных свойств данной субстанции является его противоопухолевая активность, реализуемая за счёт антипролиферативного, проапоптотического и противовоспалительного действия [2-4; 6; 9].
На данный момент рядом авторов проведен ряд доклинических испытаний, подтверждающих противоопухолевый потенциал DIM [3-6]. Однако было выявлено, что субстанция DIM демонстрирует низкую биодоступность в тканях и органах, что усложняет использование всего спектра терапевтических активностей в клинике [1;7]. Недавно нами было проведено сравнительное исследование, целью которого являлась оценка фармакокинетических параметров различных формуляций DIM [8]. Результаты показали низкую биодоступность чистой субстанции DIM, а также его кристаллической формы, вводимых животным перорально в концентрации 200 мг/кг. В то же время в крови экспериментальных животных детектировалась в пять раз более высокая концентрация DIM при использовании жидкой формуляции, вводимой в дозе 0,1 мг/кг.
Поиски путей увеличения биодоступности DIM остаются актуальными. Данное исследование посвящено оценке фармакокинетических характеристик улучшенной формуляции DIM с высокой биодоступностью, содержащей плюроник. Благодаря плюронику F127 – блок-сополимеру оксиэтилена и оксипропилена – достигается солюбилизация водонерастворимого соединения, а также модуляция клеточного P-гликопротеина – транспортного белка, обеспечивающего эффективный перенос веществ. Кроме того, есть данные об усилении противоопухолевых свойств некоторых лекарственных соединений, композиции которых содержат плюроник [10].
Целью данного исследования является сравнение фармакокинетики чистой субстанции DIM и новой фармацевтической композиции на основе DIM, содержащей плюроник, а также оценка их биодоступности.
Материалы и методы
Реагенты. Чистая субстанция DIM; формуляция на основе DIM, содержащая плюроник («Цинетон» - производитель ЗАО «МираксБиоФарма», Россия): Дииндолилметан (0,1 г), Лутрол (0,45 г) (ЗАО «МираксБиоФарма», Россия).
Животные. Исследования проведены на 98 крысах массой 0,22 ± 0,02 кг, полученных из питомника «Рапполово», г. Санкт-Петербург. Животные содержались в стандартных клетках при 12-часовом режиме освещения и свободном доступе к корму и воде. Длительность карантина (акклиматизационного периода) животных составляла 14 дней. В течение карантина проводили ежедневный осмотр каждого животного (поведение и общее состояние). Животные были разделены на 2 группы. Препарат и субстанция вводились внутрижелудочно: в дозе 60 мг/кг - с утра натощак. Стандартное питание животные получали через 2 часа после начала эксперимента.
Сбор и подготовка образцов крови. Забор крови проводился после декапитации животных через: 0,25; 0,5; 1,0; 2,0; 4,0; 6,0; 8,0; и 12,0 часов после введения тестируемой субстанции (по 6 животных на каждую точку в обеих группах). Пробы крови центрифугировали (ОПн – 8 УХЛ4.2, Россия) 15 минут при 3 000 об/мин, отбирали по 1,5–2,0 мл плазмы, замораживали и хранили при –20 °С до анализа. Перед анализом во все образцы плазмы крови в объеме 1 мл добавляли 5 мл этилацетата, а затем центрифугировали 10 мин при 4000 об/мин. Отбирали надосадочный слой, упаривали, добавляли 200 мкл ацетонитрила и аликвоту вводили в хроматограф.
Количественное определение в крови. Анализ проб с целью определения концентрации дииндолилметана в образцах плазмы крови осуществляли методом ВЭЖХ на колонке Ascentis, C18, (4.6 мм ´ 250 мм, 5 мкм) на жидкостном хроматографе LC-20 Prominence (Beckman, США) с УФ-детектором с диодной матрицей SPD M20A (230 нм) (Шимадзу). Элюент: 70% ацетонитрила, 30% водного буфера, содержащего 6 мг додецилсульфата, 0.6 мг кислого фосфорно-кислого калия на 1 л Н2О, рН 5 (H3PO4). Скорость элюирования - 1.0 мл/мин. Хроматографирование проводили при комнатной температуре (22-24 °С).
Для описания фармакокинетики DIM в плазме крови использовалась программа WinNonlin® (Pharsight,USA), с помощью которой были получены следующие показатели: Cmax - максимальная концентрация (мкг/мл), Tmax – время достижения максимума концентрации, T1/2 – период полувыведения (ч), MRT – среднее время удерживания (ч), Vss – стационарный объем распределения (мл/кг). Площадь (AUC) под кривыми зависимости концентрации в плазме от времени (от 0 до ∞) вычисляли с помощью линейного трапецеидального метода.
Статистическая обработка данных. Полученные экспериментальные данные были обработаны статистически помощью пакета Systatw 5 для персонального компьютера. Рассчитывались следующие статистические параметры: среднее арифметическое значение, стандартное отклонение среднего результата, стандартная ошибка среднего, коэффициент вариации (CV). Данные представлены в формате M±m, где M - среднее арифметическое значение, m - стандартная ошибка среднего.
Результаты и обсуждение
По результатам внутрижелудочного введения чистой субстанции DIM был получен фармакокинетический профиль, согласно которому вещество начинало детектироваться в кровотоке через 15 мин, при этом максимум концентрации Cmax достигался через 2 часа после введения и наблюдался около 120 минут (0,21±0,02 мкг/мл). Далее концентрация DIM начинала плавно снижаться, и через 12 часов после введения DIM определялся в крови в минимальных количествах (около 0,06 мкг/мл). T1/2 составило 5,26±0,71 час для субстанции DIM (рис. 1).
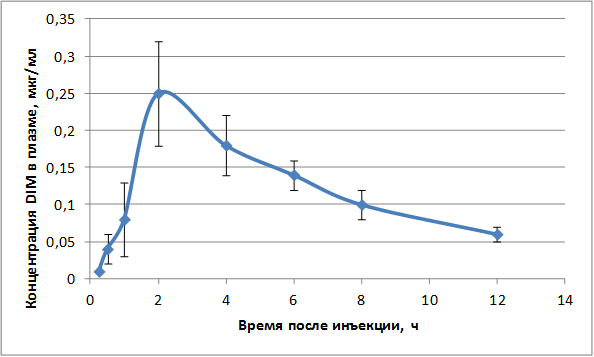
Рис. 1. Усредненная динамика концентрации DIM в плазме крови экспериментальных животных при внутрижелудочном введении субстанции, 60 мг/кг.
Общее среднее время присутствия препарата в организме — показатель MRT составляет порядка 11 часов (11,69±0,55 час). Величина кажущегося стационарного объема распределения — показатель Vss — составляет порядка 357 л/кг. Разброс индивидуальных значений умеренный: коэффициент вариации CV составил 14–55%.
На следующем этапе оценивалась фармакокинетика новой улучшенной фармацевтической композиции на основе DIM. После введения экспериментальным животным DIM начинал определяться в системном кровотоке также через 15 минут, но максимум концентрации составил 3,23±0,12 мкг/мл, наблюдаясь также в течение 120 минут. Далее концентрация DIM медленно снижается, определяясь в крови через 12 часов после введения в минимальных количествах (около 2 мкг/мл). Последующее снижение концентрации характеризуется временем половинного убывания T1/2 порядка 5 часов (5.38±0.10 час). Все полученные показатели статистически значимы (p<0,05) (рис. 2).
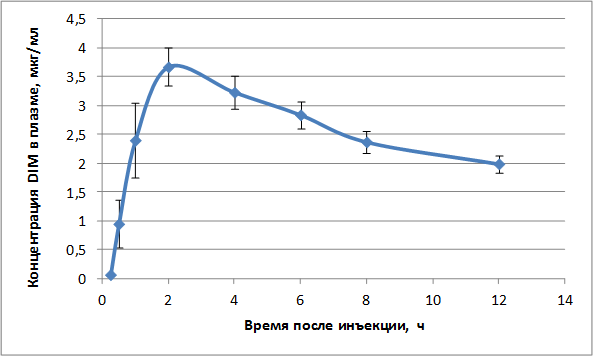
Рис. 2. Усредненная динамика концентрации DIM в плазме крови экспериментальных животных при внутрижелудочном введении улучшенной фармацевтической композиции на основе DIM, 60 мг/кг.
Показатель MRT составляет порядка 11 часов (11,66±0,16 час). Величина кажущегося стационарного объема распределения — показатель Vss — составляет порядка 19 мл/кг. Коэффициент вариации CV лежал в пределах от 8 до 42%.
Метод ВЭЖХ позволяет получить высокочувствительные, специфичные и надежные результаты. По результатам исследования были выявлены различия в фармакокинетике чистой субстанции DIM и улучшенной фармацевтической композиции на основе DIM, содержащей плюроник. Так, внутрижелудочное введение чистой субстанции DIM в дозе 60 мг/кг не продемонстрировало достижения высоких концентраций в плазме крови. Cmax неформулированного DIM оказалась примерно в 15 раз ниже максимальной концентрации активной субстанции в составе новой формуляции, содержащей плюроник (0,21±0,02 против 3,23±0,12 мкг/мл).
Помимо оценки фармакокинетических параметров, были рассчитаны показатели относительной биодоступности (табл. 1).
Таблица 1. Показатели относительной биодоступности DIM у крыс при внутрижелудочном введении фармацевтической композиции на основе DIM, 60 мг/кг.
|
№ образца |
Субстанция |
AUC мкг*ч/мл |
Относительная биодоступность (AUCDIM_New)/ AUCDIM |
Изменение относительной биодоступности (AUCDIM_New - AUCDIM)/ AUCDIM, % |
|
1 |
Дииндолилметан |
1,98 |
- |
- |
|
2 |
Фармацевтическая композиция на основе DIM |
35,50 |
17,8 |
1692 |
Как видно из полученных данных, относительная биодоступность DIM в составе новой фармацевтической композиции, содержащей плюроник, была выше в 17,8 раза по сравнению с чистой субстанцией.
Заключение
Полученные результаты подтвердили высокую биодоступность новой формуляции DIM, содержащей в своём составе плюроник, при введении животным внутрижелудочно в концентрации 60 мг/кг. Относительная биодоступность новой фармацевтической композиции на основе DIM в 17,8 раза превышает биодоступность чистой субстанции DIM, что позволяет использовать терапевтический потенциал этой субстанции и делает данную фармацевтическую композицию приоритетным кандидатом для дальнейших исследований.
Благодарности
Научно-исследовательские и опытно-конструкторские работы были выполнены в ФГБОУ ВПО «Российский университет дружбы народов» в рамках исполнения комплексного проекта по созданию высокотехнологичного производства «Производство лекарственных средств на основе биотехнологий для лечения социально значимых заболеваний», финансируемого Министерством образования и науки Российской Федерации в соответствии с постановлением Правительства РФ № 218.
Рецензенты:
Провалова Н.В., д.м.н., заместитель главного врача по научной работе НМУ «ЛДЦ», г. Томск.
Миронова Э.М., д.б.н., главный научный сотрудник отдела клинических исследований ФГБУ МНТК «Микрохирургия глаза» им. акад. С.Н. Федорова МЗ РФ, г. Москва.



