С патологическими изменениями кожи сталкиваются врачи самых разных специальностей, в том числе и эндокринологи. Поражение кожи может быть как случайной находкой, так и основной жалобой больного. Безобидные на первый взгляд изменения кожи могут оказаться единственным признаком проявления тяжелой болезни. Кожа – самый доступный для исследования орган и одновременно источник важнейшей информации. Поражение кожи может прояснить диагноз при многих внутренних болезнях, в том числе и при сахарном диабете (СД).
Кожные изменения при СД встречаются довольно часто. Тяжелые метаболические нарушения, лежащие в основе патогенеза СД, приводят к изменениям почти во всех органах и тканях, в том числе и в коже [30].
Некоторые диабет-ассоциированные кожные симптомы являются прямым результатом метаболических изменений, таких как гипергликемия и гиперлипидемия [4, 7]. Прогрессирующее повреждение сосудистой, нервной или иммунной систем также в значительной степени способствует развитию кожных проявлений. Механизмы других диабет-ассоциированных дерматологических поражений остаются неизвестными [7, 20].
Способствовать кожным изменениям также может гиперинсулинемия, как это наблюдается на ранних стадиях инсулин-резистентного диабета 2 типа.
Также значительно усугубляют течение кожных осложнений диабета макро- и микроангиопатии. У пациентов с диабетом отмечается повышенная «негерметичность» или проницаемость сосудистой стенки, снижение реактивности сосудов на симпатическую иннервацию и гипоксемический стресс [4, 43]. В сочетании с артериосклерозом крупных сосудов, эти микроваскулярные нарушения способствуют образованию диабетических язв. Кроме того, при диабете развивается потеря кожной иннервационной чувствительности, что предрасполагает к инфекциям и повреждениям [16]. Как правило, диабетические поражения кожи имеют длительное и упорное течение с частыми обострениями и трудно поддаются лечению.
Существует несколько классификаций поражений кожи при СД, в их основе лежит клиническая характеристика и некоторые аспекты патогенеза кожных изменений. Согласно классификации Хлебниковой А.Н., Марычевой Н.В. (2011) [14] условно патологию кожи при СД подразделяют на пять основных групп:
1) дерматозы, связанные с СД;
2) патология кожи, связанная с СД и инсулинорезистентностью;
3) патология кожи, ассоциированная с ангиопатией;
4) идиопатические высыпания;
5) бактериальные и грибковые инфекции.
В классификации, описанной Andrea A. Kalus, Andy J. Chien, John E. Olerud (2012) [4] выделяют следующие группы диабет-ассоциированных кожных поражений:
1) кожные проявления СД, ассоциированные с метаболическими, васкулярными, неврологическими или иммунными нарушениями (диабетическая склередема, черный акантоз, диабетическое утолщение кожи, ограничение подвижности суставов и склеродермоподобный синдром, эруптивные ксантомы, кожные инфекции (бактериальные, грибковые), диабетические язвы);
2) заболевания, связанные с СД, с неясным патогенезом (липоидный некробиоз, кольцевидная гранулема, диабетический пузырь, диабетическая дермопатия).
Данные классификации практически не отличаются и лишь дополняют друг друга.
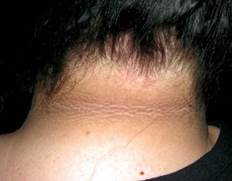
К дерматозам, связанным с СД относят диабетическую склередему. Склередема чаще встречается при длительно текущем СД в сочетании с ожирением и проявляется диффузными симметричными индуративными изменениями кожи преимущественно в области шеи и верхней трети спины по типу апельсиновой корки. По данным разных авторов, частота ее возникновения у больных СД составляет 2,5-14% [28, 25, 50].
Было предположено, что патогенез диабетической склередемы заключается в нерегулируемой продукции молекул экстрацеллюлярного матрикса фибробластами, что ведет к утолщению пучков коллагена и повышенному отложению гликозаминогликанов (ГАГ) [53]. Пациенты с диабетической склередемой могут испытывать снижение болевой и световой чувствительности в области пораженных участков кожи, а также жаловаться на затруднения движений верхних конечностей и шеи. В крайних случаях заболевание может приводить к полной потере подвижности суставов, однако, наличие склередемы не связано с ретинопатией, нефропатией, нейропатией или поражением крупных сосудов [4, 25].
ФОТО 1. Диабетическая склередема

Связь с инсулинорезистентностью и ожирением прослеживается при черном акантозе (acantosis nigricans), который проявляется участками гиперпигментации кожи с папилломатозными разрастаниями в области шеи и крупных складок [34]. Центральную роль в развитии акантоза играет инсулин. У женщин, страдающих акантозом, можно обнаружить утрату функциональных мутаций рецептора инсулина или рецептора антиинсулиновых антител (синдром типа А и типа В) [18, 31]. Считается, что избыточная стимуляция фактора роста в коже вызывает абберантную пролиферацию кератиноцитов и фибробластов, в результате чего развиваются клинические проявления черного акантоза [52]. При состояниях инсулинорезистентности и гиперинсулинемии, акантоз может развиваться вследствие избыточного связывания инсулина к рецепторам ИФР – 1 на кератиноцитах и фибробластах [27]. Данные в пользу роли различных факторов роста в патогенезе черного акантоза продолжают накапливаться.
ФОТО 2. Черный акантоз
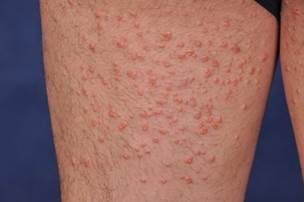
Недиагностированный СД и гипертриглицеридемия могут провоцировать появление на коже эруптивных ксантом [46, 8]. Они представляют собой красновато-желтые папулы размером 1-4 мм., расположенные на ягодицах и разгибательных поверхностях конечностей. Патологические элементы появляются в виде зерен и со временем могут сливаться с образованием бляшек. Изначально в кожных элементах преобладают триглицериды, но так как они мобилизуются легче, чем холестерол, с их распадом в коже накапливается все больше холестерола [47].
Инсулин является важным регулятором активности ЛПНП. Степень ферментной недостаточности и последующего очищения сывороточных триглицеридов пропорциональны показателям дефицита инсулина и гипергликемии [22]. Клиренс липопротеинов плазмы зависит от адекватного уровня инсулина [17]. При неконтролируемом диабете такая неспособность метаболизировать и освобождать насыщенные триглицеридами хиломикроны и липопротеины очень низкой плотности может приводить к повышению уровня триглицеридов плазмы до нескольких тысяч. Неконтролируемый диабет является распространенной причиной массивной гипертриглицеридемии [4, 26, 29].
ФОТО 3 эруптивные ксантомы
Больные СД склонны к развитию кожных инфекционных заболеваний, особенно при неудовлетворительном контроле гликемии. На поверхности кожи больных СД выявляют в 2,5 раза больше микроорганизмов, чем у здоровых лиц, а бактерицидная активность кожи у больных СД ниже в среднем на 20% [9]. Это снижение прямо коррелирует с тяжестью течения СД. Инфекционно-воспалительные заболевания прежде всего развиваются на коже нижних конечностей в связи с ангио- и нейропатиями. Причиной обычно являются полимикробные инфекции: золотистый стафилококк, стрептококки групп А и В, грамотрицательные аэробные бактерии и множество анаэробов. Пиодермии представлены в основном фолликулитами, эктимами, рожей и могут осложняться экзематизацией. Кроме того, возможно развитие фурункулеза, карбункулов, паронихий, инфекций мягких тканей [21].
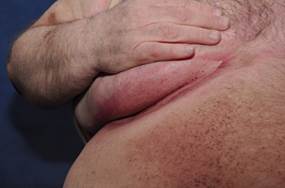
На фоне СД наблюдается повышенная частота грибковых инфекций, которые в структуре заболеваний у больных этой категории, по данным разных авторов, составляют 32,5 – 45% [14, 9]. В условиях гиперкалиемии грибы активно используют сахар для своих метаболических процессов и усиленно размножаются, вызывая болезнь. При СД нарушение микроциркуляции в сосудах нижних конечностей наблюдается в 20 раз чаще, чем у лиц без эндокринной патологии, что способствует развитию грибкового поражения стоп и онихомикоза [1]. Возбудителями грибковых поражений являются дерматофиты и Candida albicans. Причем в нормальной популяции грибковые поражения кожи, обусловленные C. albicans, не превышают 20%, тогда как у соматически отягощенных больных этот показатель повышается до 80 - 90% [12]. Следует отметить, что 80% регистрируемого кандидоза кожи приходится на больных СД [5]. Наиболее распространены интертриго (с поражением подмышечной, паховой областей, межпальцевых промежутков), вульвовагинит, баланит, паронихия, глоссит и ангулярный хейлит. Помимо дрожжевых вагинальных инфекций с клиническими проявлениями, у пациентов с диабетом также повышена частота бессимптомного носительства [36].
ФОТО 4 Кандидоз крупных складок
К заболеваниям, связанным с СД и имеющим неясный патогенез, относят липоидный некробиоз, кольцевидную гранулему, диабетический пузырь и диабетическую дермопатию.
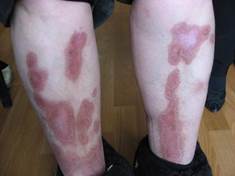
Липоидный некробиоз (болезнь Оппенгейма – Урбаха) – редкое гранулематозное хроническое заболевание сосудисто-обменного характера, представляет собой локализованный липоидоз с отложением липидов в тех участках дермы, где имеется дегенерация или некробиоз коллагена [15]. Первые симптомы дерматоза обычно возникают в возрастной группе от 20 до 60 лет. В детском возрасте болезнь Оппенгейма-Урбаха встречается редко [13]. Частота возникновения липоидного некробиоза среди пациентов с СД составляет 0,1-3% [38, 6].
Клиническая картина болезни Оппенгейма-Урбаха весьма многообразна. В процесс могут вовлекаться различные участки кожного покрова, но в первую очередь кожа передних поверхностей голеней. Это можно объяснить, вероятно, тем, что при диабете патологические изменения первоначально происходят в мелких сосудах именно нижних конечностей [10]. Обычно липоидный некробиоз проявляется в виде одной или нескольких четко отграниченных желтовато-коричневых бляшек. Элементы имеют фиолетовые неровные края, которые могут возвышаться над поверхностью кожи или уплотняться. Со временем элементы выравниваются и центральная желтая или оранжевая область становится атрофичной, часто можно видеть телеангиоэктазии, которые придают областям поражения блеск «глазурованного фарфора». В области бляшек встречается потеря чувствительности [44, 2, 42].
ФОТО 5 Липоидный некробиоз
Генерализованная кольцевидная гранулема у 20% больных – первый признак ранее не диагностированного СД 2 типа. Связь кольцевидной гранулемы с СД остается предметом дискуссий, так как она может ассоциироваться и с другими заболеваниями [55]. Наблюдались локализованные, генерализованные, а также подкожные узловатые и перфорирующие формы кольцевидной гранулемы, ассоциированной с СД [3, 37, 24].
Типичный анамнез кольцевидной гранулемы предполагает одну или несколько папул, растущих по периферии с одновременным разрешением в центре. Очаги могут сохранять естественный цвет кожи или же быть эритематозными или фиолетовыми. Обычные размеры очагов от 1 до 5 см в диаметре [41]. Кольцевидная гранулема, как правило, протекает бессимптомно; возможен слабый кожный зуд, болезненные очаги наблюдаются редко [33].
ФОТО 6 Кольцевидная гранулема
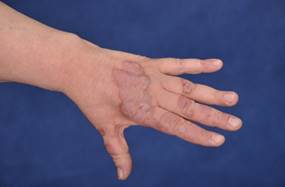
Диабетический буллез – субэпидермальный буллезный дерматоз, встречающийся у больных диабетом [39].
Впервые пузыри в качестве одного из вариантов поражений кожи при диабете наблюдал D. Kramer в 1930 г. [35]. A. Cantwell и W. Martz описали это состояние как диабетический буллез [23,11].
Причина появления пузырей у больных диабетом не ясна. Существуют теории о роли микроангиопатии и местных нарушений метаболизма. Диабетический буллез встречается преимущественно у лиц, длительно страдающих диабетом, несколько чаще – у женщин. Возраст начала заболевания колеблется от 17 до 79 лет.
На неизмененной коже появляются пузыри размером от нескольких миллиметров до нескольких сантиметров (обычно на коже нижних конечностей) [19]. Выделяют два вида поражения: интраэпидермально расположенные пузыри, которые исчезают без образования рубца, и субэпидермальные пузыри, после которых остаются атрофированные рубчики. Высыпания локализуются преимущественно на стопах и голенях, но могут встречаться на кистях и предплечьях. Пузыри самопроизвольно разрешаются через 2-5 недель, возможны рецидивы [45].
ФОТО 7 Диабетический пузырь
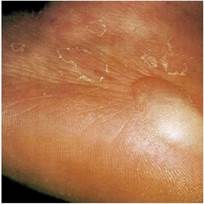
Атрофические кожные изменения нижних конечностей или «пятнистая голень», впервые были описаны и предложены в качестве маркера диабета в 1964 г. [54]. Вскоре после этого Binkley ввел термин диабетическая «дермопатия» с целью соотнесения данных патологических изменений с таковыми при ретинопатии, нефропатии и нейропатии [51]. Диабетическая дермопатия встречается чаще у пациентов с длительным течением диабета и более распространена среди мужчин [29, 40]. Клинически она представляет собой небольшие (менее 1 см) атрофические пятна от розового до коричневого цвета и напоминающие рубцовую ткань, располагающиеся на претибиальных участках. Эти элементы имеют бессимптомное течение и исчезают через 1-2 года, оставляя после себя небольшую атрофию или гипопигментацию [54]. Появление новых элементов позволяет предположить, что пигментация и атрофия являются персистирующими состояниями.
ФОТО 8 Диабетическая дермопатия
Обменно-эндокринные нарушения нередко являются пусковым механизмом развития некоторых дерматозов. Отмечается определенная взаимосвязь течения этих заболеваний с наличием эндокринопатии. Выраженный СД выявлен у 19% пациентов с красным плоским лишаем, у части из них имело место значительное изменение глюкозотолерантного теста [48]. Часто поражение слизистой оболочки полости рта при красном плоском лишае сочетается с СД и артериальной гипертензией (синдром Потекаева-Гриншпана), причем высыпания на слизистой оболочке, как правило, носят эрозивно-язвенный характер. В ходе крупномасштабного исследования для определения связи между псориазом и общим состоянием здоровья было установлено, что женщины, страдающие псориазом, на 63% больше предрасположены к развитию СД, по сравнению с пациентками, не имеющими данного дерматоза [49]. На фоне СД псориаз протекает тяжелее, наблюдаются такие формы как экссудативный псориаз, псориатический полиартрит, псориаз крупный складок [32].
Таким образом, изменения кожи вполне могут быть связаны с системными патологическими процессами, характерными для СД. В основе клинической и патоморфологической картины дерматозов и дермопатий, предшествующих или развивающихся на фоне СД, лежат метаболические, сосудистые, неврологические и иммунные нарушения.
Рецензенты:
Валеева Ф.В., д.м.н., профессор, зав. курсом, эндокринологии, профессор кафедры госпитальной терапии с курсом эндокринологии ГБОУ ВПО «Казанский государственный медицинский университет Министерства Здравоохранения Российской Федерации», г.Казань.
Сергеева И.Г., д.м.н., профессор кафедры фундаментальной медицины ФГБОУ ВПО Новосибирского национального исследовательского государственного университета, г.Новосибирск.



