Введение
Острая сердечная недостаточность (ОСН) является одним из наиболее частых и грозных осложнений инфаркта миокарда (ИМ), оказывающих неблагоприятное влияние на течение острого периода и отдаленные исходы заболевания [8]. Частота развития сердечной недостаточности при ИМ на госпитальном этапе варьирует от 5 до 30% [6]. Приблизительно 45% пациентов, госпитализированных с ОСН, в течение последующего года повторно поступают в стационар хотя бы один раз [1]. Летальность пациентов ИМ с сердечной недостаточностью достигает 20% в течение месяца и возрастает до 50% в течение года и пропорциональна тяжести проявлений сердечной недостаточности [7].
Накопленные в последние годы многочисленные экспериментальные и клинические данные показывают, что тяжесть течения и исход острого ИМ во многом зависят от выраженности окислительного стресса и адаптационно-компенсаторных возможностей организма [4]. Поскольку участие свободнорадикальных процессов в патогенезе ИМ ставит вопрос о возможности профилактики и коррекции таких нарушений фармакологическими средствами [5], то в последние годы разрабатываются принципиально новые подходы к лечению пациентов с ИМ, основанные на использовании лекарственных препаратов, нивелирующих нарушения метаболизма в ишемизированных кардиомиоцитах [2]. В настоящее время пристальное внимание фармакологов и клиницистов в качестве перспективных лекарственных средств, эффективно регулирующих процессы окисления и перооксидации, привлекли соединения гетероароматических фенолов, в частности производные 3-оксипиридина [3]. Поэтому целесообразно исследовать новые производные 3-оксипиридина. Целью нашей работы явилась оценка эффективности 3-оксипиридина сукцината и 3-оксипиридина адипината при острой сердечной недостаточности в эксперименте.
Материалы и методы. Эксперименты проводились на 24 нелинейных белых крысах, содержащихся в стандартных условиях вивария. Моделирование острой сердечной недостаточности проводилось после подключения наркотизированных уретаном в дозе 800 мг/кг животных к аппарату искусственной вентиляции легких, после левосторонней торакотомии в четвертом межреберье, рассекали перикард, обнажали сердце и при помощи атравматичной иглы подводили лигатуру и перевязывали нисходящую ветвь левой коронарной артерии. Продолжительность окклюзии сосуда составляла 40 мин.
Исследовано 3 группы животных, по 8 крыс в каждой группе: 1-я – контроль с острым повреждением миокарда без коррекции, 2-я – с коррекцией 3-оксипиридина сукцинатом в дозе 50 мг/кг и 3-я – с коррекцией 3-оксипиридина адипинатом 80 мг/кг, вводимым внутрибрюшинно, за 30 минут до формирования модели. По окончании эксперимента проводили оценку размеров анатомической зоны риска и зоны инфаркта с помощью методики «двойного окрашивания» синим Эванса и трифенилтетразолия хлоридом (ТТС). Подсчет площадей зоны риска и зоны инфаркта проводили на оцифрованных снимках поперечных срезов сердец, на персональном компьютере, с помощью программы ImageJ 1.45s. Для гистологического исследования кусочки миокарда фиксировали в 10%-ном растворе нейтрального формалина. Срезы окрашивали гематоксилином и эозином. На светооптическом уровне оценивали качественное состояние миокарда. Статистическая обработка материала осуществлялась с помощью пакета статистических программ Excel на персональном компьютере, расчеты достоверности различия средних арифметических велись с помощью t-критерия Стьюдента при 5%-ном уровне значимости.
Результаты работы и их обсуждение. В контрольной группе животных при «двойном окрашивании» синим Эванса и ТТС зона ишемии составила 54,9±0,19% от общего объема сердца. При коррекции 3-оксипиридином сукцинатом зона риска достоверно уменьшилась к контролю на 33% (рк<0,001), а при коррекции 3-оксипиридина адипинатом данный показатель был достоверно меньше на 27,72% (рк<0,001) относительно контрольных животных. Объем зоны некроза в первой группе составил 37,59±0,96% по отношению к объему сердца, на фоне коррекции 3-оксипиридином сукцинатом, зона некроза достоверно снизилась на 36,95% (рк<0,001), а на фоне введения 3-оксипиридина адипината зона повреждения достоверно уменьшилась на 18,16% (рк<0,001). Отношение площади некроза к площади ишемии в контроле составило 65±4,09%, при коррекции 3-оксипиридина сукцинатом значение данного отношения приближалось к таковым в контроле и составило 64,83%, а при коррекции 3-оксипиридина адипинатом данный показатель снизился на 4,15%.
При микроскопическом исследовании, в контрольной группе животных, в области экспериментального повреждения миокарда, отмечались изменения преимущественно дисциркуляторного характера в виде умеренного стромального отека ткани, неравномерного кровенаполнения интрамуральных сосудистых ветвей: полнокровие венозных сосудов и капилляров с их дистонией и периваскулярным отеком, на фоне малокровия артериол. Поперечная исчерченность мышечных волокон была нечеткой, а местами и вовсе пропадала. Межмышечные и периваскулярные пространства неравномерно расширены. Отмечалось набухание кардиомиоцитов с выраженной гомогенной эозинофилией цитоплазмы, приобретающей «лаковый» вид, с базофильными пикнотичными ядрами. Наблюдались участки миофибриллярной дегенерации и участки волокнистых, извилистых волокон с фрагментами миоцитолиза, глыбчатого распада миофибрилл кардиомиоцитов. А также обнаруживались участки контрактурного повреждения кардиомиоцитов. В просвете кровеносных сосудов и в тканях миокарда, прилегающих к сосудистой сети, наблюдалась начинающаяся лейкоцитарная инфильтрация преимущественно нейтрофильного характера (рис. 1).
На фоне введения 3-оксипиридина сукцината отмечалось сохранение изменений дисциркуляторного характера, однако стромальный и периваскулярный отек сердечной ткани выражены в меньшей степени. Очаговые кровоизлияния не наблюдались, хотя сохранялась дистония кровеносных сосудов, преимущественно венозного компонента с единичными эритроцитарными экстравазатами, на фоне малокровия артериол. Поперечная исчерченность мышечных волокон, как и в предыдущей группе животных, была нечеткой, с местами ее полного отсутствия. Миофибриллярная дегенерации значительно меньше выражена относительно контрольной группы животных. Как и в предыдущей группе, отмечались участки контрактурного повреждения кардиомиоцитов. В просвете кровеносных сосудов и в тканях миокарда, прилегающих к сосудистой сети, также наблюдалась начинающаяся лейкоцитарная инфильтрация преимущественно нейтрофильного характера, однако степень ее выраженности была меньше по сравнению с контролем (рис. 2).
На фоне применения 3-оксипиридина адипината отмечался периваскулярный и перицеллюлярный отек ткани умеренного характера, более выраженный, чем в предыдущей группе, но в меньшей степени по сравнению с контрольными животными. Сохранялось полнокровие сосудистой системы ткани миокарда с более выраженной дистонией венозной системы сердца. Отмечались единичные, небольшие очаги кровоизлияний в межмышечные пространства миокарда, эритроцитарные экстравазаты. Изменения структуры кардиомиоцитов более выражены относительно второй группы исследуемых животных и в меньшей степени выражены по сравнению с контролем. Данные изменения характеризовались участками отсутствия миофибрилл в цитоплазме кардиомиоцитов, гомогенностью и эозинофилией цитоплазмы, с редкими явлениями кариопикноза. Прослеживались участки с избыточным пересокращением кардиомиоцитов. Обнаруживались кровеносные сосуды, в просвете которых наблюдалось краевое стояние лейкоцитов. В периваскулярной ткани миокарда отмечалась лейкоцитарная инфильтрация, и степень ее выраженности была схожа с предыдущей группой исследуемых животных (рис. 3).
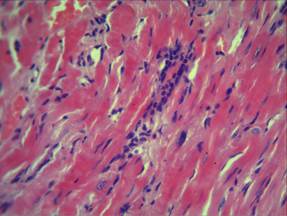
Рис. 1. Морфология миокарда при ОСН, контрольная группа. Окраска гематоксилином и эозином. Ув. х400.
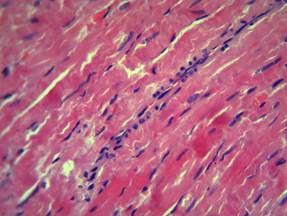
Рис. 2. Морфология миокарда при ОСН на фоне 3-оксипиридина сукцината. Окраска гематоксилином и эозином. Ув. х400.
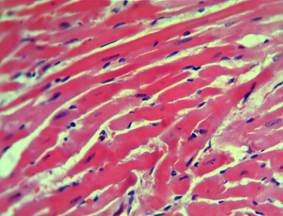
Рис. 3. Морфология миокарда при ОСН на фоне 3-оксипиридина адипината. Окраска гематоксилином и эозином. Ув. х400.
Заключение. У исследованных нами производных 3-оксипиридина выявлены кардиопротекторные свойства на фоне острой сердечной недостаточности в эксперименте.
3-оксипиридина сукцинат в дозе 50 мг/кг значительно и достоверно уменьшал объем зоны ишемии и некроза миокарда по сравнению с контрольными животными. Кардиопротекторное действие данного соединения также наблюдалось и при гистологическом исследовании сердца, и выражалось в уменьшении стромального и периваскулярного отека сердечной ткани, миофибриллярной дегенерации, отсутствии очаговых кровоизлияний и уменьшении нейтрофильной инфильтрации в зоне повреждения сердечной ткани.
3-оксипиридина адипинат в дозе 80 мг/кг также показал положительное действие на миокард при острой сердечной недостаточности, выражающееся в уменьшении зоны ишемии и некроза миокарда в очаге поражения, корригировал гистологическую картину миокарда по сравнению с контрольной группой исследуемых животных, однако его эффективность уступает аналогичной при использовании 3-оксипиридина сукцината в дозе 50 мг/кг.
Таким образом, более перспективно использовать 3-оксипиридина сукцинат в дозе 50 мг/кг по сравнению с 3-оксипиридина адипинатом в дозе 80 мг/кг при острой сердечной недостаточности на фоне инфаркта миокарда.
Рецензенты:
Блинов Д.С., д.м.н., профессор, заведующий кафедрой организации здравоохранения, ФГБОУ ВПО «Мордовский государственный университет им. Н.П. Огарева», г. Саранск.
Сипров А.В., д.м.н., профессор кафедры фармакологии и клинической фармакологии с курсом фармацевтической технологии, ФГБОУ ВПО «Мордовский государственный университет им. Н.П. Огарева», г. Саранск.



