Исследованию электрической проводимости стекол систем Me2O-SiO2; Me2O-B2O3;Me2O-P2O5 и т.п. посвящено большое количество публикаций [8], в которых изучались вопросы природы носителей тока в оксидных многощелочных стеклах. В 1834 г. Фарадей, исходя из экспериментальных данных, полученных при исследовании прохождения электрического тока через стекла, сформулировал закон электролиза, а в 1853 г. Гитторф, исследуя электрические свойства стекол, ввел понятие «числа переноса» и предложил метод их нахождения. Дальнейшие исследования процессов электропереноса как в кристаллических, так и в стеклообразных твердых телах показали, что в композициях с высоким содержанием ионов щелочных металлов всегда выполняется закон Фарадея. Так, например, еще в 1884 г. Варбург подверг электролизу натриевосиликатное стекло. Он показал, что если использовать активный анод (амальгама натрия), то масса стекла остается неизменной даже в случае полного замещения всех ионов натрия в объеме стекла, подвергнутого электролизу ионами натрия из активного анода. При этом физико-химические свойства стекол остаются постоянными (по [6]). Прецизионные опыты по электролизу оксидных стекол с высоким содержанием Me2O показали выполнение закона Фарадея с точностью до 0,5 ÷ 1%. Варбург доказал, что если при электролизе материалов с высокой концентрацией Me2O использовать пассивные электроды (ртуть, графит, платину), то есть электроды, не содержащие ионы щелочных металлов, то у анода образуется слой электролита, в котором либо совсем отсутствуют ионы Me+, либо их концентрация очень мала. Этот слой часто называют слоем Варбурга, а его физико-химические свойства сильно отличаются от свойств основного объема стекла. Так, из-за полного отсутствия или резкого падения концентрации носителей тока (ионов Me+) электропроводность прианодного слоя (слоя Варбурга) заметно уменьшается. Степень изменения физико-химических свойств зависит от состава исследуемого образца, а также от количества электричества, прошедшего через образец. Электролиз с неактивным анодом сопровождается разрушением стекла, проводимость которого обусловлена миграцией щелочных ионов, после прохождения какого-то количества электричества.
В работах Варбурга, Тегетмейера и др. было показано, что проведение электролиза с активным (амальгамным) анодом позволяет на 90–100% заместить натрий, содержащийся в исходном натриевосиликатном стекле, без разрушения (по [6]).
В литературе [8] отмечается, что введение в щелочные силикатные, боратные, фосфатные и др. стекла Al2O3 сопровождается резким возрастанием электрической проводимости, химической устойчивости и т.п. Если исследованию температурно-концентрационной зависимости электрических свойств стекол систем Me2O-Al2O3-SiO2; Me2O-Al2O3-B2O3 посвящен ряд работ [8], то изучению процессов электролиза не уделено достаточного внимания. Так, например, в [5] было установлено (с использованием методики Гитторфа), что носителями тока в стеклах системы Na2O-Al2O3-ZnO-P2O5 являются ионы натрия, числа переноса которых равны 0,99, то есть в пределах погрешности эксперимента перенос электрического тока обусловлен миграцией только ионов натрия. В [1] был проведен электролиз стекол этой системы. В гальваностатическом режиме происходил пробой образца после пропускания 40–60 Кл электричества. В соответствии с законом Фарадея ~ 50 Кл электричества должно выделить на катоде ~ 5,2 ∙ 10-4 экв. натрия. Электролизу подвергался объем стекла ~ 0,1 см3 (при толщине образца 1,00 мм), в котором содержится 8,82∙10-4 экв. натрия (у стекла с 20,6 мол. % Na2O) или 1,15∙10-4 экв. натрия (у стекла с 25,7 мол. % Na), то есть до разрушения стекла в гальваностатическом режиме удается заменить ~ 50% ионов натрия в объеме стекла на ионы Na из активного анода.
При потенциостатическом режиме электролиза разрушение образцов наблюдалось после пропускания 250 ÷ 300 Кл. При прохождении ~ 300 Кл электричества должно выделиться на катоде ~3,1∙10-3 экв. натрия, но существует возможность двукратной замены ионов натрия в объеме стекла.
Большое внимание в последние годы уделяется изучению твердых электролитов (ТЭЛ), проводимость которых обусловлена миграцией ионов лития. Так, например, наиболее изученным твердым электролитом с проводимостью, обусловленной миграцией ионов лития, является α-фаза ортосиликата лития Li2SiO4 в интервале температур 586-860 °С, достигающая ~ 3 Ом-1∙см-1. Путем модификации ортосиликата лития оксидами таких металлов, как Zn, Mg, Al, удалось получить композиции, обладающие такой же проводимостью, но в области более низких температур. Однако электропроводность литиевых электролитов при низких (комнатных) температурах невелика. Основное внимание в настоящее время уделяется исследованию кристаллических ТЭЛ, хотя стеклообразные композиции превосходят по электрической проводимости кристаллические на 1-2 порядка. К числу таких композиций можно отнести литиевые алюмофторофосфатные стекла, которые обладают униполярной проводимостью, обусловленной миграцией ионов лития, числа переноса которых равны единице [4], то есть подвижность ионов лития на несколько порядков превосходит подвижность ионов другого вида. Подобного рода композиции уже нашли свое применение в термоактивируемых химических источниках тока в качестве твердого электролита, в качестве материала для изготовления ионоселиктивных сенсоров, для получения сверхчистых щелочных металлов, дозированного введения этих металлов в реакционную зону. При создании химического источника тока (ХИТ) с твердым электролитом одним из основных требований является максимальная проводимость ТЭЛ, поскольку эта величина является составной частью полного внутреннего сопротивления ХИТ. Основной целью настоящей работы было исследование стойкости литиевых алюмофосфатных стекол к электролизу и определение возможности создания термоактивируемого химического источника тока с литиевым анодом, в качестве которого используется стекло с униполярной проводимостью, обусловленной миграцией ионов лития.
Методика и техника эксперимента
Синтез стекол осуществлялся из реактивов марки ХЧ в стеклоуглеродных тиглях (стеклоуглерод марки СУ-2000) в атмосфере аргона (ГОСТ 10157-79) марки Ч в электропечи при 950 °С в течение 45 мин. Исходными реактивами служили Li2CO3, LiF, Al2O3 и H3PO4. Состав изученных стекол (по синтезу) 25,0Li2O∙41,7LiF∙8,3Al2O3∙25,0P2O5 мол.%.
Из литературы [8] известно, что щелочные алюмофосфатные стекла обладают более высокой (по сравнению с другими классами стекол) электрической проводимостью. Применение стекла, в котором перенос электрического тока осуществляется за счет миграции ионов лития, позволяет использовать литиевый анод, что обеспечивает более высокую удельную энергоемкость ХИТ и большую величину ЭДС. Однако применение металлического лития связано с рядом технологических трудностей, так как литий уже при комнатной температуре реагирует не только с влагой воздуха, но и с азотом, что требует необходимости работы в атмосфере аргона, очищенного от следов как кислорода, так и азота. Даже в «аргоне газообразном высокой чистоты ТУ-6-21-12-94», в качестве примеси объемная доля кислорода составляет 2∙10-4%, а азота 1∙10-3%, достаточного для образования пленок нитрида лития, обладающих высоким сопротивлением. Поэтому аргон из баллона барбатировался через расплав металлического лития при ~ 550 °С для удаления примесей кислорода и азота (в расплаве азот реагирует с Li со взрывом).
Для исследования устойчивости синтезированных стекол к воздействию расплавленного лития в условиях протекания электрохимических реакций и выявления возможности их использования в качестве ТЭЛ был проведен электролиз стекол состава 25,0Li2O∙41,7LiF∙8,3Al2O3∙25,0P2O5 мол.%.
Образцы для электролиза представляли собой плоскопараллельные пластины толщиной 1,00 и 2,00 ± 0,01 мм, диаметром ~ 25 мм, поверхность которых была мелко шлифована или полирована. Электролиз проводился при (330 ± 5) °С. Анодом служил либо расплав металлического лития, либо амальгама лития, в качестве катода использована ртуть. Площадь электродов составляла 1,0 см2 [1].
Количество электричества, пропущенного через образцы во время электролиза, определялось с помощью электролитического счетчика количества электричества X603 и серебряно-таллиевого кулонометра, включенных последовательно [1; 3].
Стабилизированное напряжение снималось с потенциостата Camry Reference 3000. Использовались два режима: гальваностатический (при плотностях тока от 50 до 300 мА/см2) и потенциостатический (с фиксированными потенциалами 2, 4, 6, 8 и 10 В). Критерием выхода из строя образца электролита служило скачкообразное изменение свободного параметра электролитического процесса (тока или напряжения) не менее чем на порядок, за время не более 1 с. Свободный параметр непрерывно фиксировался, а характер разрушения образцов определялся визуально после разборки охлажденной ячейки.
Экспериментальные данные и обсуждения
В стеклах систем Me2O-SiO2; Me2O-B2O3, где Me – щелочные металлы, по данным, приведенным в [6], возможно многократное замещение (путем электролиза) содержащихся в объеме стекла ионов щелочных металлов, без разрушения образца, если используется активный анод. Усложнение состава стекол системы Na2O-P2O5 за счет введения в его состав оксидов алюминия и цинка сопровождается разрушением стекла в процессе электролиза примерно при двукратной замене ионов натрия при потенциостатическом режиме.
При электролизе стекол системы Na2O-Al2O3-ZnO-P2O5, как уже отмечалось, разрушение стекол наступало при пропускании ~ 60 Кл электричества (в гальваностатическом режиме). Типичным повреждением был сквозной прожог стекла на небольшой площади. Аналогичное явление наблюдалось при электролизе стекол систем Li2O-LiF-Al2O3-P2O5 после пропускания ~ 50–70 Кл электричества. Одной из причин подобного явления может служить ухудшение контакта (по всей площади) между образцом и электродами, что вызывает локальную перезагрузку как по току, так и по напряжению, поскольку заданный суммарный ток через образец поддерживается постоянным. Вследствие локального разогрева стекла (при протекании токов высокой плотности) сопротивление образца уменьшается, и вся подводимая электрическая мощность выделяется на данном участке образца, что в конце концов и сопровождается пробоем.
При потенциостатическом режиме начальная плотность тока составляла от 50 до 300 mA/см2. В процессе электролиза наблюдалось спадение тока во времени. Характер спадения тока сильно зависел от предварительной подготовки поверхности образца к эксперименту. У образцов, поверхность которых предварительно обезжиривалась спиртом, а затем прогревалась либо в вакууме, либо в атмосфере аргона при ~ 150 °С в течение часа, падение силы тока достигало 50–60% от начальной плотности с последующей стабилизацией на этом уровне. При этом разрушение образцов наблюдалось после пропускания 290 ÷ 330 Кл, независимо от толщины. Для образцов, поверхность которых не была подготовлена к эксперименту, наблюдалось быстрое падение тока по экспоненциальному закону. При этом разрушение образцов наступало, после прохождения 50 ÷ 70 Кл электричества и носило поверхностный характер в виде почернения поверхности и образования разнообразных пленок между образцом и катодом. В отдельных случаях на образце появлялась трещина, и тогда все дефекты группировались в районе трещины, а остальная поверхность стекла оставалась чистой.
При потенциостатическом режиме предельное количество электричества, приводящее к разрушению образца, практически также не зависело от его толщины (1 или 2 мм) и характера механической обработки поверхности (полировка или шлифовка), но сильно зависело от способа его подготовки к проведению электролиза: обезжиривание поверхности, предварительное прокаливание, выдержка в вакууме или атмосфере аргона и т.п. – эти факторы способствовали увеличению количества электричества, которое разрушало образец.
В объеме стекла (V = 0,1 см3 при толщине образца 1 мм) содержится ~ 3,75∙10-3 молей ионов лития. В гальваностатическом режиме разрушение наблюдалось после прохождения через образцы Qсрn ~ 50 Кл электричества. В соответствии с законом Фарадея на катоде после прохождения такого количества электричества разряжается 5∙10-4 молей ионов лития. Следовательно, в этом режиме электролиза возможна многократная замена ионов лития, находящихся в объеме стекла, подвергнутого электролизу, ионами лития из активного анода.
В потенциостатическом режиме (после тщательной подготовки поверхности образцов) до разрушения удавалось пропустить Qсрn ~ 290 Кл электричества, на катоде выделяется 3∙10-3 молей лития. Сопоставление количества ионов лития, содержащихся в объеме стекла с количеством лития, выделившимся на катоде, также свидетельствует о возможности более чем 10-кратной замены ионов лития в объеме стекла.
Влияние предварительной подготовки поверхности стекол к проведению электролиза на количество электричества, вызывающее разрушение образцов, свидетельствует о заметном участии адсорбированных поверхностью каких-то примесных веществ. Наибольшее влияние, по-видимому, играет «вода». В [8] приведен ряд публикаций, в которых рассматривается влияние «примесной воды» (всегда содержащейся в объеме оксидных стекол) на их физико-химические свойства. Показано, что содержание «примесной воды» возрастает в ряду стекол на основе SiO2,B2O3 и P2O5, а сведения об электрических свойствах фосфатных стекол малочисленны и плохо согласуются между собой, что, по-видимому, обусловлено различиями в методике синтеза стекол и экспериментальными трудностями количественного определения «примесного водорода». Так, например, изменение температуры синтеза стекла Ca(PO3)3 с 1000 до 1400 °С сопровождается падением содержания H2O с 9,5∙10-2 до 5,5∙10-2 мас. % [2]. Характер удаления воды при нагревании измельченных на воздухе и монолитных стекол заметно различается, особенно в низкотемпературной области. Удаление воды в области 110–130 °С и 340–360 °С мало зависит от состава стекла, а последняя область близка к температуре размягчения стекла и зависит от его состава (рис. 1). Высокотемпературная ветвь кривой ДТБ практически не отличается от аналогичной кривой монолитного стекла. Слабое влияние природы щелочноземельных металлов на удаление воды в области температур до Tg позволяет предположить, что удаляется вода, сорбированная на активных центрах поверхности, которые образуются при механическом разрушении фосфатных фрагментов структуры. На поверхности образцов образуются фрагменты ≡P–O-...H+, которые интенсивно сорбируют молекулы воды из атмосферы. Необходимо отметить, что содержание «примесной воды» зависит от методики синтеза и, например, по данным [7], содержание «примесной воды» в Ba(PO3)3 достигает ~ 3 мас. %, а по данным [2], только 6,9∙10-2 мас. %. Кроме того, на поверхности стекол, подвергнутых механической обработке, содержится большое количество воды (в 2 ÷ 10 раз) в виде поверхностных гидроксильных групп и сорбированных на них молекул атмосферной влаги. Именно эта вода может быть удалена с поверхности путем ее соответствующей обработки, что позволяет исключить влияние поверхностной влаги на процессы электролиза.
Заключение
Проведен электролиз стекол состава 25,0Li2O∙41,7LiF∙8,3Al2O3∙25,0P2O5 (% мол.) с использованием активных анодов. Показано, что как в гальваностатическом, так и в потенциостатическом режимах электролиза возможна многократная замена ионов лития, находящихся в объеме стекла на ионы из активного анода, так как числа переноса ионов лития практически равны единице (0,995). Рассмотрено влияние подготовки поверхности образцов к электролизу и влияние воды, адсорбированной на этой поверхности.
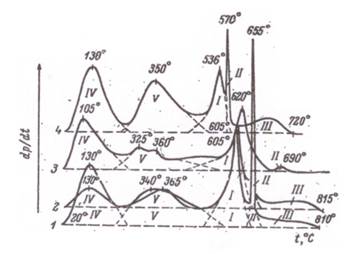
Рисунок 1. Кривые измельченных стеклообразных метафосфатов щелочноземельных металлов [2]:
1, 2 – Ca(PO3)2
(1 – запись после хранения растертого образца на воздухе; 2 – запись сразу после растирания);
3 – Mg(PO3)2;
4 – Ba(PO3)2.
Рецензенты:
Ивахнюк Г.К., д.х.н., профессор, заведующий кафедрой инженерной защиты окружающей среды Санкт-Петербургского государственного технологического института (технического университета), г. Санкт-Петербург.
Демидов А.И., д.х.н., профессор кафедры физико-химии и технологии микросистемной техники Санкт-Петербургского государственного политехнического университета, г. Санкт-Петербург.



