Ведение. Несмотря на бурное развитие медицины проблемы сосудистых заболеваний головного мозга и особенно сосудистых катастроф не решены и до настоящего времени [8].
При развитии церебральной ишемии создаются условия формирования окислительного стресса (ОС). ОС является одним из ведущих механизмов в патогенезе ишемического инсульта (ИИ) и развивается в первые часы ишемии [1]. При очаговой ишемии мозга основную опасность для нервных клеток представляют процессы образования активных форм кислорода (АФК) и перекисного окисления липидов (ПОЛ) с усиленной продукцией реактивных оксигенных радикалов и перекисных продуктов, обладающих мембрано- и цитотоксичностью, запускающих процессы «повреждения» с фрагментацией мембранных фосфолипидов [7]. Процесс свободнорадикального окисления в настоящее время признан абсолютно универсальным общебиологическим механизмом при развитии любого вида патологии. В этих условиях очень важна своевременная мобилизация факторов системы антиоксидантной защиты (АОЗ) [3].
Для изучения эффективности ТЭС-терапии при ИИ была поставлена цель изучить ее влияние на «оксидативный» статус и показатели системы про- /антиоксиданты в эксперименте на животных.
Материалы и методы. Эксперименты проведены на 180 белых нелинейных крысах-самцах, средней массой – 250±50 гр., средний возраст которых колебался от 9 месяцев до 1 года. Операции выполнялись под общим золетил-ксилазиновым наркозом. Моделирование острой локальной церебральной ишемии выполнялось путем коагуляции правой средней мозговой артерии [5,9]. Для сравнительного изучения влияния ТЭС-терапии животные были разделены на 3 группы: 1 группа (n=20) – контрольная, операция этим крысам не выполнялась; 2 группа (n=80) – животные с моделированным ИИ и 3 группа (n=80) – животные с моделированным ИИ, которым проводилась ТЭС-терапия в течение первых 7 суток, при этом ТЭС назначалась в 1 сутки до проведения оперативного вмешательства.
ТЭС-терапия экспериментальным животным проводилась модифицированным двухпрограммным электростимулятором «ТРАНСАИР-03» (г. С.-Петербург, Россия) в анальгетическом режиме. Параметры транскраниальной электростимуляции для крыс представлены в таблице 1.
Расположение подкожных игольчатых электродов фронто-мастоидальное (два катода помещены на лоб в надбровных областях, сдвоенный анод – позади ушных раковин). Длительность сеанса во всех случаях составляла 45 минут.
Таблица 1
Параметры электрического тока, использованного при проведении ТЭС-терапии в режиме анальгезии у крыс
|
Частота, Гц |
Длительность импульса, мс |
Величина суммарного тока, мА |
|
70±2 |
3,75±0,25 |
0,6-2,5 |
Для изучения динамики процессов свободнорадикального окисления (СРО), состояния системы АОЗ при моделировании ИИ и влияния на эти процессы ТЭС-терапии забор крови у экспериментальных животных осуществляли после выведения их из эксперимента на 1, 3, 7 и 14 сутки по 20 животных во 2 и 3 группе. Забор крови производился по общепринятой методике. Контролем служили показатели группы интактных крыс (n=20). В эритроцитарной массе изучалась активность ферментов первой и второй линии системы АОЗ крови – супероксиддисмутазы (СОД) и каталазы (КАТ). Активность КАТ исследовали в гемолизате эритроцитов по спектрофотометрическому методу, предложенному R. Beers et all (1952) в авторской модификации И.И. Павлюченко и соавт., (2006) [2], основанному на оценке скорости убыли субстрата фермента (перекиси водорода). Активность СОД определяли в гемолизате эритроцитов по методу предложенному В.А. Костюк и соавт. (1990) в авторской модификации И.И. Павлюченко и соавт. (2006) [2]. В плазме крови изучались биофизическими методами общая антиоксидантная активность (АОА) и уровень максимальной вспышки хемилюминесценции (МХВЛ). Интенсивность МВХЛ определялась с помощью люминотестера ЛТ-01 в составе системы для диагностики ОС [4], позволяющей регистрировать амплитуду и площадь хемилюминесценции. Способ основан на измерении электрического тока, возникающего при окислении биологического образца на поверхности рабочего электрода при определенном потенциале. Использовалась стандартная методика [А.Я. Яшин и соавт., 2003] в модификации [А.А. Басов и соавт., 2007].
Результаты и их обсуждение. При изучения показателей системы про-/ антиоксиданты были выявлены существенные сдвиги в системе АОЗ крови уже на 1 сутки, причем в этот период примерно одинаковые во 2 и 3 группах (рис.1).
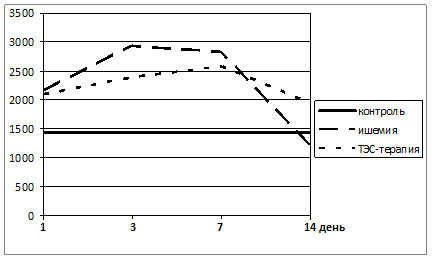
Рисунок 1. Динамика показателей АОА плазмы крови экспериментальных животных с моделированным ИИ (группа 2) и с моделированным ИИ на фоне ТЭС-терапии (группа 3)
АОА плазмы крови во 2 группе экспериментальных животных на 1 сутки моделирования ИИ достоверно (p≤0,05) возросла в среднем на 49 % в 3 группе – на 45 % (p≤0,05) относительно показателей 1 контрольной группы животных, что отражает напряжение в системе АОЗ в ответ на ОС при остром оперативном вмешательстве. В дальнейшем показатель АОА плазмы возрастал еще более выражено, но в разной степени в наблюдаемых группах. Во 2 группе на 3 сутки показатель АОА был достоверно (p≤0,05) выше контрольных значений в среднем на 103 %, в 3 группе – на 65 % (p≤0,05) и такое повышение данного биофизического показателя сохранялось вплоть до 7 суток в обеих группах. На 14 сутки наблюдения отмечалось резкое снижение АОА плазмы крови, при этом во 2 группе происходил обвал этого показателя ниже контрольных значений на 16 % (p≤0,05), а в 3 группе снижение было менее выраженное, и показатель оставался выше данных группы контроля в среднем на 35 % (p≤0,05). Данная динамика показателей АОА плазмы крови у животных с моделированным ИИ свидетельствует о выраженном состоянии ОС, который прогрессирует во времени. На фоне проводимой ТЭС-терапии его течение менее агрессивное.
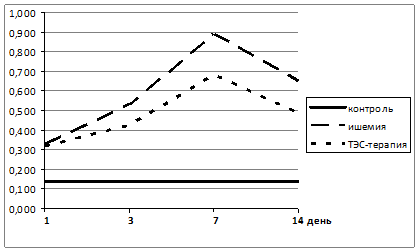
Рисунок 2. Динамика показателей ХЛ плазмы крови экспериментальных животных с моделированным ИИ (группа 2) и с моделированным ИИ на фоне ТЭС-терапии (группа 3)
Выраженность оксидативной нагрузки подтвердил показатель ХЛ, отражающий накопление продуктов СРО в биологических жидкостях и тканях организма (рис. 2).
Уровень ХЛ на 1 сутки после моделирования ИИ во 2 и 3 группах был достоверно (p≤0,05) выше значений контрольной группы животных в 2,4 и 2,3 раза соответственно. На 3 сутки интенсивность прооксидантной нагрузки достоверно (p≤0,05) возрастала, причем более выражено во 2 группе животных. Показатель ХЛ плазмы крови в этот период во 2 группе был достоверно (p≤0,05) выше показателя контроля в 3,9 раза, а в 3 группе – в 3,1 раза. На 7 сутки отмечен максимальный подъем уровня продуктов СРО в плазме крови экспериментальных животных, что выразилось в достоверном (p≤0,05) повышении показателя ХЛ во 2 и 3 группах (в 6,5 и 5,0 раз соответственно). К 14 суткам отмечено достоверное (p≤0,05) снижение уровня ХЛ плазмы крови относительно 7 суток, но уровень этого показателя прооксидантной нагрузки оставался высоким и в этот период. Он достоверно (p≤0,05) превышал показатель контроля во 2 группе в 4,7 раза, а в 3 группе в 3,6 раза и оставался даже выше показателей 1 суток. Данный факт является подтверждением выраженных метаболических сдвигов в организме при возникновении ишемических катастроф в мозговых тканях.
Для более детального понимания характера сдвигов в системе АОЗ-СРО необходимо изучать и оценивать, прежде всего, состояние эндогенных антиоксидантов, образование и функционирование которых зависит от общих метаболических процессов в организме и степени их защищенности. Отражением этого является активность ферментов 1 и 2 линии антирадикальной и антиоксидантной защиты – СОД и КАТ. При изучении их активности в крови экспериментальных животных наблюдаемых групп подтвердилось наличие значительного дисбаланса в системе АОЗ организма при развитии ИИ. Активность СОД значительно повышалась при моделировании ИИ с первых суток наблюдения (рис.3). Так, активность СОД уже на 1 сутки эксперимента достоверно (p≤0,05) возросла во 2 и 3 группах, относительно группы контроля, на 38,5 % и 30,7 % соответственно. При этом необходимо отметить, что уже в этот период у экспериментальных животных 3 группы на фоне ТЭС-терапии отмечен менее выраженный сдвиг в активности СОД. На 3–7 сутки возрастало напряжение в системе АОЗ и происходило дальнейшее повышение активности СОД. На 3 сутки показатель достоверно (p≤0,05) увеличивался во 2 и 3 группах, относительно контрольных значений, соответственно на 61,5 % и 46,2 %, и на 7 сутки на 153,8 % и 69,2 % соответственно. Это свидетельствует о максимальном напряжении системы АОЗ в этот период у экспериментальных животных с моделированным ИИ и ОС. Однако он значительно менее выражен на фоне проводимой ТЭС-терапии в 3 группе. К 14 суткам отмечено снижение активности СОД, при этом во 2 группе показатель оставался выше контрольных значений на 23,1 %, а в 3 группе практически возвращался к нормальным значениям (рис. 3).
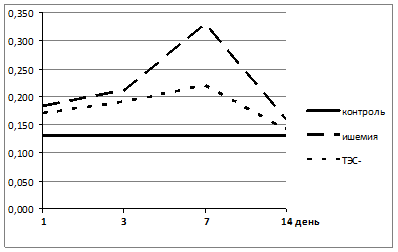
Рисунок 3. Динамика показателей активности СОД эритроцитов экспериментальных животных с моделированным ИИ (группа 2) и с моделированным ИИ на фоне ТЭС-терапии (группа 3)
Это, с одной стороны, свидетельствует об истощении эндогенных ресурсов антирадикальной защиты на фоне процессов ишемия/реперфузия, после частичного восстановления мозгового кровообращения, а, с другой, о компенсаторном значении активации стресс-лимитирующих систем. В отличие от активности СОД, активность фермента 2 линии антиоксидантной защиты КАТ эритроцитов была сниженной у экспериментальных животных 2 группы с моделированным ИИ на всем протяжении эксперимента (рис. 4).
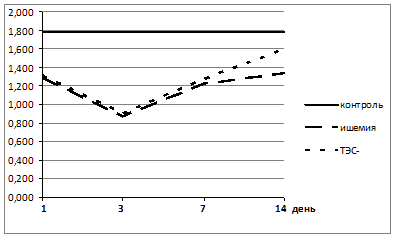
Рисунок 4. Динамика показателей активности КАТ эритроцитов экспериментальных животных с моделированным ИИ (группа 2) и с моделированным ИИ на фоне ТЭС-терапии (группа 3)
При этом необходимо отметить тот факт, что отличия в динамике КАТ в обеих группах были похожи. В 1 сутки, после моделирования ИИ, активность КАТ была достоверно (p≤0,05) ниже контрольных значений у животных 2 и 3 групп на 28,5 % и 26,9 % соответственно, на 3 сутки – на 51,4 % и 49,7 % соответственно. В последующем отмечен некоторый рост активности КАТ эритроцитов у экспериментальных животных обеих групп, но ее показатели не возвращались к значениям контрольной группы и к 14 суткам оставались достоверно (p≤0,05) ниже во 2 и 3 группах на 25,7 % и 10,6 % соответственно. Следовательно, необходимо отметить, что на фоне проведения ТЭС-терапии активность КАТ имела более позитивную динамику.
Особенно обращает внимание дисбаланс в работе двух основных ферментов системы АОЗ. Необходимо также отметить некоторые особенности в изменении активности ферментов на фоне ТЭС-терапии у животных 3 группы. Хотя динамика изменения активности ферментов была похожа во 2 и 3 группах экспериментальных животных, но на фоне ТЭС-терапии имели место более сглаженные сдвиги в изменении показателей системы АОЗ относительно группы контроля. Однако можно отметить более благоприятное изменение активности СОД, которая была значимо повышена в обеих группах, у животных с моделированным ИИ на фоне ТЭС-терапии. При этом к 14 суткам активность СОД у животных с моделированным ИИ на фоне использования ТЭС-терапии практически возвращалась к норме. Менее выражен был и дисбаланс в активности изучаемых ферментов, что свидетельствует о меньшей истощенности и дисфункции системы АОЗ на фоне проведения ТЭС-терапии.
Выводы. На основании полученных результатов можно сделать заключение, что положительные эффекты ТЭС-терапии в большей степени объясняются ее гомеостатическими свойствами, что описано в литературе [6]. Это связано с особенностями действия защитных пептидов мозга, прежде всего β-эндорфина, которые обладают обезболивающими свойствами и способностью модулировать действия некоторых гормонов, но и будучи веществами пептидной природы сами могут обладать прямыми антиоксидантными свойствами. Это важно для тканей головного мозга. При развитии ишемии ткани мозга, гипоксических состояниях применение ТЭС-терапии оказывается весьма важным с патофизиологической точки зрения.
Рецензенты:
Брин В.Б., д.м.н., профессор, заведующий кафедрой нормальной физиологии ГБОУ ВПО СОГМА Минздрава России, г. Владикавказ.
Колесникова Н.В., д.б.н., профессор, заведующая ЦНИЛ Отдела клинической экспериментальной иммунологии и молекулярной биологии ГБОУ ВПО КубГМУ Минздрава России, г. Краснодар.



