Иксодовые клещевые боррелиозы (ИКБ) представляют собой группу этиологически близких природно-очаговых трансмиссивных заболеваний, характеризующихся полиморфизмом клинической симптоматики с вовлечением в патологический процесс нервной, сердечно-сосудистой систем, кожных покровов, опорно-двигательного аппарата [2; 3]. Вместе с тем скудные патогномоничные проявления заболевания, медленный антителогенез значительно затрудняют своевременную верификацию диагноза, что обусловливает отсутствие адекватного лечения и, как следствие, формирование хронического течения ИКБ с развитием порой необратимых органных поражений [3]. Распознавание как можно ранних клинических проявлений хронического ИКБ приобретает медико-социальную значимость, т.к. эффективное лечение непосредственно инфекционного процесса предупредит развитие необратимых органных поражений, нередко приводящих к инвалидности лиц молодого трудоспособного возраста.
Известно, что клинические проявления боррелиозной инфекции тесно связаны с иммунореактивностью организма человека [3; 10]. Состояние иммунной системы пациента определяет не только исход заболевания, но и степень компенсаторных резервов организма, направленных на инактивацию инфекционного процесса. Глубина дефектов иммунного статуса и продукции цитокинов прямо коррелирует с длительностью и степенью иммуносупрессии, а следовательно, и с продолжительностью заболевания [4; 10]. Поэтому изучение иммунного статуса пациентов с хроническим течением ИКБ необходимо для определения риска развития глубоких нарушений гомеостаза и иммунодефицитных состояний.
Нейроборрелиоз является одним из клинических проявлений заболевания, и характеризуется поражением как центральных (ЦНС), так и периферических (ПНС) отделов нервной системы [1; 7]. Неврологическая симптоматика включает в себя весьма обширный спектр клинических проявлений, однако патогномоничные критерии нейроборрелиоза практически отсутствуют [7; 9]. Единственным характерным признаком нейроборрелиоза является сочетанное поражение ЦНС и ПНС (синдром Баннварта), включающее одномоментное развитие серозного менингита, мононеврита n. facialis и люмбалгии [7]. Длительное течение инфекционного процесса при отсутствии адекватной этиопатогенетической терапии с включением иммунокорректоров может привести к необратимым органным неврологическим поражениям, ведущим к снижению качества жизни, а в отдельных случаях к инвалидности больных трудоспособного возраста [6; 9]. Поэтому совершенствование клинико–иммунологической диагностики хронического нейроборрелиоза является необходимым перспективным направлением для определения дальнейшей тактики ведения пациентов.
Целью настоящего исследования является определение закономерностей клинических проявлений хронического нейроборрелиоза с учетом иммунного и цитокинового статуса пациентов.
Материалы и методы исследования
Клинические наблюдения выполнены на 86 пациентах (исследуемая группа) с хроническим нейроборрелиозом, находившихся на стационарном лечении в условиях инфекционного отделения Городской клинической больницы скорой медицинской помощи им. Н.С. Карповича г. Красноярска, их них 47 (54,6%) мужчин и 39 (45,3%) женщин; средний возраст составил 44,6±3,5 года. Для сравнения лабораторных показателей сформирована контрольная группа здоровых доноров (n=35), сопоставимая по возрасту (F=0,05; р>0,1) и полу (χ2=0,17; р>0,1) с исследуемой группой.
Диагноз подтверждали обнаружением специфических антител классов IgM и IgG к боррелиям методом иммуноферментного анализа с применением тест-систем производства ЗАО «Вектор-Бест» (г. Кольцово Новосибирской области).
Для оценки иммунного статуса пациентов изучали клеточное, фагоцитарное и гуморальное звенья иммунной системы. Рассчитывали абсолютное количество лимфоцитов (АКЛ), абсолютное количество CD3+ клеток, число фагоцитирующих нейтрофилов (ЧФН) по соответствующим формулам. Уровень CD3+, CD4+, CD8+ определяли методом преципитации в геле. Оценку фагоцитарной активности нейтрофилов проводили латекс-тестом с определением фагоцитарного индекса (ФИ) и фагоцитарного числа (ФЧ). Гуморальное звено иммунитета изучали по содержанию в крови общих IgM и IgG методом простой радиальной иммунодиффузии по G. Mancini с соавт. (1965).
Уровень цитокинов (IL–1b, IL–4, IL–8, TNF–a) в крови определяли методом иммуноферментного анализа с применением тест-систем производства ЗАО «Вектор-Бест». Референсными значениями считали для IL-1b – до 5 пг/мл, для IL-4 – до 6 пг/мл, для IL-8 – до 62 пг/мл, для TNF-a – до 8,21 пг/мл.
Пациентам с поражением ЦНС при отсутствии общепринятых противопоказаний проводили люмбальную пункцию с последующим цитологическим и молекулярно-генетическим (полимеразная цепная реакция – ПЦР) исследованием ликвора. Для визуализации структуры, функции и исследования биохимических характеристик головного мозга применяли магнитно-резонансную томографию (МРТ) магнитно-резонансным томографом Siemens Magnetom 1,5T (Нидерланды).
Критериями исключения из исследования являлись беременность, лактация, сопутствующие острые и другие хронические инфекционные заболевания, а также тяжелые соматические заболевания, способные повлиять на чистоту эксперимента (сахарный диабет, злокачественные новообразования, органические поражения ЦНС, инсульты, черепно–мозговые травмы в анамнезе).
Статистическая обработка результатов исследования проведена с применением пакета статистических программ Statistica for Windows 6.0. Фактические данные представлены в виде «средней ± ошибки среднего» (М±m). Описательные статистики для качественных признаков представлены абсолютными значениями и процентными долями. Для определения достоверности различий независимых выборок применяли непараметрический U-критерий Манна-Уитни. Анализ таблиц сопряженности проводили с использованием критерия согласия хи-квадрат (c2). Количественную связь признаков оценивали по F–критерию однофакторного дисперсионного анализа. Критический уровень значимости при проверке статистических гипотез в исследовании принимали равным 0,05.
Результаты и обсуждение
Клинические проявления нейроборрелиоза характеризовались наиболее частым вовлечением в патологический процесс соматической ПНС – в 93,0±2,8% случаев, причем в сочетании с поражением опорно-двигательного аппарата в 48,8±5,4% случаев, в сочетании с поражением ЦНС – в 1,2±1,2% случаев. Поражение соматической ПНС характеризовалось мононевритом плечевого нерва (n=17, 19,8±4,3%), бедренного нерва (n=17, 19,8±%), лицевого нерва (n=9, 10,5±3,3%), тройничного нерва (n=12, 14,0±3,7%), отводящего нерва (n=4, 4,7±2,3%), полирадикулоневритом (n=21, 24,4±4,6%; рис. 1). Мононевриты плечевого, бедренного и тройничного нервов регистрировались чаще, и наблюдались в основном у пациентов после перенесенных безэритемной формы болезни и сочетанного течения ИКБ и КЭ. Полирадикулоневрит с преимущественным поражением шейного и поясничного отделов позвоночника сопровождался умеренным корешковым синдромом, люмбалгиями, цервикалгиями.
Тяжелые поражения ЦНС наблюдались у пациентов с хроническим ИКБ после ранее перенесенной субклинической формой заболевания, что и явилось причиной госпитализации, в ходе которой диагноз был верифицирован (рис. 1). При ПЦР–диагностике ликвора была выявлена ДНК боррелий. Серозный менингит (2,3±1,6%) и менингоэнцефалит (2,3±1,6%) сопровождались менингеальной симптоматикой, лимфоцитарным плеоцитозом в ликворе, в случаях менингоэнцефалита – незначительной белково–клеточной диссоциацией.
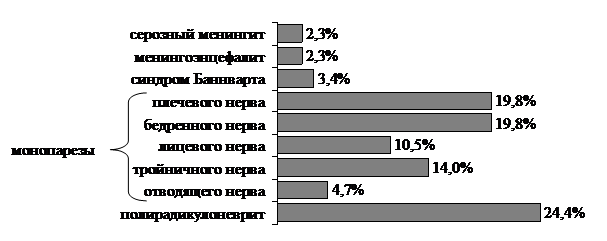
Рисунок 1. Спектр клинических проявлений нейроборрелиоза при хроническом течении инфекционного процесса
Сочетанное поражение ЦНС и ПНС характеризовалось синдромом Баннварта, и наблюдалось у 3 (3,4±2,0%) пациентов. Клиническое течение симптомокомплекса, безусловно, сопряжено с боррелиозной инфекцией, т.к. известно, что для КЭ не характерно глубокое поражение ПНС [1; 6; 8; 9]. Заболевание характеризовалось постепенным началом с явлений интоксикации и нарастанием лихорадки от субфебрильных цифр до умеренной. У наблюдаемых больных лихорадочный период в целом составил 5–9 дней. Неврологическая симптоматика также развивалась постепенно на 4–6-й день болезни: начальным клиническим проявлением во всех случаях являлся серозный менингит, характеризовавшийся умеренно выраженным менингеальным синдромом, лимфоцитарным плеоцитозом в ликворе при наличии умеренной клеточно-белковой диссоциации. На 2–3-й день явлений менингита развивались люмбалгии, сохраняющиеся 3–5 недель, а также односторонний умеренно выраженный неврит n. facialis.
Органическое поражение ЦНС выявлено лишь у 1 (1,2%) пациента при длительном течении ИКБ (около 2-х лет) при отсутствии своевременной верификации диагноза, а следовательно, адекватной этиопатогенетической терапии. Клинические проявления характеризовались постоянной головной болью на фоне субфебрильного повышения температуры тела, снижением памяти, концентрации внимания. По результатам МРТ головного мозга выявлены мультифокальные очаги преимущественно белого вещества обоих полушарий и левой гемисферы мозжечка (рис. 2). В результате этиопатогенетической терапии клиническая симптоматика регрессировала, согласно результатам МРТ головного мозга, проведенного через 6 месяцев, количество очагов поражения белого вещества уменьшилось.
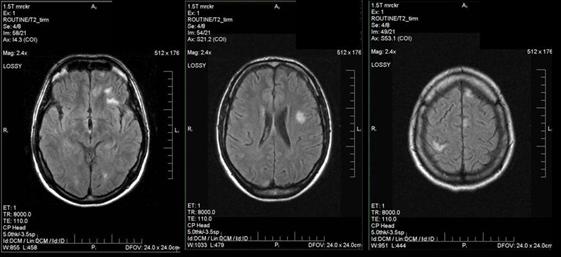
Рисунок 2. МРТ головного мозга – очаговое поражение головного мозга
при хроническом нейроборрелиозе
Изменения иммунного статуса у наблюдаемых пациентов характеризовались снижением АКЛ и доли цитотоксических CD8+ клеток (р<0,05 в сравнении с контролем), снижением уровня абсолютного и процентного количества CD3+ клеток, CD4+ клеток относительно контроля. Показатели фагоцитоза были сопоставимы с контролем, что косвенно свидетельствует о несостоятельности макрофагально-фагоцитарного звена иммунной системы. Со стороны гуморального звена иммунитета отмечались высокое содержание общих IgM и дефицит общих IgG (р<0,05 в сравнении с контролем; табл. 1).
Таблица 1- Иммунный и цитокиновый статус при хроническом нейроборрелиозе (M±m)
|
Показатели |
Контрольная группа |
Исследуемая группа |
р |
Показатели |
Контрольная группа |
Исследуемая группа |
р |
|
АКЛ/мкл-1 |
1858,1±97,8 |
1189,5±67,2 |
<0,05 |
ЧФН |
1680,9±183,9 |
1036,2±142,5 |
>0,05 |
|
CD3+ (абс.) |
1175,3±74,5 |
785,6±67,5 |
<0,001 |
IgM (г/л) |
1,6±0,1 |
2,1±0,1 |
<0,05 |
|
CD3+ (%) |
62,9±1,6 |
43,6±2,3 |
<0,05 |
IgG (г/л) |
18,7±0,7 |
12,5±0,4 |
<0,05 |
|
CD4+ (%) |
38,0±1,8 |
29,8±1,5 |
<0,05 |
IL–1β (пг/мл) |
83,8±7,9 |
195,5±19,2 |
<0,001 |
|
CD8+ (%) |
28,5±1,1 |
20,3±1,3 |
<0,05 |
IL–4 (пг/мл) |
47,6±4,0 |
30,7±3,9 |
<0,001 |
|
ФИ |
47,5±3,2 |
51,2±2,6 |
>0,05 |
IL–8 (пг/мл) |
72,9±7,2 |
112,4±6,6 |
<0,001 |
|
ФЧ |
6,1±0,6 |
5,1±0,7 |
>0,05 |
TNF–α (пг/мл) |
6,8±0,6 |
7,9±1,2 |
>0,05 |
Известно, что любая хроническая инфекция сопровождается изменениями реактивности иммунной системы, маркером чего отчасти является цитокиновый статус [5; 10]. У наблюдаемых пациентов отмечался повышенный синтез IL–1β и IL–8, дефицит продукции IL–4. Уровень TNF–α в исследуемой группе был сопоставим с контролем (табл. 1).
Заключение
Хроническое течение ИКБ с преимущественным поражением нервной системы характеризовалось в подавляющем большинстве случаев патологическими проявлениями со стороны соматической ПНС. Органическое поражение ЦНС установлено лишь у одного больного, по результатам МРТ головного мозга которого определялось мультифокальное очаговое поражение вещества головного мозга.
Перестройка иммунной системы при хроническом нейроборрелиозе сопровождалась клеточным иммунодефицитом, несостоятельностью макрофагально–фагоцитарного звена. Повышенный синтез общих IgM и дефицит общих IgG, по всей вероятности, сопряжен со специфическим иммунным ответом.
Патогенетической основой заболевания является воспалительный процесс, о чем свидетельствует повышенный синтез провоспалительных цитокинов IL–1β и IL–8 и дефицит продукции IL–4.
Описанные клинические проявления хронического нейроборрелиоза, сопровождаемые изменениями иммунного и цитокинового статуса, следует учитывать врачам амбулаторно-поликлинического звена, т.к. основная неврологическая симптоматика как проявление хронического течения ИКБ неспецифична и требует верификации диагноза с последующим включением антибактериальной и иммунокорригирующей терапии.
Рецензенты:
Тихонова Е.П., д.м.н., профессор, зав. кафедрой инфекционных болезней и эпидемиологии с курсом последипломного образования Красноярского государственного медицинского университета им. проф. В.Ф. Войно-Ясенецкого, г. Красноярск.
Мартынова Г.П., д.м.н., профессор, зав. кафедрой детских инфекционных болезней с курсом последипломного образования Красноярского государственного медицинского университета им. проф. В.Ф. Войно-Ясенецкого, г. Красноярск.



