В современных условиях здоровье человека во многом определяется качеством продуктов питания, содержащих все необходимые микроэлементы, в том числе и селен. Учитывая, что до 80% населения России имеет недостаточную обеспеченность селеном [4; 12; 16], в настоящее время проводится синтез и использование органических форм селена для профилактики селенодефицита и ряда заболеваний (беломышечной болезни, некроза и жирового перерождения печени, экссудативного диатеза, энцефаломаляции, расстройства сперматогенеза и др.) [1; 6; 15].
Интерес к селену и его соединениям связан с перспективами их использования в медицине, ветеринарии и сельском хозяйстве. Основной функцией селена и селенсодержащих соединений является их участие в синтезе селенопротеинов и селеноферментов, защищающих клетки от действия активных форм кислорода, ионов тяжелых металлов и других токсикантов.
Главным антиоксидантным селенозависимым ферментом является глутатионпероксидаза (ГПО), способная разлагать токсичную перекись водорода до двух молекул воды.
Однако исследования последних лет показывают [21; 22; 26; 27], что перекись водорода является важной регуляторной молекулой и участвует в передаче рецептор-опосредованного сигнала в клетки.
Основная часть перекиси водорода в клетках образуется в процессе дисмутации супероксид-анион радикала (O2− ∙). Последний образуется в процессе функционирования дыхательной цепи переноса электронов (ЦПЭ) путем одноэлектронного восстановления кислорода ферментами комплексов I и III ЦПЭ, а также глицерол-3-фосфатдегидрогеназы. Большая часть супероксида обезвреживается с образованием перекиси водорода под действием Mn-зависимой супероксиддисмутазы (Mn-СОД) в матриксе митохондрий или под действием Cu/Zn-СОД в цитозоле.
Другим важным источником Н2О2 является НАДФН-оксидаза (Nox), участвующая в работе фагоцитирующих иммунных клеток за счет выработки большого количества супероксида, необходимого для уничтожения поглощенных патогенных клеток. НАДФН-оксидаза обнаружена на внутренней поверхности плазматической мембраны нефагоцитирующих клеток, где она связана с цитоплазматическими доменами рецепторов. Известны 7 НАДФН-оксидаз: Nox1-Nox5 и двойные оксидазы 1 и 2. При связывании специфического лиганда с рецептором НАДФН-оксидаза активируется и вырабатывает супероксид, который затем превращается в пероксид водорода под действием СОД. Недавние исследования показали [20], что перекись водорода может вырабатываться непосредственно при образовании лиганд-рецепторного комплекса. Образованный супероксид и/или перекись водорода вызывают активацию киназной активности комплекса, который запускает серию реакций фосфорилирования белков, специфичных для этого рецептора.
Например, связывание инсулина с рецептором инициирует каскадный механизм передачи сигнала в клетку. Участниками этого процесса являются субстрат инсулинового рецептора (IRS-ИРС), протеин-тирозин-фосфатаза (PTP-ПТФ) и протеинкиназа В (серин/треонинкиназаAkt), а также транскрипционный фактор О1а (Fox) и его пероксисомальный пролифератор - активированный рецепторный гамма-коактиватор (PGC)-1α (рис. 1).
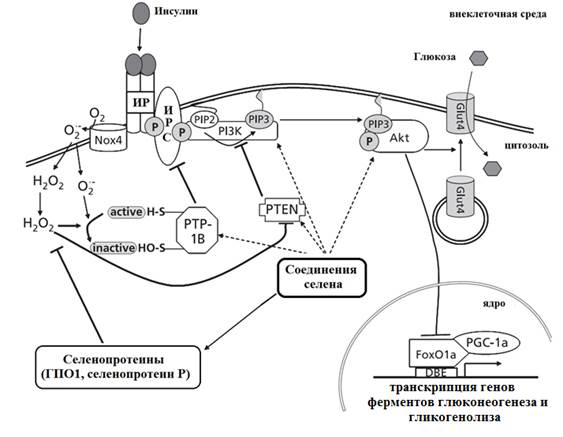
Рис. 1. Схема потенциальной активности селена на компоненты инсулинового каскада передачи сигнала. Селенопротеины и низкомолекулярные соединения селена могут вмешиваться в различные стадии инсулин-индуцированной трансдукции сигнала, в конечном счете приводя к разлаживанию углеводного метаболизма (адаптировано на русский язык по [29]). Обозначения: ИР – инсулиновый рецептор; ИРС – субстрат инсулинового рецептора, Nox4 – НАДФН-оксидаза; PI3K – фосфоинозитид-3-киназа; PIP3 – фосфатидилинозитол-3,4,5-трисфосфат; Akt – протеинкиназа В (серин/треонинкиназа); GLUT4 – белок-транспортер глюкозы; РТЕN – протеинфосфатаза с двойной специфичностью; РТР-1В – протеин тирозинфосфатаза; DBE – деветвящий фермент; FoxO1a – «вилкоголовый» бокс; PGC-1a – пероксисомальный пролифератор - активированный рецепторный гамма-коактиватор.
При связывании инсулина со своим рецептором на плазматической мембране адипоцита инсулин стимулирует кратковременный «взрыв» активных форм кислорода (АФК): супероксида и перекиси водорода. Это происходит благодаря тому, что инсулин активирует НАДФН-оксидазу (Nox4) для выработки супероксида, который затем превращается в перекись водорода. Это небольшое количество перекиси водорода служит вторичным посредником, который уменьшает активность фосфатаз с редокс-чувствительными остатками цистеина и таким образом увеличивает фосфорилирование компонентов сигнального каскада инсулина (рис. 1).
Поверхностные клеточные рецепторы, вырабатывающие АФК после активации, включаются эпидермальным фактором роста, фактором роста тромбоцитов, инсулиноподобным фактором роста, фактором роста сосудов и различными цитокинами.
АФК регулируют аутофагию, проникновение кальция в митохондрии и освобождение кальция из эндоплазматического ретикулума, который необходим для проведения кальциевого сигнала к митохондриям. АФК, образованные в митохондриальной ЦПЭ, выходят в цитоплазму, где они могут реагировать с молекулами-мишенями, чтобы запустить клеточный ответ.
Благодаря такому участию перекиси водорода в жизни клетки можно назвать ее новым вторичным посредником.
Концентрация перекиси водорода зависит от активности ГПО в различных тканях. Вместе с тем синтез ГПО напрямую зависит от поступления в организм селена и от метаболизма главного селен-транспортного белка селенопротеина Р (М=57кД, в его составе 10 или 11 атомов селена), который синтезируется, главным образом, в печени и обеспечивает периферические ткани селеном [29]. Селенопротеин Р представляет собой биомаркер селенового статуса, поскольку его концентрация в плазме повышается в ответ на различные пищевые формы и дозы селена.
У человека промотор селенопротеина Р состоит из связывающего участка для транскрипционного фактора FoxO 1a, локализованного в непосредственной близости от связывающего участка для ядерного фактора 4α (HNF-4α) гепатоцитов. Этот участок обнаружен в промоторах селенопротеина Р человека, крыс, мышей; он обусловливает высокий уровень экспрессии селенопротеина Р в печени и гормональную регуляцию транскрипции печеночного селенопротеина Р. Транскрипционный фактор FoxO 1a также участвует в регуляции экспрессии генов ферментов глюконеогенеза и гликогенолиза (рис. 2). Оба транскрипционных фактора (FoxO 1a и HNF-4α) коактивируются PGC-1α (пероксисомный пролифератор - активированный рецепторный гамма-коактиватор), который действует как «молекулярный переключатель» в ответ на гормоны, такие как инсулин, глюкагон и глюкокортикоиды. Хорошо известно контролирующее влияние этих гормонов на продукцию глюкозы печенью и уровень глюкозы крови. Инсулин ингибирует транксрипцию гена селенопротеина Р через ось PI3K/Akt/FoxO 1a, тогда как PGC-1α-индукция глюкокортикоида дексаметазона значительно увеличивает уровни мРНК селенопротеина Р в культуре гепатоцитов крысы [28]. Введение глюкокортикоидного препарата дексаметазона per os приводит к перераспределению селена у мышей, вызывая уменьшение активности печеночной ГПО в пользу повышения уровня селена в составе селенопротеина Р в плазме крови.
Следовательно, комплекс между FoxO1а и его коактиватором PGC-1α играет чрезвычайно важную роль для транскрипционной регуляции как ферментов глюконеогенеза – глюкозо-6-фосфатазы (Г6Фаза) и фосфоенолпируваткарбоксикиназы (ФЕПКК) [23; 32], так и селенопротеина Р [28], обеспечивая гипотетическую связь между метаболизмом селена и углеводным обменом.
Можно предположить, что селенопротеин Р и низкомолекулярные соединения селена могут затрагивать инсулин-индуцированные сигнальные пути, регулирующие углеводный и липидный обмены.
Кроме того, следует отметить, что повышение печеночного PGC-1α приводит не только к развитию гипергликемии, но и к нарушению гомеостаза селена. Например, антигипергликемическое средство метформин широко применяется для лечения сахарного диабета 2 типа, поскольку он подавляет выработку печенью глюкозы и повышает чувствительность к инсулину периферических тканей. Параллельно с глюконеогенезом метформин ослабляет биосинтез и секрецию селенопротеина Р in vitro, а также снижает биодоступность селена во внепеченочных тканях и за счет этого ослабляет экспрессию и активность селеноферментов in vivo [29].
Глюкокортикоидный препарат дексаметазон, напротив, приводит к увеличению секреции селенапротеина Р печенью и развитию гипергликемии. Гипергликемический эффект дексаметазона можно объяснить его индуцирующим действием на экспрессию гена киназы пируватдегидрогеназы [25], следствием чего является снижение активности этого мультиферментного комплекса, замедление процесса окисления глюкозы и накопление пирувата и глюкозы в цитозоле клеток. Кроме того, дексаметазон уменьшает фосфорилирование фермента гликогенсинтазы, что приводит к восстановлению ее активности. Избыток глюкозы (при наличии активной гликогенсинтазы) используется для синтеза гликогена в печени, скелетных мышцах и миокарде [24; 25]. Также следует отметить, что глюкортикоиды увеличивают экспрессию ферментов глюконеогенеза - глюкозо-6-фосфатазы и фосфоенолпируваткарбоксикиназы [31], что влечет за собой усиление реакций глюконеогенеза в печени, выход свободной глюкозы в кровь и развитие гипергликемии. Глюкокортикоиды усиливают гипергликемию также за счет снижения поступления глюкозы в клетки периферических тканей [18; 19; 30].
Подводя итог, можно заключить, что поступление селена с пищей и/или в составе синтетических селенсодержащих препаратов приведет к усилению синтеза селенопротеина Р и ферментов глюконеогенеза в печени.
Действительно, в исследованиях с применением различных неорганических (селенит и селенат натрия) и органических соединений селена (диацетофенонилселенид и селенопиран), проведенных на различных животных и птицах (коровы, быки, свиноматки, овцы, утки, гуси и пр.), показано увеличение концентрации глюкозы в крови [2; 5; 7; 9; 10].
Однако наиболее выраженное увеличение содержания глюкозы в плазме крови демонстрировали только селеноорганические препараты. Вместе с тем применение препарата диацетофенонилселенид (ДАФС-25) также приводило к изменению ряда других показателей углеводного обмена: повышению содержания гликогена в печени и крови, снижению концентрации пирувата в крови, а также увеличению активности глюкозо-6-фосфатазы в печени белых беспородных мышей [2]. Большинство из вышеперечисленных биохимических изменений свидетельствуют об усилении реакций глюконеогенеза в печени и снижении поступления глюкозы в клетки периферических тканей, что согласуется с литературными данными, приведенными выше.
Как известно, соединения селена участвуют в синтезе ГПО, разрушающей перекись водорода, в результате чего снижается концентрация Н2О2, что приводит к активации фосфатаз (РТР-1В и РТЕN) и, как следствие, к дезорганизации внутриклеточной передачи инсулинового сигнала (рис. 2). Результатом этого является, с одной стороны, снижение концентрации инозитол-1,4,5-трисфосфата в цитоплазме клетки и нарушение включения транспортера глюкозы (GLUT4) в цитоплазматическую мембрану клеток жировой и мышечной тканей, а, с другой, изменение экспрессии генов ферментов углеводного обмена. Такое действие соединений селена сравнимо с действием природных и синтетических глюкокортикоидов, что позволяет рассматривать соединения селена как потенциальные гормоноподобные препараты.
Подробное изучение отечественной литературы, касающейся биологической активности органических и неорганических соединений селена, демонстрирует интересные закономерности: органические соединения селена (ДАФС-25 иселенопиран) оказывают большее влияние на показатели углеводного и липидного обменов животных, чем неорганические (селенит натрия).
Результаты по применению препарата ДАФС-25 [5; 7; 9; 10] демонстрируют достоверное увеличение концентрации глюкозы в плазме крови от 26% [10] до 55% [7] по сравнению с контрольными группами животных. Во всех перечисленных выше работах также показано увеличение в крови концентрации общих липидов, α- и β-липопротеинов, а также фосфолипидов. Кроме того, обращает на себя внимание значительное увеличение концентрации общего белка и его фракций в сыворотке крови животных, принимавших препарат ДАФС-25, от 50% [10] до 73% [9].
Применение неорганического селенита натрия [11] сопровождалось увеличением концентрации глюкозы (на 18,2%), общего белка (на 6,8%) и общих липидов (на 32%).
Помимо этого, в большинстве работ, проведенных на сельскохозяйственных животных, обращает на себя внимание достоверное увеличение ежесуточного и общего прироста живой массы. Причем прирост живой массы животных, получавших селенит натрия, колебался в пределах от 4% [8; 11] до 5,4% [10], а принимавших ДАФС-25 - от 6% [17] до 10-13% [8; 10] у свиней; 12,4% у цыплят [13], до 39,3% у кроликов [10].
В работах [3; 8; 10; 13; 17] проводился сравнительный анализ влияния соединений селенита натрия и/или ДАФС-25 и/или селенопирана, показавших достоверное увеличение прироста живой массы в направлении селенопиран > ДАФС > селенит натрия по сравнению с контролем.
Особый интерес представляет работа Трошиной Т.А. [14], посвященная фармакокоррекции селенодефицита у животных препаратом ДАФС-25 и его влиянию на продуктивные качества, результаты которой показывают более высокий уровень активности гипофизарно-тиреоидно-надпочечниковой системы сельскохозяйственных животных и пушных зверей и полученного от них молодняка, а также активацию анаболических процессов и увеличение андрогенного статуса у жеребцов, обусловливающих их интенсивный рост. Кроме того, полученные результаты доказывают повышение адаптационных возможностей организма, стимулирование роста, активацию глюконеогенеза, за счет которого организм обеспечивался глюкозой на 85- 90% [14].
Таким образом, добавление в корма селеноорганических препаратов ДАФС-25 и селенопирана приводит к более значительному усилению роста животных по сравнению с селенатом натрия и контрольными животными.
Все вышеизложенное позволяет высказать предположение о возможном гормоноподобном действии препаратов ДАФС-25 и селенопирана. Анаболический эффект этих селеноорганических соединений, вероятно, обусловлен определенными чертами сходства препаратов с пространственной структурой нестероидных веществ, обладающих гормоноподобной активностью:
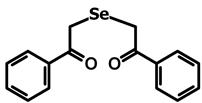
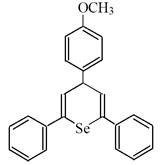
Диацетофенонилселенид (ДАФС-25) Селенопиран
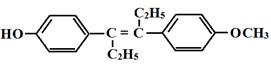
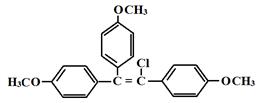
Метилстильбол Хлортрианизен (тейс)
Вероятно, диацетофенонилселенид и селенопиран в оптимизированных конформациях способны взаимодействовать с рецепторами стероидных гормонов и через них оказывать гормоноподобное действие на клетки животных.
Подводя итог, можно сделать вывод о возможности взаимодействия различных по строению нестероидных соединений с лиганд-связывающими доменами рецепторов стероидных гормонов (андрогенов, эстрогенов и глюкокортикоидов). Дальнейшие исследования в этой области помогут выявить потенциальные гормоноподобные вещества нестероидной природы, обладающие анаболическим, андроген/эстроген-модулирующим и противовоспалительным действием, что позволит правильно оценить их биологическую активность и корректно использовать в медицине, ветеринарии, животноводстве, птицеводстве и других областях народного хозяйства.
Рецензенты:
Горошинская И.А., д.б.н., профессор, руководитель биохимической лаборатории ФГБУ «Ростовский научно-исследовательский онкологический институт» Минздрава России, г.Ростов-на-Дону.
Коннова С.А., д.б.н., профессор, зав. кафедрой биохимии и биофизики ФГБУ ВПО «Саратовский государственный университет им. Н.Г. Чернышевского» Минобрнауки России, г. Саратов.



