Ежегодно сердечно-сосудистые заболевания становятся причиной 4,3 млн смертей в Европе и свыше 2 млн в странах Европейского союза, что составляет соответственно 48 и 42% от общего числа всех летальных исходов. Реконструкция артерий после травм зачастую требует наличия пластического материала для восстановления поврежденного участка. Для этих целей широко применяются сосудистые имплантаты, такие как аутовена, аутоартерия, различные изделия из синтетических материалов [1; 5; 6]. Одним из перспективных направлений современной хирургии является разработка новых имплантов, биологически инертных и одновременно адекватно замещающих утраченную органом структуру и даже функцию [4]. Именно возмещение утраченных в результате травм и оперативных вмешательств фрагментов сосудистой стенки путем имплантации сосудистых заплат позволяет не только восстановить морфологическую целостность сосудистой стенки, но и повысить надежность сосудистых швов, оптимизировать условия прорастания сосудистых заплат соединительной тканью и эндотелизации их поверхности [2; 3].
Учитывая то, что в состав стенки кровеносных сосудов входят все 4 вида истинных тканей, но наиболее важными для структурной и функциональной состоятельности сосудистой стенки являются соединительная и эпителиальная ткани, сравнительное исследование совместимости новых материалов и видов сосудистых заплат с указанными видами тканей наряду с научной актуальностью приобретает существенную научно-практическую значимость.
Цель исследования: в стандартизованных условиях эксперимента in vivo изучить реакцию волокнистой соединительной ткани на имплантацию новых образцов сосудистых заплат, применяемых для восстановления дефектов крупных сосудов.
Материалы и методы исследования
В качестве материалов для экспериментальных исследований были использованы новые образцы сосудистых заплат, разработанные авторами совместно с ООО «Линтекс» (г. Санкт-Петербург), представляющие собой плетеный сетчатый эндопротез (далее – «Л»), состоящий из лавсановых волокон. В качестве контроля изучалась реакция тканей на имплантацию плетеного лавсанового полотна такой же толщины производства ООО ПТГО «Север», г. Санкт-Петербург (далее – «С»).
Исследования проводили на 40 крысах-самцах линии Вистар массой 200-250 г, без внешних признаков заболеваний. Животные были разделены на две равные группы, в которых выполнялась подкожная имплантация сравниваемых образцов. Все манипуляции на животных выполнялись под общим наркозом с соблюдением принципов, изложенных в Конвенции по защите позвоночных животных, используемых для экспериментальных и других целей (г. Страсбург, Франция, 1986).
Под общим наркозом в стерильных условиях операционного блока кафедры оперативной хирургии и топографической анатомии им. А.Д. Мясникова Курского государственного медицинского университета крысам производили рассечение кожного и подкожно-жирового слоев по срединной линии живота. Тупым путем формировали два кармана между мышечным и кожным слоями (в подкожной клетчатке), расположенные по обе стороны срединного разреза, глубиной до 3,5 см и длиной на протяжении всего разреза. В каждый сформированный карман помещали образец сосудистой заплаты размером 1х1 см. Операционную рану ушивали наглухо с захватом мышечного слоя по срединной линии с целью изоляции карманов, содержащих экспериментальные образцы. Послеоперационную рану обрабатывали антисептиками.
После аутопсии животных проводили забор материала (участок ткани в месте внедрения имплантата) для приготовления гистологических препаратов. Парафиновые срезы окрашивали гематоксилин-эозином и по Маллори.
Микроскопирование и микрофотосъёмка на увеличениях х100 и х400 осуществлялись с помощью оптической системы, состоящей из светового микроскопа Leica CME, цифровой окуляр-камеры DCM - 500 и программы FUTURE WINJOE, входящей в комплект поставки окуляр-камеры.
Оценивали строение соединительнотканной капсулы, выраженность ее слоев и степень зрелости коллагеновых волокон. Также исследовали состав клеточного слоя капсулы, расположенный непосредственно вокруг нитей протеза. Клетки волокнистой соединительной ткани дифференцировали на основе кариологических признаков. Процентное соотношение указанных представителей клеточной популяции рассчитывали после подсчета 100 клеток в нескольких непересекающихся полях зрения.
Для подтверждения статистической значимости отличий между цифровыми показателями в сравниваемых группах животных нами проводилось вычисление значений доверительного интервала при заданном значении р ≤ 0.05 и определялось их расхождение. Вычисления значений проводили с использованием возможностей аналитического пакета приложения Excel 2010 (лицензия ГБОУ ВПО «Курский государственный медицинский университет» Минздрава России).
Результаты исследования и их обсуждение
При исследовании препаратов от животных 1 серии эксперимента (материал Л) установлено, что у всех животных вокруг протеза сформирована мощная капсула, имеющая неодинаковую толщину на протяжении и выраженную двухслойную организацию (рис. 1).
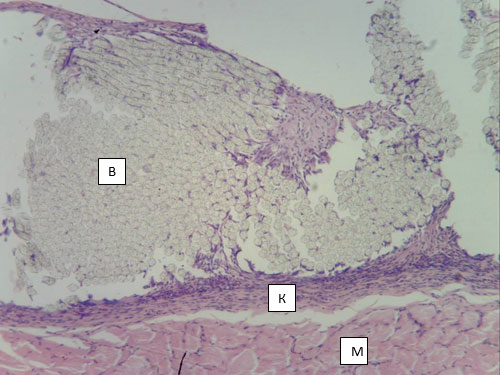
Рис. 1. Капсула вокруг протеза из материала Л. 14 суток после имплантации в переднюю брюшную стенку. Волокна протеза (В), капсула (К), пучки мышечных волокон (М). Окраска гематоксилин-эозином. Микрофото. Ув. х100.
Наружный слой капсулы представлен плотной волокнистой соединительной тканью (ПВСТ), состоящей из параллельно ориентированных пучков коллагеновых волокон, среди которых обнаруживаются ядра механоцитов, имеющие форму от округло-овальной до вытянутой. Следует отметить, что внутрь протеза от волокнистого слоя капсулы отходят трабекулы, также организованные из ПВСТ и как бы «разделяющие» пучки волокон протеза, и даже окружающие отдельные нити протеза (рис. 2). Синтетический потенциал механоцитов в таких трабекулах выше, о чем свидетельствует более округлая форма ядер и большее количество эухроматина в них. Это, а также меньшая оксифилия пучков волокон (особенно в местах отсутствия клеток – механоцитов) позволяют сделать вывод о меньшей степени зрелости коллагена в трабекулах по сравнению с наружной капсулой. Также следует указать на завершенность интеграции капсулы в соединительнотканную строму передней брюшной стенки - на всех без исключения препаратах не удается определить границу между волокнистым слоем капсулы и фасциями окружающих ее мышц (рис. 2).
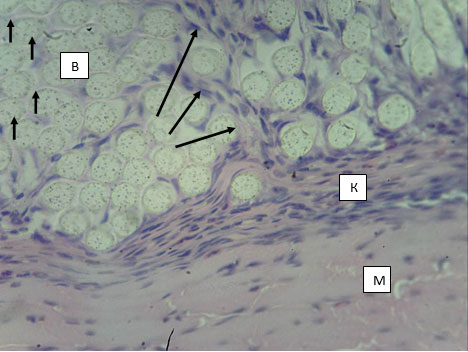
Рис. 2. Капсула вокруг протеза из материала Л. 14 суток после имплантации в переднюю брюшную стенку. Волокна протеза (В), капсула (К), пучки мышечных волокон (М). Трабекулы, отходящие от капсулы внутрь пучка волокон (указано длинными стрелками). Участок со сниженной оксифилией (указан короткими стрелками). Окраска гематоксилин-эозином. Микрофото. Ув. х400.
Анализ цифровых показателей клеточного состава капсулы (клеточного слоя) в этой серии исследования показывает, что более половины (59,2%) от общего количества клеток составляют клетки фибробластического ряда (табл. 1). А общее количество фагоцитирующих клеток и их предшественников достигает 25%.
Таблица 1
Соотношение различных типов клеток в клеточном слое перипротезной капсулы на 14-е сутки после имплантации
|
|
Фибро-бласты |
Фибро-циты |
Лимфо-циты |
Макро-фаги |
Нейтро-филы |
Эозино-филы |
Моно-циты |
|
|
Л |
M |
27,8* |
31,4* |
10,6* |
7,9* |
10,0 |
4,8* |
7,1 |
|
m |
3,64 |
3,50 |
1,75 |
2,84 |
2,59 |
1,62 |
2,44 |
|
|
t |
1,91 |
1,83 |
0,91 |
1,48 |
1,36 |
0,85 |
1,28 |
|
|
С |
M |
14,8 |
17,6 |
28,2 |
12,1 |
9,4 |
8,8 |
8,8 |
|
m |
2,61 |
2,52 |
3,25 |
3,47 |
1,06 |
1,33 |
1,38 |
|
|
t |
1,14 |
1,10 |
1,42 |
1,52 |
0,46 |
0,58 |
0,60 |
Примечание: M – среднее арифметическое, m - стандартное отклонение, t - доверительный интервал, * - наличие статистически значимых отличий при р≤0,05
Исследование препаратов в серии с использованием протеза С показало, что после имплантации этот материал в силу своей эластичности приобретает «гофрированный» вид. В участках между соседними складками происходит образование грануляционной ткани (рис. 3), в которой отчетливо различимы слои фибробластов и сосудистых петель. Степень дифференцировки фибробластов убывает по направлению к волокнам протеза, и в непосредственной близости от них оказываются наиболее молодые формы, имеющие классическую трапециевидную или треугольную форму тела с умеренно базофильной цитоплазмой. Их ядра крупные, изобилующие эухроматином (светлые) и имеют хорошо различимое и крупное ядрышко (рис. 4). Все вышесказанное позволяет идентифицировать эти фибробласты как клетки, интенсивно секретирующие белок. Следует отметить, что среди всех исследуемых клеточных форм в клеточном слое капсулы клетки фибробластического ряда составляют только 32,4% (табл. 1).
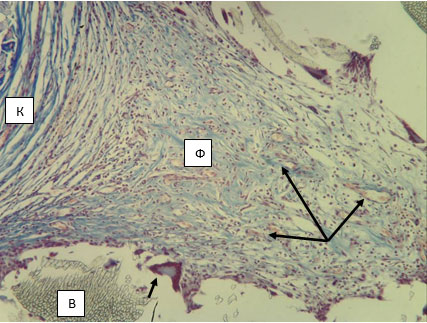
Рис. 3. Капсула вокруг протеза из материала С. 14 суток после имплантации в переднюю брюшную стенку. Волокна протеза (В), волокнистый слой капсулы (К), слой фибробластов (Ф). Кровеносные сосуды в слое сосудистых петель (указаны длинными стрелками). Гигантская клетка инородного тела (ГКИТ) (указана короткой стрелкой). Окраска по Маллори. Микрофото. Ув. х100.
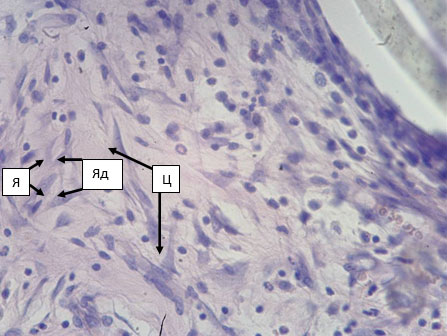
Рис. 4. Капсула вокруг протеза из материала С. 14 суток после имплантации в переднюю брюшную стенку. Фибробласты, имеющие базофильную цитоплазму (Ц), крупное, светлое ядро (Я) и крупное ядрышко (Яд). Окраска гематоксилин-эозином. Микрофото. Ув. х400.
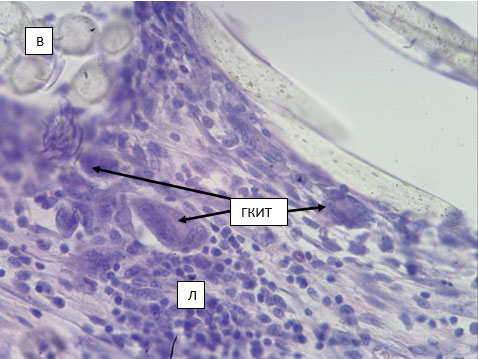
Рис. 5. Капсула вокруг протеза из материала С. 14 суток после имплантации в переднюю брюшную стенку. Волокна протеза (В), скопление лимфоцитов (Л). Гигантские клетки инородного тела (ГКИТ) (указаны стрелками). Окраска гематоксилин-эозином. Микрофото. Ув. х400.
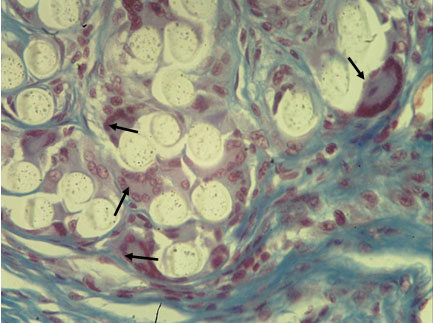
Рис. 6. Капсула вокруг протеза из материала С. 14 суток после имплантации в переднюю брюшную стенку. Ядра гистиоцитов, механоцитов и лимфоцитов вокруг волокон протеза. Коллагеновые волокна окрашены в синий цвет. Гигантские клетки инородного тела (ГКИТ) указаны стрелками. Окраска по Маллори. Микрофото. Ув. х400.
Лимфоциты и фагоцитирующие клетки (и их предшественники) представлены приблизительно в одинаковой пропорции (28.2 и 30.3 процентов соответственно) (табл. 1). В препаратах эти клетки обнаруживаются в виде лимфо-гистиоцитарных инфильтратов, не имеющих четких границ (рис. 5). Более того, в непосредственной близости от нитей протеза часто встречаются ГКИТ, имеющие от 5-6 до нескольких десятков ядер. При окраске по Маллори и фагоцитирующие клетки, и лимфоциты, и клетки фибробластического ряда обнаруживаются в пучках волокон протеза и окружают каждое волокно. Эти взаимоотношения клеток ВСТ и волокон межклеточного вещества, с одной стороны, и волокон протеза, с другой стороны, чем-то напоминают взаимоотношения клеток нейроглии и осевых цилиндров в пучках нервных волокон (периферических нервов) (рис. 6).
Таким образом, пребывание в тканях передней брюшной стенки лабораторных животных в течение 14 суток протезов, изготовленных из материала Л и С, приводит к развитию асептической воспалительной реакции в зоне стояния протезов. Смена фаз воспалительной реакции протекает быстрее в серии исследования с материалом Л, что проявляется статистически достоверным увеличением количества клеток фибробластического ряда и уменьшением лимфоцитов и фагоцитов в клеточном слое капсулы по сравнению с серией исследования с материалом С.
Рецензенты:
Ляшев Ю.Д., д.м.н., профессор кафедры патофизиологии, ГБОУ ВПО «Курский государственный медицинский университет» Минздрава России, г. Курск.
Артюшкова Е.Б., д.б.н., директор НИИ Экологической медицины ГБОУ ВПО «Курский государственный медицинский университет» Минздрава России, г. Курск.



