Введение
Эксперименты на животных показывают, что хроническое облучение гонад самцов может приводить к нестабильности генома в клетках их потомков [5; 7]. Исследования генетических эффектов, проведенные в популяциях облучённых людей, не позволяют сделать однозначных выводов о радиационно-индуцированной нестабильности генома в соматических клетках их потомства. Исследования частоты мутаций в мини-сателлитных последовательностях и аберрантных клеток крови потомков, отцы которых выжили после атомной бомбардировки Хиросимы и Нагасаки, не показали различий по сравнению с группой контроля [6]. Однако повышенная частота хромосомных аберраций в лимфоцитах крови отмечена у потомков ликвидаторов ЧАЭС [3]. При изучении хронического радиационного облучения мужчин, проживавших на территориях р. Теча, была выявлена повышенная частота мутаций в мини-сателлитных локусах ДНК их половых клеток в диапазоне индивидуальных преконцептивных гонадных доз от 0,3 до 624 мГр, однако четкой зависимости от дозы не наблюдалось [1].
Цель исследования: изучить спонтанную частоту и радиочувствительность лимфоцитов у потомков первого поколения, отцы которых подверглись хроническому радиационному воздействию.
Материалы и методы
Схема исследования
В данной работе проводилось сравнение исходной поврежденности и радиочувствительности Т-лимфоцитов периферической крови у облучённых мужчин (далее отцы) с указанными показателями у их необлучённых потомков первого поколения (далее потомки). Методом оценки поврежденности и радиочувствительности Т-лимфоцитов стал микроядерный анализ.
Отцы подверглись хроническому внешнему и внутреннему облучению вследствие проживания в период 1950 –1959 гг. на загрязненных радионуклидами территориях р. Теча. Доза внешнего облучения сформировалась за счет γ-излучающих радионуклидов (главным образом, 137Cs, 85Zr, 85Nb, 103Ru), находившихся в донных отложениях и пойменных почвах. Основными источниками внутреннего облучения в первые сроки после загрязнения реки стали 90Sr, 89Sr, 137Cs и другие изотопы, поступавшие в организм с речной водой и продуктами местного производства [2].
Для оценки повреждающего влияния ионизирующего излучения на лимфоциты периферической крови отцов использовалась доза облучения красного костного мозга (ККМ), которая в значительной степени сформировалась за счет инкорпорированного в костной ткани 90Sr. Изучение изменения частоты клеток с микроядрами в зависимости от дозы облучения ККМ является важным показателем, который может отражать степень радиационного повреждения стволовых кроветворных клеток. Для оценки вклада радиационного фактора в формирование лимфоцитов с микроядрами в группе потомков использовалась доза на гонады отца в год зачатия ребенка. Дозы были рассчитаны в биофизической лаборатории ФГБУН УНПЦ РМ на основе дозиметрической системы TRDS 2009 [8].
Группу потомков составили биологические дети облучённых на реке Теча отцов. Основными критериями включения потомков в исследуемую группу были следующие.
- Отец потомка проживал в одном из населённых пунктов, расположенных на побережье реки Теча, в период с 1950 по 1959 г.
- Биологические матери потомков облучённых отцов не проживали на загрязненных радионуклидами территориях и не подвергались воздействию ионизирующего излучения на территориях р. Теча и Восточно-Уральского радиоактивного следа.
- Обследуемый потомок облученного отца родился и проживал на незагрязненных радионуклидами территориях, а, следовательно, не подвергался хроническому радиационному воздействию.
Отсутствие аварийного облучения матерей исключает участие облучённой ядерной и цитоплазматической ДНК в формировании нестабильности генома потомков. Также этот критерий исключает возможность опосредованного влияния облучённого материнского организма на развитие зародыша и плода, а также внутриутробное и постнатальное облучение потомка за счет поступления 90Sr через плаценту и с молоком матери. Таким образом, в исследования были включены потомки облучённых отцов, не подвергавшиеся ни внутриутробному, ни постнатальному облучению, а, следовательно, это позволило изучить роль облучения гонад отцов в развитии радиационно-индуцированной нестабильности генома клеток крови их потомков.
В группу сравнения (контроль-отцы и контроль-потомки) вошли лица, проживавшие на незагрязненных радионуклидами территориях Челябинской области в близких социально-экономических условиях и имеющие одинаковый характер медицинского обслуживания.
Возрастно-половая и дозиметрические характеристики исследуемых групп приведены в таблице 1.
|
Таблица 1 – Характеристика обследуемых групп |
|||||
|
Группа |
Пол, женщины/мужчины
|
Возраст, лет, M±δ (min-max)
|
Доза на ККМ, Гр, M±δ (min-max)
|
Максимальная мощность дозы на ККМ, Гр/год, M±δ (min-max) |
Доза на гонады отца в год зачатия, Гр, M±δ (min-max) |
|
Отцы |
0/33 |
69,1±4,2 (63-76) |
1,23±0,65 (0,08- 2,6) |
0,32±0,20 (0,02- 0,6) |
0,11±0,11 (0,003- 0,5) |
|
Потомки |
28/24 |
40,4±5,0 (27-52) |
0 |
0 |
0 |
|
Контроль-отцы |
0/28 |
69,8±6,1 (61-80) |
0 |
0 |
0 |
|
Контроль-потомки |
39/11 |
38,1±7,2 (24-55) |
0 |
0 |
0 |
Микроядерный анализ
Образцы крови были взяты после получения информированного согласия доноров. Подготовительные работы и постановка культуры клеток выполнялась в стерильных условиях. Забор крови производился утром, натощак из локтевой вены в шприц с гепарином.
В культуральные флаконы добавляли 0,7 мл крови, 3,3 мл RPMI 1640 (ПанЭко, Россия), 20%-ную сыворотку крупного рогатого скота (РАА Laboratories, Австрия), 7 мкг/мл ФГА (ПанЭко). Флаконы с кровью инкубировали в CO2– инкубаторе при 37,5 °С 72 часа. Через 29 часов от начала инкубации часть проб подвергали острому γ-облучению в дозе 1 Гр (60Со, мощность дозы 0,0017 Гр/с). Через 48 часов от начала инкубации во все пробы добавляли 70 мкл рабочего раствора цитохолазина Б в DMSO (США). Цитохолазин Б блокирует цитокинез клеток, что позволило накопить более 1000 двухъядерных лимфоцитов в препаратах. Фиксация препаратов проводилась в смеси этанол : ледяная уксусная кислота в соотношении 3:1. На следующем этапе готовили препараты и окрашивали их по Романовскому-Гимза (ПанЭко) в течение 2 часов [4].
Анализ частоты лимфоцитов с микроядрами проводился в двух образцах от каждого пациента: без облучения - спонтанный уровень и с облучением в дозе 1 Гр. Оценивалось количество двухъядерных лимфоцитов с микроядрами на 1000 двухъядерных лимфоцитов. Итого в пробах от каждого пациента анализировалось 2000 клеток.
Методы статистической обработки
Для описания частоты лимфоцитов с микроядрами использовались среднее арифметическое и стандартное отклонение. Для сравнения частоты лимфоцитов с микроядрами между исследуемыми группами использовался t-критерий Стьюдента.
Связь между дозовыми показателями и частотой лимфоцитов с микроядрами определяли с помощью ранговой корреляции по Пирсону. Статистический анализ проводили в программных пакетах SPSS Statistic 17.0, Excel 2010.
Результаты и обсуждение
В таблице 2 показано, что в группе облучённых отцов средний спонтанный уровень частоты лимфоцитов с микроядрами составил 14,2‰ и в группе потомков – 12,1‰. Сопоставимый уровень клеток с микроядрами был установлен и в контрольных группах: в группе отцов - 13,6‰ и в группе потомков - 12,0‰. Статистически значимых различий в спонтанной частоте лимфоцитов с микроядрами между исследуемыми группами отцов и их потомков, а также между исследуемыми группами и соответствующим контролем не отмечено (р≥0,05).
После дополнительного облучения in vitro в дозе 1 Гр произошло 9–13-кратное увеличение частоты клеток с микроядрами во всех четырёх изучаемых группах по сравнению со спонтанным уровнем. При этом наиболее выраженное увеличение отмечено в контрольных группах отцов и потомков. При сравнении показателей, полученных для родительского поколения, было установлено, что частота лимфоцитов с микроядрами после облучения in vitro в дозе 1 Гр составила 122,1‰ в группе отцов и 138,7‰ – в группе необлучённых отцов (р=0,1). Между группами потомков отмечены более выраженные различия: 130,0‰ – в группе потомков облучённых отцов и в контрольной группе - 158,5‰ (р=0,002).
|
Таблица 2 – Частота лимфоцитов с микроядрами в группах обследуемых лиц |
||
|
Группа |
Частота лимфоцитов с микроядрами, ‰ M±δ (min-max) |
|
|
спонтанная |
после in vitro облучения в дозе 1 Гр |
|
|
Отцы |
14,2±8,2 (2-38) |
122,1±39,4 (58-216) |
|
Контроль-отцы |
13,6±5,7 (3-23) |
138,7±39,0 (49-214) |
|
Потомки |
12,1±7,0 (2-37) |
130,0 ±41,1 (40-250), р=0,002 |
|
Контроль-потомки |
12,0±6,0 (2-28) |
158,5±34,5 (72-254) |
|
Примечание: р – статистически значимые различия по сравнению с группой контроль-потомки, t-критерий Стьюдента. |
||
Корреляционный анализ зависимости спонтанной частоты клеток с микроядрами и частоты клеток с микроядрами после дополнительного облучения in vitro в дозе 1 Гр (рис. 1) показал наличие достоверной корреляционной связи для групп облучённых отцов (k=0,5; р=0,01) и потомков облучённых отцов (k=0,3, р=0,047). В группе контрольных отцов (k=0,3; р=0,08) и контрольных потомков (k=0,3; р=0,06) корреляционная связь была на уровне тенденции.
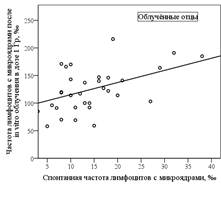
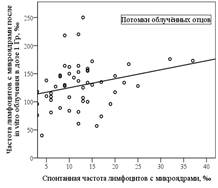
Рисунок 1. Корреляционная связь частоты лимфоцитов с микроядрами после in vitro облучения в дозе 1 Гр и спонтанной частоты лимфоцитов с микроядрами (группа облучённых отцов и их потомков)
В таблице 3 показано, что не отмечено зависимости спонтанной и индуцированной частоты лимфоцитов с микроядрами от дозы и мощности дозы на ККМ облучённых отцов.
|
Таблица 3 – Корреляционная связь частоты лимфоцитов с микроядрами от дозы и мощности дозы на ККМ в группе отцов |
||
|
Частота микроядер, ‰ |
Доза на ККМ, Гр |
Мощность дозы на ККМ, Гр/год |
|
Спонтанная |
k=0,08 p =0,7 |
k=0,2 p =0,3 |
|
После in vitro облучения в дозе 1 Гр |
k= -0,01 p =0,9 |
k= -0,01 p =0,9 |
Из рисунка 2 можно видеть, что частота лимфоцитов с микроядрами (спонтанная и после in vitro облучения в дозе 1 Гр) в группе потомков не зависела от дозы облучения гонад отцов в год зачатия ребёнка.
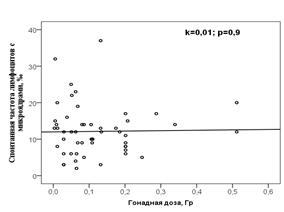
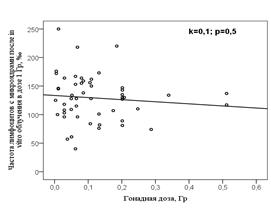
Рисунок 2 – Зависимость частоты лимфоцитов с микроядрами у потомков от преконцептивной гонадной дозы отца
Заключение
Спонтанная частота лимфоцитов периферической крови с микроядрами в группе потомков первого поколения облучённых отцов не отличается от данного показателя в группе их облучённых отцов и в группе потомков необлучённых отцов аналогичного возраста. Было обнаружено статистически значимое снижение уровня лимфоцитов с микроядрами после in vitro обучения в дозе 1 Гр в группе потомков относительно контрольной группы потомков (р=0,002), но при этом частота лимфоцитов с микроядрами не зависела от гонадной дозы отцов в год зачатия потомков. Частота клеток с микроядрами в группе облучённых отцов не зависела от дозы и мощности дозы облучения красного костного мозга.
Рецензенты:
Левина С.Г., д.б.н., профессор, декан естественно-технологического факультета ФГБОУ ВПО «Челябинский государственный педагогический университет», г. Челябинск.
Тахауов Р.М., д.м.н., профессор, директор Северского биофизического научного центра ФМБА России, профессор кафедры общественного здоровья и организации здравоохранения Сибирского государственного медицинского университета Минздрава России, г. Северск.



