Введение
В систему регуляции метаболических процессов опорных тканей входят как регуляторы, вырабатываемые центральной нервной системой и оказывающие действие на все уровни организма, так и местные регуляторы – факторы, оказывающие действие только на конкретные клетки. В настоящее время применение выделенных из костной ткани пептидов – регуляторов процессов остеогенеза является перспективным направлением в травматологии и ортопедии [1; 2; 4; 5]. Так, свое применение нашли следующие полученные из костной ткани стимуляторы остеогенеза: инсулинподобные факторы роста, трансформирующие факторы роста и костные морфогенетические белки. Однако и по сей день оценки регуляторных влияний местных рострегулирующих факторов на костную ткань противоречивы [6; 7].
Исходя из всего вышесказанного, следует признать, что состав и роль в метаболических процессах неколлагеновых белков костной ткани разных видов животных мало изучены. В связи с этим нами была предпринята попытка исследовать и сравнить состав водорастворимых неколлагеновых белков костной ткани млекопитающих животных.
Цель исследования
Провести сравнительное хроматографическое исследование особенностей состава неколлагеновых белков костной ткани млекопитающих животных.
Материалы и методы
Препараты белков были получены из бедренной кости быка, свиньи и собаки, путем деминерализации костной ткани раствором соляной кислоты с последующим фракционированием смеси пептидов с помощью диализной установки. Полученные препараты костных белков исследовали с помощью анионообменной и гельпроникающей хроматографии, чтобы установить состав и молекулярную массу основных фракций смеси.
Хроматографическая система была представлена насосом высокого давления серии LC-20 AP, блоком автоинжектора SIL-10 AP, блоком ультрафиолетового детектора SPD-20 A и коллектора фракций FRC-10 A, колонки Shodex Protein KW-2002.5 для гельпроникающей хроматографии и Shodex IEC QA-2825 для анионообменной хроматографии. В качестве элюентов для гельпроникающей хроматографии использовали буферный раствор Трис-HCl концентрацией 50 ммоль/л и рН = 7,5. Для ионообменной хроматографии был использован фосфатный буфер концентрацией 20 ммоль/л. Буфер для анионообменной хроматографии имел рН = 7,5. Линейный градиент концентрации элюирующего раствора создавали использованием 0,00 – 1 М хлористого натрия в 20 мМ фосфатном буфере.
В качестве калибровочных растворов для гельпроникающей хроматографии использовали набор маркеров молекулярной массы Sigma-Aldrich MWGF 200-1 KT. Элюенты и пробы были предварительно профильтрованы через мембранный фильтр с диаметром пор 45 мкм. Масса белка, наносимого на колонку, составляла 10 мг [3].
Результаты исследования и их обсуждение
Из 100 г костной ткани животных было получено 0,981, 0,722 и 0, 316 г неколлагеновых белков быка, свиньи и собаки соответственно. Используя гельпроникающую хроматографию, было установлено количество пептидов в лиофилизированных препаратах и их молекулярная масса. Хроматографические профили препаратов представлены на рис. 1, время выхода пиков и молекулярная масса белковых фракций представлены в табл. 1.
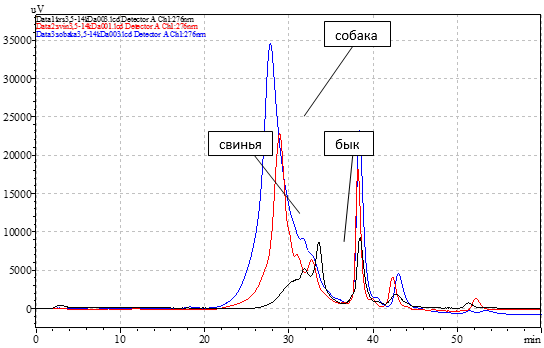
Рис. 1. Хроматографические профили неколлагеновых белков костной ткани быка, свиньи и собаки, полученные с использованием гельпроникающей хроматографии на колонке Shodex Protein KW-2002.5, скорость потока 2,5 мл/мин, светофильтр 276 нм.
|
Таблица 1 Время выхода пиков и рассчитанная молекулярная масса фракций неколлагеновых белков костной ткани быка, свиньи и собаки, полученные с использованием гельпроникающей хроматографии на колонке Shodex Protein KW-2002.5 |
|||||
|
Бык |
Свинья |
Собака |
|||
|
Время выхода, мин |
Молекулярная масса, kDa |
Время выхода, мин |
Молекулярная масса, kDa |
Время выхода, мин |
Молекулярная масса, kDa |
|
31,877 |
2,13 ± 0,07 |
28.908 |
4,68 ± 0,11 |
27.801 |
6,41 ± 0,09 |
|
33.556 |
1,30 ± 0,05 |
32.694 |
1,6 ± 0,09 |
38.387 |
0,32 ± 0,12 |
|
38.441 |
0,31 ± 0,10 |
38.202 |
0,33 ± 0,10 |
42.991 |
0,09 ± 0,04 |
|
42.754 |
0,09 ± 0,06 |
42.303 |
0,11 ± 0,08 |
|
|
|
51.287 |
0,01 ± 0,06 |
52.243 |
> 0,01 |
|
|
Масса белковых препаратов, наносимых на колонку, была одинаковой – 10 мг. Площадь двух основных пиков препарата костных белков собаки с временем выхода 27,80 и 38,39 мин составляет 6,6 и 1,2 V соответственно, что в 2,3 и 1,6 раза больше, чем площадь пиков с аналогичным временем выхода костных белков свиньи, и более чем в 2,5 раза больше площади пиков препарата белков быка. Это говорит о большем количественном содержании белка в препарате костной ткани собаки по сравнению с препаратами других экспериментальных животных. Хроматографические профили белков костной ткани свиньи и собаки имеют одинаковый пик в интервале времени выхода 27,8–29 мин и молекулярной массы в области 4,6–6,5 kDa, что свидетельствует о наличии общего пептида в этих препаратах. Хроматограмма препарата неколлагеновых белков костной ткани собаки содержит на 2 пика меньше, чем хроматограммы препаратов быка и свиньи. Так, пики, имеющие время выхода 38,3 и 42,7 мин, принадлежат пептидам, имеющим молекулярную массу 334 и 69 Da и присутствующим во всех трех препаратах.
С помощью анионообменной хроматографии нами были получены хроматографические профили неколлагеновых белков костной ткани животных – быка, свиньи и собаки, представленные на рис. 2, время выхода пиков и концентрация соли в элюирующем растворе представлены в табл. 2.
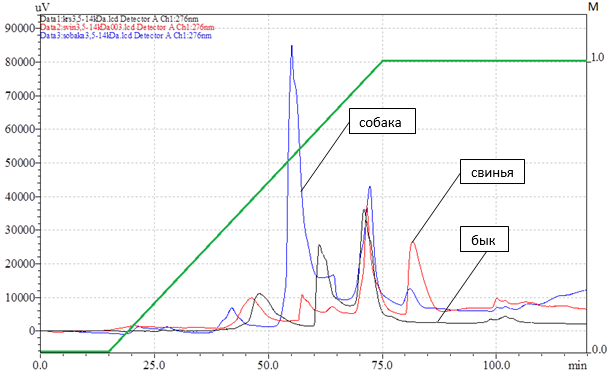
Рис. 2. Хроматографические профили неколлагеновых белков костной ткани быка, свиньи и собаки, полученные с использованием анионообменной хроматографии на колонке Shodex IEC QA-2825, скорость потока 6 мл/мин, светофильтр 276 нм.
|
Таблица 2 Время выхода пиков хроматографического профиля неколлагеновых белков костной ткани быка, свиньи и собаки, полученные с использованием анионообменной хроматографии на колонке Shodex IEC QA-2825 и концентрация соли в элюирующем растворе. |
|||||
|
Бык |
Свинья |
Собака |
|||
|
Время выхода, мин |
Концентрация соли элюирующего раствора, моль/л |
Время выхода, мин |
Концентрация соли элюирующего раствора, моль/л |
Время выхода, мин |
Концентрация соли элюирующего раствора, моль/л |
|
42,154 |
0,56 |
46,371 |
0,62 |
42,010 |
0,56 |
|
50,123 |
0,66 |
57,446 |
0,76 |
55,150 |
0,73 |
|
71,546 |
0,95 |
71,605 |
0,95 |
72,272 |
0,96 |
|
81,588 |
1,00 |
81,035 |
1,00 |
||
Все хроматографические профили содержат пики с одинаковой формой и временем выхода. Хроматограммы неколлагеновых белков костной ткани быка и собаки имеют одинаковый пик с временем выхода в интервале 42,0–42,2 мин. На всех хроматограммах можно увидеть пик, имеющий время выхода в интервале 71,5–72,3 мин. Это говорит о наличии во всех препаратах одного и того же белкового компонента. На хроматографических профилях неколлагеновых белков костной ткани свиньи и собаки на 1 пик больше, чем на профиле быка, и этот пик имеет время выхода 81,0–81,6 мин, что говорит о наличии одинакового белкового компонента в их препаратах.
Используя коллектор фракций, были выделены из препарата белков костной ткани быка с молекулярной массой 3,5–14 kDa три фракции: фракция 1 – время выхода 41–47 мин, фракция 2 – время выхода 52–59 мин, фракция 3 – время выхода 71–73 мин. С помощью гельпроникающей хроматографии были установлены молекулярные массы основных компонентов полученных фракций. Хроматографические профили полученных фракций представлены на рис. 3.
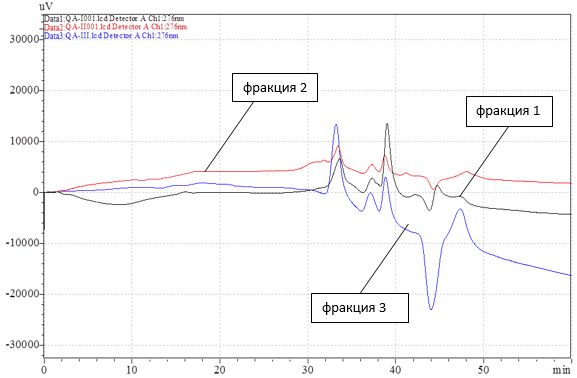
Рис. 3. Хроматографические профили фракций неколлагеновых белков костной ткани быка, свиньи и собаки, полученные с использованием гельпроникающей хроматографии на колонке Shodex Protein KW-2002.5, скорость потока 2,5 мл/мин, светофильтр 276 нм.
Состав всех трех фракций одинаков, имеются 4 ярко выраженных пика, два основных с временем выхода в области 33,2 и 39,6 мин обладают наибольшей интенсивностью и молекулярной массой 1,38 kDa и 224 Da.
Заключение
Все хроматографические профили препаратов неколлагеновых белков костной ткани быка, свиньи и собаки содержат пики с одинаковой формой и близкими значениями времени выхода. Исходя из этого, можно сделать вывод об одинаковом составе белковых препаратов и отсутствии характерных видоспецифических отличий в составе неколлагеновых белков костной ткани экспериментальных животных. Концентрация белковых компонентов в препарате костной ткани собаки в среднем в 2 раза больше, чем концентрация аналогичных компонентов в препаратах других экспериментальных животных.
Исследование полученных фракций неколлагеновых белков костной ткани быка с помощью ГПХ показало идентичность состава всех трех фракций. Это говорит о том, что все три фракции содержат белки с близкими значениями молекулярной массы, но имеющие разные изоэлектрические точки.
Рецензенты:
Стогов М.В., д.б.н., ведущий научный сотрудник лаборатории биохимии, ФГБУ «РНЦ "ВТО" имени академика Г.А. Илизарова» Минздрава России, г. Курган.
Матвеева Е.Л., д.б.н., ведущий научный сотрудник лаборатории биохимии, ФГБУ «РНЦ "ВТО" имени академика Г.А. Илизарова» Минздрава России, г. Курган.



