Введение
Интерес к исследованию альбумина, неугасающий последние 40 лет, связан с открытием всё новых его функций в организме. Уникальное строение альбумина позволяет ему связывать различные по своей химической природе вещества и переносить их в крови. Альбумин участвует в антиокислительных процессах, в поддержании онкотического давления плазмы, в направленной передаче нейтрофилов в очаги воспаления и т. д. [4]. Значение альбумина, как и других белков, в поддержании гомеостаза огромно. Однако известно, что при связывании белковых молекул с различными лигандами, их конформация определённым образом изменяется. Альбумин может образовывать димеры, состоящие из двух молекул, связанных дисульфидным мостиком через цистеиновые аминокислотные остатки, а также олигомеры. Примеси димеров и других олигомеров в препарате альбумина в количественном отношении могут варьировать от 5 – 10% и более [4].
Цель исследования - изучение молекулярных параметров и коллигативных свойств водных растворов альбумина.
Материалы и методы исследования
В качестве объекта исследования использовали раствор альбумина для инфузий с концентрацией 10%, производимый на Челябинской станции переливания крови.
Определение молекулярных параметров альбумина проводили методом высокоэффективной жидкостной хроматографии (ВЭЖХ) в изократическом режиме. В качестве подвижной фазы использовали ацетонитрил с добавлением раствора трихлоруксусной кислоты. Длина волны детектирования – 280 нм, поскольку в этой области поглощают большинство аминокислот, входящих в состав альбумина, скорость подачи элюента – от 50 до 150 мкл/мин. Испытание проводили в сравнении со стандартным образцом предприятия альбумина.
Электрофоретическую однородность препарата оценивали методом электрофореза на пленке из ацетатцеллюлозы на приборе УЭФ-01-АСТРА; в качестве красителя использовали пунцовый С, в качестве отмывающего раствора – кислоту уксусную. Просветляющим раствором служило вазелиновое масло и смесь ледяной уксусной кислоты и ацетона в соотношении 1:1. Считывание результатов электрофореза и их обработка производилось с помощью специальной программы, которая совместно с персональным компьютером и планшетным сканером выполняет функции денситометра. Определение фракционного состава проводили методом иммуноэлектрофореза в агаровом геле. В качестве реактивов использовали агар «Дифко» фирмы «Defco Laboratories», буферный раствор для электрофореза белков, антисыворотки для иммуноэлектрофореза к белкам плазмы крови человека, разрешенные к применению Министерством РФ, краситель бромфеноловый синий водорастворимый.
Определение температуры замерзания проводили на автоматическом криоскопическом осмометре ОМТ–5–02 [2, 3]. Предварительно прибор калибровали с помощью серии растворов рабочих стандартных образцов натрия хлорида. Испытуемый раствор альбумина объемом 0,2 мл помещали в кювету прибора, погруженную в термостат с контролируемой температурой, и замораживали. По зафиксированной температуре замерзания автоматически определяется осмолярность раствора.
Результаты и их обсуждение
По результатам электрофоретических исследований трех серий препаратов раствора альбумина, на электрофореграмме выявлена только одна интенсивная дуга преципитации. Содержание раствора альбумина 10%-ного в препарате составило 99,61 ± 0,03%. Сравнение результатов электрофореграмм белков сыворотки крови, полученных с использованием мембран из ацетата целлюлозы и агарового геля, не выявило существенных различий. Использование мембран из ацетатцеллюлозы позволяет при относительно низкой их стоимости и доступности за короткое время получить четкое фракционирование и возможность количественной оценки белковых фракций. Параллельно в аналогичных условиях проводили испытание со стандартом, полученным из плазмы здоровых людей, путем фракционирования по модифицированному методу Кона [6]. Полученные результаты свидетельствовали об электрофоретической однородности стандарта и испытуемого раствора белка.
Основным показателем качества альбумина является сохранение нативности молекул в процессе получения и хранения препарата. Поэтому препарат с высоким содержанием мономерного альбумина имеет более высокую лечебную эффективность, осмотическую активность, длительный период циркуляции в организме и отличается отсутствием аллергических реакций. Для выявления структуры и полиморфизма биологических макромолекул, наблюдения за их конформационными превращениями под воздействием различных физико-химических факторов в молекулярной биологии и биофизике широкое распространение получили многочисленные разновидности хроматографических и электрофоретических методов. Одной из основных характеристик физико-химического состояния белков является величина их молекулярной массы. Особенно важное значение имеет данный параметр для олигомерных белков, состоящих из двух и более полипептидных цепей (субъединиц), которые склонны при изменении ближайшего микроокружения или под действием физико-химических факторов либо образовывать более крупные агрегаты, либо распадаться на исходные субъединицы. Изменение молекулярной массы сложных белков влечет за собой изменение конформации белковой глобулы в целом и, как следствие этого, изменение функциональной активности белка.
При определении и анализе молекулярных параметров альбумина методом ВЭЖХ в изократическом режиме было установлено, что при содержании кислоты трихлоруксусной в подвижной фазе 0,1% на хроматограмме наблюдается появление дополнительных пиков, соответствующих полимерам и агрегатам. Увеличение концентрации трихлоруксусной кислоты до 0,5% не влияет на степень разрешения, но при этом оказывает разрушающее воздействие на хроматографическую колонку. Однако, снижение концентрации менее 0,1% нежелательно, так как из-за низкого содержания примесных белков (димеров, олигомеров и т.д.) возможно непроявление их пиков. Было также установлено, что оптимальная скорость подачи элюента составляет 100 мкл/мин. В этих условиях время удерживания основного пика альбумина находится в пределах 4,5 мин. Анализ всех серий раствора альбумина, проведенный за 12 месяцев, показал, что суммарное содержание полимеров и агрегатов находилось в пределах 0,22 – 1,51%, что соответствовало требованиям ФСП [1].
Молекулы альбумина, а также ассоциаты молекул, присутствующие в водных растворах, могут образовывать глобулы [5]. Для проверки данной гипотезы оценивали осмолярность раствора как характеристику, выражающую осмотическое давление через суммарную концентрацию кинетически активных частиц в единице объема раствора.
Определение эффективной осмотической концентрации и понижения температуры замерзания раствора при помощи автоматического осмометра является достаточно экспрессным методом, требующим очень малого количества испытуемого раствора, и характеризующимся высокой воспроизводимостью результатов. Согласно проведенным исследованиям 10%-ный раствор альбумина для инфузий изотоничен крови: его осмолярность составляет ![]() мОсм/кг при понижении температуры замерзания раствора относительно воды на
мОсм/кг при понижении температуры замерзания раствора относительно воды на ![]() оС.
оС.
Для установления правильности и линейности рекомендуемой методики готовили серию разведений стандартного раствора альбумина для инфузий в концентрациях 1 – 10% и 0,1 – 1%, и проводили определение температуры замерзания и осмолярности. Было установлено, что температура замерзания в обоих интервалах концентраций линейно зависит от концентрации. Уравнение линейной регрессии имеет вид: ![]() (рис. 1). Критерием приемлемости методики является коэффициент корреляции, величина которого должна быть не ниже 0,99. Для экспериментальных данных R = 0,997, что соответствует критерию приемлемости. Поскольку линейная зависимость температуры замерзания от концентрации отвечает критерию приемлемости, то методика определения концентрации альбумина в водных растворах по калибровочному графику
(рис. 1). Критерием приемлемости методики является коэффициент корреляции, величина которого должна быть не ниже 0,99. Для экспериментальных данных R = 0,997, что соответствует критерию приемлемости. Поскольку линейная зависимость температуры замерзания от концентрации отвечает критерию приемлемости, то методика определения концентрации альбумина в водных растворах по калибровочному графику ![]() при концентрации белка до 10% от может быть использована для количественного определения альбумина и контроля качества препарата.
при концентрации белка до 10% от может быть использована для количественного определения альбумина и контроля качества препарата.
Известно [5], что осмотическое давление в реальных растворах высокомолекулярных соединений описывается уравнением Галлера ![]() , где С - массовая концентрация раствора; R – универсальная газовая постоянная; Т – температура в стандартных условиях; b - константа, учитывающая гибкость и форму макромолекул. При низких концентрациях, когда
, где С - массовая концентрация раствора; R – универсальная газовая постоянная; Т – температура в стандартных условиях; b - константа, учитывающая гибкость и форму макромолекул. При низких концентрациях, когда ![]() , и в случае глобулярной структуры макромолекул вещества в растворе (b = 0) уравнение Галлера переходит в уравнение Вант-Гоффа
, и в случае глобулярной структуры макромолекул вещества в растворе (b = 0) уравнение Галлера переходит в уравнение Вант-Гоффа ![]() .
.
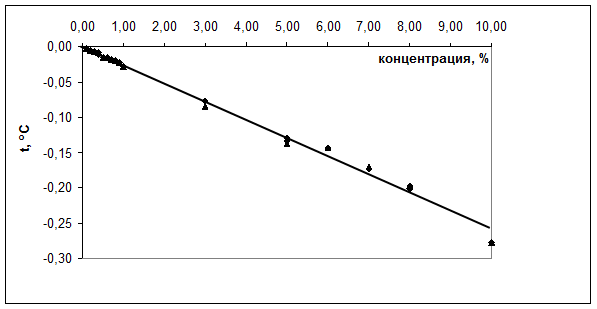
Рис. 1.
Зависимость понижения температуры замерзания раствора от концентрации альбумина
Для определения формы нахождения макромолекул альбумина в водных растворах была изучена закономерность изменения величины ![]() от массовой концентрации белка (рис. 2).
от массовой концентрации белка (рис. 2).
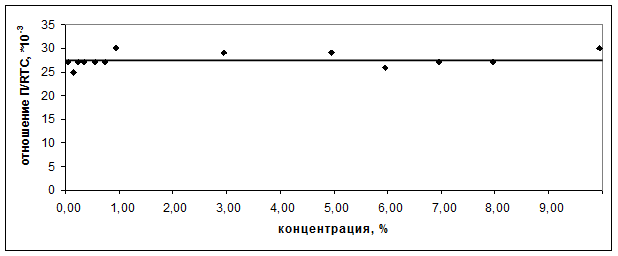 Рис. 2.
Рис. 2.
Зависимость величины ![]() от массовой концентрации альбумина
от массовой концентрации альбумина
Поскольку график ![]() представляет собой прямую линию, проходящую параллельно оси концентраций, величина
представляет собой прямую линию, проходящую параллельно оси концентраций, величина ![]() не зависит от С. По результатам метрологической обработки было установлено, что угловой коэффициент прямой незначимо отличается от нуля. Это однозначно свидетельствует о том, что молекулы альбумина в водном растворе находятся в виде глобул.
не зависит от С. По результатам метрологической обработки было установлено, что угловой коэффициент прямой незначимо отличается от нуля. Это однозначно свидетельствует о том, что молекулы альбумина в водном растворе находятся в виде глобул.
Выводы
Показана возможность идентификации, количественного определения и оценки степени чистоты раствора альбумина в процессе производства, а также возможность установления содержания олигомеров с помощью сочетания различных вариантов хроматографии (ВЭЖХ, капиллярный электрофорез).
Обосновано использование коллигативных свойств растворов альбумина (метод осмометрии) для оценки степени чистоты и количественного определения содержания белка.
Рецензенты:
Цейликман В.Э., д.б.н., профессор, заведующий кафедрой биохимии, ГБОУ ВПО Южно-Уральский государственный медицинский университет, г.Челябинск.
Лиходед В.А., д.фарм.н., профессор, заведующий кафедрой фармации ЮУГМУ, ГБОУ ВПО Южно-Уральский государственный медицинский университет, г.Челябинск.



