Введение
Количество публикаций, в которых представлены экспериментально или теоретически установленные корреляции между характеристиками иммунохимического взаимодействия (KD, ka, kd) и параметрами иммуноанализа, крайне ограничено. В 1970 г. Rodbard и Lewald [9] предложили первый алгоритм для описания радиоиммуноанализа и построения линейных градуировочных зависимостей с целью предсказания пределов обнаружения. Первая теоретическая модель, основанная на законе действующих масс, была предложена для радиоиммуноанализа только в 1991 г. [3]. В дальнейшем корреляцию между характеристиками иммунохимического взаимодействия и иммуноанализа характеризовали для радиоиммуноанализа [8], иммунного капиллярного электрофореза [10], иммуноферментного анализа (ИФА) [2], иммунохроматографического анализа (ИХА) [1].
Известно, что в ИФА требуется значительное количество дополнительных экспериментов, чтобы оптимизировать время анализа и концентрации антител. Использование современных схем оптимизации, например, «Doehlert matrix» [5] или «Box-Behnken design» [4], снижает трудоемкость этих исследований, однако не предоставляет возможности априорной оценки предела обнаружения.
Choi и соавт. [2] для предсказания параметров конкурентного ИФА (предела обнаружения и рабочего диапазона) комбинировали кинетические и математические модели, предложенные в работе [7], в которой для построения теоретической градуировочной кривой использовали данные об изменениях концентраций комплексов антиген - антитело и антитело - меченый антиген, определяемых с помощью дифференциального уравнения по методу Runge-Kutta. Данная модель, предложенная Hayashi и соавт. [7], позволяет, исходя из кинетических характеристик антител, наблюдаемых в анализе, установить оптимальные условия проведения конкурентного ИФА. Выбор антител для конкурентного ИФА, обеспечивающих низкий порог обнаружения и широкий рабочий диапазон, в большинстве случаев основывают на аффинности. Однако антитела с высокой аффинностью не всегда оптимальны. КА характеризует связывание в равновесном режиме, но реакция антиген-антитело в ходе анализа не всегда достигает равновесия. Поэтому ka становится более важной характеристикой, чем КА, при использовании реакций антиген-антитело в аналитических схемах, ограниченных по времени.
Таким образом, представляется крайне актуальным рост числа сведений о корреляциях между параметрами иммуноаналитических систем и характеристиками реакций, происходящих во время иммуноанализа. На сегодняшний день информация о подобном сравнительном анализе отсутствует как в библиографических базах данных, так и в обзорных публикациях по иммуноаналитическим методам, в том числе вышедших в последние годы. Уточнение физико-химических характеристик взаимодействия вирус-антитело в значительной степени зависит от корректного определения количества эпитопов на поверхности вирусных частиц, способных связываться с антителами. В распоряжении исследователя имеется широкий диапазон методов определения равновесных и кинетических характеристик реакции антиген–антитело. Выбор методического подхода диктуется особенностями изучаемой системы и доступностью инструментария.
Целью исследования являлось определение количественных характеристик взаимодействия вирус-антитело с применением методов иммуноферментного анализа и поверхностного плазмонного резонанса, установление зависимостей между характеристиками иммунохимических взаимодействий и показателей иммуноанатитических систем. В работе изучено взаимодействие поли- и моноклональных антител специфичных к вирусами растений: вирусу крапчатости гвоздики (ВКГ) (carnation mottle virus), Х-вирусу картофеля (ХВК) (potato virus X), вирусу табачной мозаики (ВТМ) (tobacco mosaic virus) и вирусу шарки сливы (ВШС) (plum pox virus).
Материалы и методы
1. Реагенты и оборудование
В работе использовали вирусы растений: ВКГ, ВТМ, ХВК и ВШС, предоставленные кафедрой вирусологии МГУ им. М.В. Ломоносова. Поликлональные антитела (ПАт), специфичные к ВКГ, ВТМ, ХВК, ВШС, получены на кафедре вирусологии МГУ им. М.В. Ломоносова, пять моноклональных антител (МАт) (1А5, 3G4 – против ХВК, 1D5B1, 2H2F6, 2F12E8 – против ВШС) – получены в результате совместной работы с ЦНИИ туберкулеза РАМН.
В работе применяли овечьи («Имтек», Россия) и козьи («Имтек», Россия и «Arista Biologicals», США) антитела против IgG кролика, козьи («Arista Biologicals», США) антитела против IgG мыши, пероксидазные конъюгаты антикроличьих и антимышиных антител («Медгамал», Россия), трис, Тритон Х-100, 3,3',5,5'-тетраметилбензидин (ТМБ), азид натрия, HEPES, 3 («Sigma», США), Твин-20, бычий сывороточный альбумин (БСА), цитрат натрия, сурфактант P20, N-гидроксисукцинимид (NHC), 1-этил-3-(3-диметиламинопропил) карбодиимида гидрохлорид (EDC), этаноламин («Biacore AB», Швеция), NaCl, K2CO3 («ДиаэМ», Россия), Na2CO3, NaHCO3, (NH4)2SO4, KH2PO4, KOH («Химмед», Россия). Все соли были аналитической или химической чистоты.
Для проведения ИФА использовали 96-луночные прозрачные полистироловые микропланшеты Costar 9018 («Corning Costar», США). Оптическую плотность продукта реакции определяли с помощью многофункционального микропланшетного детектора ZENYTH 3100 (Anthos Labtec Instrumens, Австрия) при длине волны 450 нм. УФ-спектры регистрировали на спектрофотометре UV-1202 («Shimadzu», Япония).
2. Твердофазный ИФА вирусов растений («сэндвич»-формат)
В лунках микропланшета проводили сорбцию МАт (или ПАт) в течение ночи при 4ºС из 100 мкл раствора в ФБС с концентрацией 1-3 мкг/мл. Микропланшет четырехкратно промывали ФБС-Т, после чего в лунки вносили по 10 мкл растворов вируса (ВШС или ХВК) в ФБС-Т (диапазон концентраций от 10 мкг/мл до 1 нг/мл), инкубировали 1 ч при 37ºС (первая стадия), далее – ПАт (или МАт соответственно) (5 мкг/мл), также инкубируя 1 ч при 37ºС. Затем микропланшет повторно промывали, добавляли по 100 мкл антивидовых антител, конъюгированного с пероксидазой (разведение 1 : 6000 в ФБС-Т), и инкубировали 1 ч при 37ºС. Далее планшет четырехкратно отмывали ФБС-Т и определяли пероксидазную активность связавшейся метки (см. п. 2.4).
Зависимость предела обнаружения в «сэндвич»-формате ИФА от равновесной константы взаимодействия получали, исходя из равновесных уравнений, отражающих взаимодействие вирус–антитело:
первая стадия
![]() ,
,
![]() ,
,
[Ab-Ag]1 – равновесная концентрация комплекса иммобилизованное антитело-вирус;
[Ag] – равновесная концентрация вируса;
[Ab]im – концентрация иммобилизованного антитела;
[ПО] – концентрация добавляемого вируса, равная пределу обнаружения;
вторая стадия
![]() ,
,
![]() ,
,
[Ab-Ag]2 – равновесная концентрация комплекса иммобилизованное антитело-вирус-антитело с пероксидазой;
[Ab]2 – концентрация конъюгата антител с пероксидазой.
3. Твердофазный ИФА вирусов растений (конкурентный формат)
Сорбцию вирусов в лунках микропланшетов осуществляли в течение ночи при 4°С из растворов с концентрациями 0,5 или 1,0 мкг/мл. Иммобилизацию проводили из объема 100 мкл ФБС или 50 мМ Na-карбонатного буфера, рН 9,2. После этого микропланшет четырехкратно отмывали ФБС-Т. В лунки микропланшета вносили по 50 мкл растворов вируса (концентрацию варьировали от 10 мкг/мл до 0,1 нг/мл) и антител (в концентрациях, указанных в разделе 3.5) в ФБС-Т. Микропланшет инкубировали 1 ч при +37°С и отмывали. Затем добавляли 100 мкл пероксидазного конъюгата антивидовых антител (разведение 1:6000 в ФБС-Т) и инкубировали 1 ч при 37°С. Далее планшет четырехкратно отмывали ФБС-Т и определяли пероксидазную активность связавшейся метки (см. п. 2.4).
4. Измерение пероксидазной активности
В качестве субстрата ПХ использовали ТМБ (0,4 мМ) в 40 мМ Na-цитратном буфере, рН 4,0, с 3 мМ Н2О2. В лунки микропланшета вносили по 100 мкл субстрата, инкубировали 15 мин в темноте при комнатной температуре, останавливали реакцию добавлением 50 мкл 1 М H2SO4 и измеряли оптическую плотность продуктов ферментативной реакции при длине волны 450 нм (А450).
5. Определение количественных характеристик иммунохимического взаимодействия
Для нахождения равновесной константы ассоциации (Ка) реакции антиген-антитело в растворе использовали модификацию конкурентного ИФА, предложенную в работе В. Friguet и соавт. [6]. Вирусы сорбировали в лунках микропланшета из объема 100 мкл при +4оС в течение ночи из растворов с концентрациями 0,5 или 1,0 мкг/мл в ФБС или в 50 мМ Na-карбонатном буфере, рН 9,2. Микропланшет четырехкратно отмывали ФБС-Т. В лунки вносили по 50 мкл растворов вируса (от 10 мкг/мл до 0,1 нг/мл) и IgG в ФБС-Т. Микропланшет инкубировали 60 мин при +37оС и отмывали, как описано выше. Затем добавляли 100 мкл пероксидазного конъюгата антивидовых антител (разведение 1:6.000 в ФБС-Т) и инкубировали 60 мин при +37°С. Далее планшет четырехкратно отмывали ФБС-Т и определяли пероксидазную активность связавшейся метки (см. п. 2.4).
Полученные зависимости связывания меченых антител от логарифма концентрации определяемого вируса линеаризовали посредством программы Origin 7.5 («Origin Lab», США).
6. Измерение констант иммунохимических реакций на приборе Biacore X
На поверхности сенсорного чипа СМ5 или СМ3 («Biacore AB», Швеция) иммобилизовали антивидовые антитела (схема №1), АТ (схема №2) из концентрации 50-100 мкг/мл в 10 мМ Na-цитратном буфере, значение рН которого определяли экспериментально, выбирая максимальный отклик при введении реагента в разных растворах. Иммобилизацию реагентов на поверхности сенсорного чипа согласно стандартной процедуре. Чип активировали, используя раствор (70 мкл) EDC и NHC (1:1) при скорости потока 5 мкл/мин. Затем при той же скорости пропускали раствор иммобилизуемого реагента в выбранном буфере (70 мкл) и концентрации. Непрореагировавшие активные группы блокировали 1 М этаноламином, pH 8,5 (70 мкл) при скорости потока 5 мкл/мин. Далее в ячейку прибора Biacore X («Biacore AB», Швеция) вводили (в зависимости от схемы):(1) вирусы в концентрации от 0,05 до 100 мкг/мл (схема №1) или 5-10 мкг/мл (схема №3); (2) АТ в концентрации от 4 до 400 нМ (3) HEPES-P буфер (10 мM HEPES, pH 7,4, содержащий 150 мM NaCl и 0,005% сурфактанта P20); (4) регенерирующий реагент (10 мМ глицин-HCl, pH 2,0). Взаимодействия на стадиях (1) и (2) проводили в HEPES-P буфере («Biacore AB», Швеция). Константы рассчитывали с использованием программы «BIAevaluation» («Biacore AB», Швеция).
Результаты и обсуждение
1. Количественная характеристика реакции взаимодействия вирусов растений с антителами в иммуноферментном анализе
Количественные характеристики взаимодействия вирус-антитело являются определяющими для любого иммуноанализа. Для их определения был применен непрямой конкурентный ИФА по методике B. Friguet [6]. Методика позволяет определять равновесную константу реакции антиген – антитело в растворе. Для этого используют меченные ферментом соединения и детектируют по каталитической активности метки образование иммунных комплексов в конкурентной схеме анализа, на основании этих данных рассчитывать количественные характеристики взаимодействия. Предварительно условия анализа оптимизируют таким образом, чтобы исключить сдвиг равновесия в растворе при взаимодействии антител с иммобилизованным антигеном. В силу поливалентности вируса как антигена, обусловленной наличием повторяющихся белковых субъединиц в оболочке, KD следует рассматривать как эффективную величину, характеризующую суммарный вклад во взаимодействие отдельных антигенных детерминант (эпитопов) на поверхности вирусной частицы. Следует учитывать, что агглютинация приводит к отклонению экспериментальных равновесных кривых титрования вирусных частиц антител от теоретических зависимостей.
Предварительно были оптимизированы условия (подбор концентраций реагентов, выбор длительностей стадий), исключающие сдвиг равновесия в растворе при взаимодействии антител с иммобилизованным антигеном. Вирус в лунках микропланшетов сорбировали в следующих концентрациях: ХВК – 0,5 мкг/мл, ВТМ – 1,0 мкг/мл, ВКГ – 0,5 мкг/мл; концентрации антител, примененные в ИФА для этих вирусов, составляли 100, 350 и 100 нг/мл соответственно. Время инкубации смеси антител и вируса, достаточное для насыщения сайтов связывания и установления равновесия, во всех случаях было определено равным 60 минутам. В результате для каждой пары вирус-антитело были получены кривые конкурентного ИФА. На рис. 1 представлен пример конкурентной зависимости для ХВК.
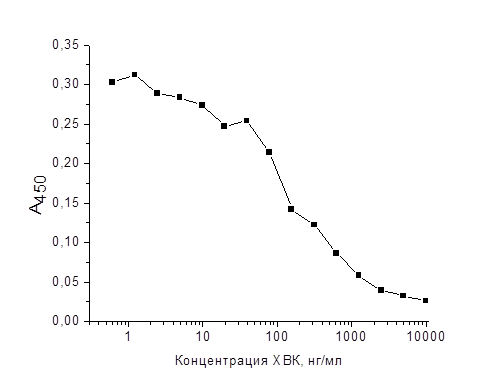
Рис. 1. Концентрационные зависимости связывания ХВК с индивидуальными препаратами поликлональных антител в ИФА по методике Friguet и соавт.
При расчете KA концентрацию вируса представляли как молярную концентрацию вирусных частиц. Из-за поливалентности вируса как антигена KA является эффективной величиной, характеризующей суммарный вклад во взаимодействие отдельных антигенных детерминант (эпитопов). В соответствии с этим KA зависит от количества эпитопов, связанных с антителами в состоянии равновесия. Для всех охарактеризованных пар антитело-вирус были получены два линейных участка кривой связывания (на рис. 2 приведен пример линеаризации для ВКГ). Рассчитанные по данным ИФА эффективные значения KD для вирусной частицы как целого антигена и ПАт составили (линеаризация на участке с избытком вирусных частиц): ВКГ – (0,3-1,0) 10-12 М; ХВК – (2,7-4,7)∙10-12 М; ВТМ – (0,2-1,7)∙10-12 М, разброс значений отражает разные способы линеаризации данных. KA, рассчитанные для второго линейного отрезка (избыток антител), были ниже в среднем на два порядка. По-видимому, высокие значения KA (при избытке вирусных частиц) характерны для бивалентного взаимодействия антител с вирусными частицами. В условиях избытка антител реализуются по преимуществу моновалентные взаимодействия, отличающиеся, как известно, меньшей прочностью. Значения KD, полученные для целой вирусной частицы, близки к KD, измеренным на Biacore X в экспериментальной схеме №1.
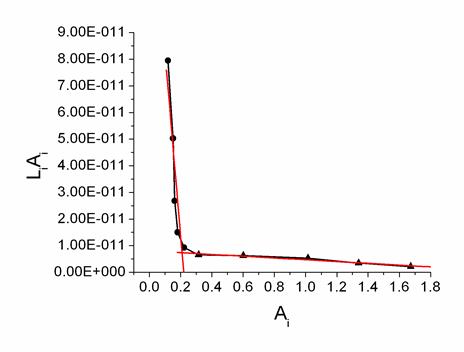
Рис. 2. Линеаризация данных эксперимента по определению методом ИФА константы связывания ВКГ с поликлональными антителами. Расчет Кд проводился по формуле LiAi = Кдх(Ao-Ai), где Li – концентрация антигена (М), Ao – оптическая плотность в отсутствие конкурирующего антигена, Ai – оптическая плотность при концентрации конкурирующего антигена, равной Li
2. Количественная характеристика взаимодействия вирусов растений с антителами методом поверхностного плазмонного резонанса на приборе Biacore X
Для прямого количественного контроля процессов формирования иммунных комплексов применяли регистрацию эффекта поверхностного плазмонного резонанса (ППР) на приборе Biacore (BIAcore X).
Изучение взаимодействия на приборе Biacore X проводили после ковалентной иммобилизации одного из реагентов; механизм иммобилизации во всех случаях основывался на образовании пептидной связи между NH2-группами вируса или антител и СООН-группами модифицированного карбоксиметилированного декстрана на поверхности чипа. Непосредственно перед этапом иммобилизации проводили процедуру преконцентрации, определяя буфер, в котором должен вводиться иммобилизуемый реагент. Иммобилизуемый реагент вводили в буферных растворах с разным значением рН. При использовании 10 мМ цитратного буфера с рН 5,0 получен максимальный сигнал, что свидетельствует об оптимальном балансе зарядов между поверхностью чипа и молекулами антител. Таким образом, обеспечивается необходимое условие для ковалентной иммобилизации – положительно заряженный реагент приближается к отрицательно заряженной поверхности карбоксиметилированного декстранового матрикса.
Для изучения взаимодействия антител с вирусами на приборе Biacore X были использованы две экспериментальные схемы. Первая схема предполагает получение равновесных констант на этапе введения вирусных частиц, после стадии связывания специфических антител с антивидовыми. На рис. 3 приведены концентрационные зависимости взаимодействия ПАт с ВТМ, ХВК и ВКГ. Получены значения равновесной константы (KD) (в расчете на моль вирусных частиц) для ВКГ и ПАт – 1,55∙10-12 М (χ2 = 3,76) и для ВТМ и ПАт – 7,31∙10-12 М (χ2 = 2,47). При этом кинетические константы ассоциации составляли 2,7∙107 (ВКГ) и 7,8∙106 (ВТМ) М-1с-1, диссоциации – 4,2∙10-5 (ВКГ) и 5,7∙10-5 (ВТМ) с-1. Однако схема №1 малоинформативная в условиях плотной посадки антивидовых антител на поверхность чипа (что необходимо для получения регистрируемого сигнала) и больших размеров вирусных частиц. Из-за поливалентного характера взаимодействия с вирусной частицей в этой системе иммобилизованные Fab-фрагменты, антитела и поливалентные структуры на основе антител будут слабо отличаться по аффинности.
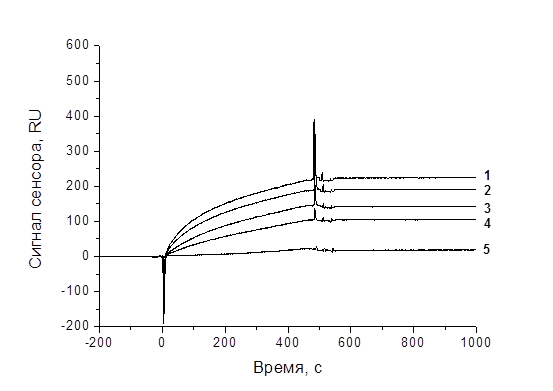 Б
Б
Рис. 3. Концентрационные зависимости взаимодействия поликлональных антител против ХВК (в растворе). Кривые 1-5 соответствуют концентрациям ХВК 60, 50, 20, 10, 1 мкг/мл. Все измерения проводились в HEPES-P буфере
Во второй схеме была реализована возможность регулировать уровень взаимодействующих вирусных частиц на поверхности чипа и использовать в каждом цикле вирусы в нативном состоянии – не подвергавшиеся воздействию агрессивных сред. К недостаткам данной схемы следует отнести длительность цикла. Преимущества второй схемы:
- отсутствие влияния эффекта прямой ковалентной иммобилизации вируса на кинетику связывания с препаратами антител;
- уменьшение диффузионных ограничений при взаимодействии антител в растворе;
- возможность контролировать количество иммобилизованного вируса.
Для МАт к ВШС (1D5B1, 2H2F6, 2F12E8) и ХВК (3G4, 1A5) были получены следующие значения Кд (при расчете на моль антител): 1,46∙10-8 M (1D5B1), 1,73∙10-8 M (2H2F6), 5,54∙10-7 M (2F12E8), 1,01∙10-9 M (3G4), 3,09∙10-8 M (1A5). Таким образом, МАт к ХВК и МАт 1D5B1 и 2H2F6 были сходными по аффинности, МАт 2F12E8 характеризовались меньшим сродством к ВШС.
3. Аналитические характеристики иммуноферментной системы на основе взаимодействия вирусов растений с антителами
Аналитические характеристики иммунореагентов (порог детекции антигенов в микропланшетном ИФА) были определены в конкурентном и «сэндвич»-варианте ИФА. Определение режима ИФА, обеспечивающего предельную чувствительность анализа, включало выбор оптимальной продолжительности стадий анализа и концентраций реагентов. В соответствии с результатами опытов по варьированию этих параметров для получения калибровочных кривых ИФА в лунках микропланшетов сорбировали ХВК, ВШС и ВКГ в концентрации 0,5 мкг/мл, ВТМ – 1,0 мкг/мл. Адсорбцию вирусных частиц проводили из разных буферных растворов: для ВТМ, ВКГ и ВШС оптимальным (максимальная амплитуда сигнала при прочих одинаковых условиях проведения анализа) оказался 150 мМ ФБС, pH 7,4; для ХВК – 50 мМ натрий-карбонатный буфер, рН 9,2. Концентрации антител, использованные для конкурентного взаимодействия с вирусом в растворе и иммобилизованным вирусом, составляли: ПАт против ВТМ – 100 нг/мл, ПАт против ХВК – 350 нг/мл, ПАт против ВШС – 200 нг/мл, ПАт против ВКГ – 100 нг/мл, 1А5 – 10 нг/мл, 3G4 – 5 нг/мл, 1D5B1 – 3 нг/мл, 2H2F6 – 5 нг/мл, 2F12E8 – 100 нг/мл. Время инкубации смеси антител и вируса, достаточное для насыщения сайтов связывания и обеспечения максимальной чувствительности и точности анализа, для всех охарактеризованных систем равнялось 60 минутам.
Для полученных калибровочных кривых конкурентного ИФА вычисляли IC50 (концентрация антигена, вызывающая 50%-ное ингибирование связывания антител) и IC10 (10%-ное ингибирование, рассматриваемое применительно к системам конкурентного ИФА как предел достоверного обнаружения антигена).
На рис. 4 приведены кривые конкурентного формата ИФА для ХВК и антител, специфичных к нему. Как видно, предел обнаружения (IC10) в конкурентном ИФА, полученный для ПАт и МАт к ХВК, отличается не более чем в три раза.
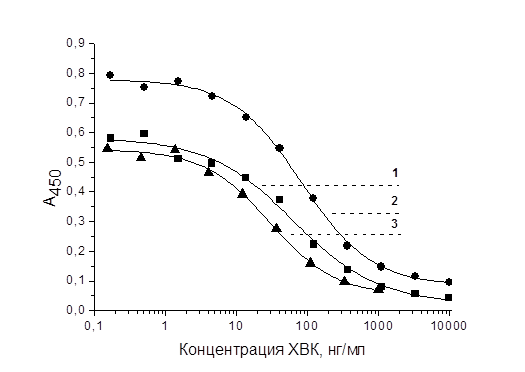
Рис. 4. Градуировочные кривые конкурентного ИФА для ХВК с поли- (1) и моноклональными антителами (1A5 – 2 и 3G4 – 3)
Для ВШС и ХВК были реализованы иммуноферментные аналитические системы в «сэндвич»-формате, при этом минимальный передел обнаружения был достигнут при использовании наиболее высокоаффинных антител (1D5B1 – для ВШС и 3G4 – для ХВК) в качестве реагентов, используемых на заключительной иммунохимической стадии. В этом случае достигался предел обнаружения ~ 3 нг/мл.
Характеристики ИФА, полученные с использованием МАт и ПАт, суммированы в таблице 1. Для шести пар вирус–антитело установлены низкие пределы обнаружения в конкурентном формате ИФА (IC10 до 10 нг/мл, IC50 до 100 нг/мл), для пар ВШС с ПАт и МАт указаны значения пределов детекции для «сэндвич»-формата (см. таблица 1).
Таблица 1.
Характеристика ИФА с использованием МАт и ПАт
|
Антитела |
IC10, нг/мл |
IC50, нг/мл |
|
Поликлональные антитела против ВТМ |
4,0 |
70 |
|
Поликлональные антитела против ХВК |
3,1 |
31 |
|
Поликлональные антитела против ВКГ |
6,0 |
56 |
|
Моноклональные антитела против ХВК-1 (1А5) |
6,9 |
83 |
|
Моноклональные антитела против ХВК-2 (3G4) |
2,8 |
30 |
|
Моноклональные антитела против ВШС-1 (1D5B1) |
6,9 |
82 |
|
Моноклональные антитела против ВШС-1 (1D5B1) |
4,0 (сэндвич) |
|
|
Моноклональные антитела против ВШС-2 (2H2F6) |
40 (сэндвич) |
|
|
Моноклональные антитела против ВШС-3 (2F12E8) |
700 (сэндвич) |
|
|
Поликлональные антитела против ВШС |
20 (сэндвич) |
|
Мы построили зависимость предела обнаружения в «сэндвич»-формате ИФА (для случая, когда антитела, использованные на обеих стадиях анализа, были одинаковыми) от равновесной константы взаимодействия МАт и ВШС (рис. 5). Если на теоретической зависимости предела обнаружения от равновесных констант расположить константы взаимодействия вирусов с антителами, полученные на приборе Biacore X по второй схеме №3, то пределы детекции для МАт 1D5B1 и 2H2F6 близки и находятся на уровне 1 нг/мл. Для МАт 2F12E8 предел детекции увеличивается на три порядка.
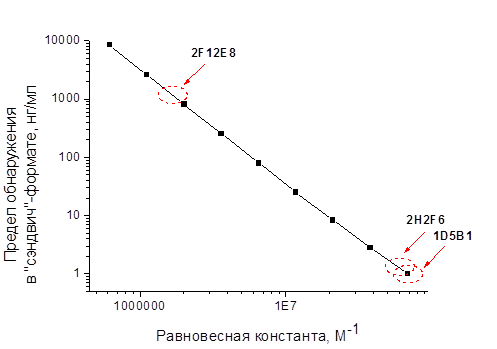
Рис. 5. Зависимость предела детекции в «сэндвич»-формате ИФА (на примере ВШС) от равновесной константы взаимодействия МАт и ВШС. Значения, лежащие внутри красного пунктира, соответствуют указанным МАт.
Выводы
Для шести пар вирус–антитело установлены низкие пределы обнаружения в конкурентном ИФА (IC10 до 10 нг/мл, IC50 до 100 нг/мл), для пары ВШС – МАт 2F12E8 отмечено наибольшее значение предела обнаружения – 700 нг/мл. Данные соответствуют теоретически рассчитанным значениям пределов обнаружения, если исходить из равновесных констант взаимодействия вирусов с антителами, полученных на приборе «Biacore X».
Работа выполнена при финансовой поддержке Российского фонда фундаментальных исследований (грант 13-04-90451_Укр_ф_а) и Межгосударственной целевой программы «Инновационные биотехнологии» (государственный контракт № 16.М04.11.0022 от 29.04.2011).
Рецензенты:
Ерёмин С.А., д.х.н., профессор кафедры химической энзимологии Химического факультета Московского Государственного Университета им. М.В. Ломоносова, г.Москва.
Ярополов А.И., д.х.н., профессор, заведующий лабораторией химической энзимологии Института биохимии им. А.Н.Баха РАН, г.Москва.



