Введение. Хлорогеновая кислота обладает широким спектром биологической активности. Доказано ее действие в качестве антибактериального, противовирусного, противовоспалительного, гепатопротекторного, антимутагенного, гипотензивного биологически активного вещества. Установлены ее пребиотические свойства [4, 5]. Хлорогеновая кислота и ее производные, оказывают более сильный антиоксидантный эффект, чем аскорбиновая кислота, кофейная кислота и токоферол (витамин Е), может эффективно удалить ДФПГ радикал, гидроксильный радикал и супероксид анион радикалы, подавлять липопротеины низкой плотности окисления [2].
В ходе фитохимичеcкого изучения методом ВЭЖХ было установлено наличие хлорогеновой кислоты в корневищах и корнях любистка лекарственного (Levísticum officinále Koch.) семейства сельдерейных (Apiaceae).
Согласно требованиям, предъявляемым к современным методам стандартизации ЛРС необходимо разрабатывать показатели норм качества в зависимости от пути его использования при производстве лекарственных средств [3]. Исходя из первичного аналитического скрининга, фенолкарбоновые кислоты являются доминирующими и на их долю приходится основной вклад ожидаемого фармакологического эффекта, поэтому и разрабатывали методики их качественного и количественного определения.
Цель работы. Разработка методики идентификации и количественного определения хлорогеновой кислоты в корнях и корневищах любистка лекарственного.
Материал и методика. Сырьём для анализа являлись высушенные корневища и корни, заготовленные от растений культивируемых в условиях Кавказских Минеральных Вод в период 2010-2011 гг. В качестве экстрагента использовали 70% спирт этиловый в соотношении 1:2. Извлечение получали методом реперколяции (повторная или многократная перколяция). Сущность метода заключалась в том, что сырье делили на части и каждую последующую его порцию экстрагировали вытяжкой, полученной из предыдущей.
Для приготовления стандартного образца (СО) 0,1 г хлорогеновой кислоты (точная навеска) помещали в мерную колбу вместимостью 100,0 мл, растворяли в этиловом спирте 95% и доводили спиртом раствор до метки. Концентрация СО хлорогеновой кислоты составила 1,0 мкг/мкл.
Для идентификации и количественного определения использовали метод ТСХ с последующей денситометрической обработкой хроматограмм. Хроматографирование проводили на пластинках марки «Sorbfil» (г. Краснодар) размером 10х15 см. В качестве подвижной фазы использовали систему n-бутанол-ледяная уксусная кислота-вода (5:4:1). Высота подъема растворителя 9 см. Детектирование проводили парами аммиака.
На линию старта хроматографической пластинки длиной 15 см наносили 0,5; 1,0; 1,5; 2,0; 2,5; 3,0 мкл раствора СО с содержанием хлорогеновой кислоты 0,5; 1,0; 1,5; 2,0; 2,5; 3,0 мкг соответственно. На этой же пластинке обозначали четыре линии контрольных треков, на которые наносили спиртовое извлечение объемом 20 мкл. Пробы наносили при помощи микрошприца МШ-10 (агат). Пластинки помещали в камеру для хроматографирования объемом 2000 см3, насыщенную парами растворителя. После подъема растворителя на необходимый уровень пластинки вынимали, высушивали в вытяжном шкафу при комнатной температуре до удаления паров растворителя. Через 10-15 минут на воздухе появляются пятна тёмно-коричневого цвета. Для усиления окраски пластинку держали над парами аммиака концентрированного.
Далее пластинки сканировали при помощи планшетного сканера «HP Scanjet 3670» (разрешение 100 dpi) и осуществляли их цифровую обработку с помощью компьютерной программы «Видеоденситометр Sorbfil v1.7» (г. Краснодар). Количественное определение проводили методом абсолютной калибровки (внешнего стандарта), по градуировочному графику зависимости «масса вещества – площадь пика» (линейная аппроксимация).
Результаты и их обсуждение. Определение хроматографических характеристик. Для выбора наиболее эффективных пластинок исследовали пластинки следующих марок: ПТСХ-П-В-УФ, ПТСХ-П-А-УФ и ПТСХ-АФ-В-УФ (г. Краснодар). Эффективность пластинки определяли по числу теоретических тарелок (NTR) и ассиметрии (As) пятен стандартных образцов.
Таблица 1 – Показатели эффективности различных типов пластинок
|
Тип пластики |
NTR |
As |
|
ПТСХ-П-В-УФ |
1308±250 |
0,67±0,09 |
|
ПТСХ-П-А-УФ |
694±185 |
0,48±0,03 |
|
ПТСХ-АФ-В-УФ |
604±121 |
0,39±0,03 |
Наиболее эффективными являются пластинки марки ПТСХ-П-В-УФ, которые были выбраны нами для определения хлорогеновой кислоты в спиртовом извлечении (табл. 1).
Чувствительность детектирующего реагента устанавливали по величине предела обнаружения (ПО), нанося точно известное количество СО хлорогеновой кислоты на хроматографическую пластинку. Готовили растворы стандартного образца с концентрациями 0,1; 0,2; 0,3; 0,4; 0,5; 1,0 и далее – до 3-х мкг/мкл. На пластинку наносили по 1 мкл приготовленных растворов и хроматографировали. ПО составляет 0,5 мкг/мкл.
Специфичность определяли по величине Rf пятна контрольного трека, которое должно соответствовать Rf пятен стандартного образца (0,56±0,02). На треках контрольного образца визуально обнаруживалось пятно тёмно-коричневого цвета с Rf 0,54, что соответствует окраске и Rf стандартных образцов (рис 1.).
Статистическая обработка результатов проводилась в соответствии с ОФС «Статистическая обработка результатов химического эксперимента и биологических испытаний» [1].
Валидация методики количественного анализа проведена по следующим критериям: линейность, правильность и сходимость результатов.
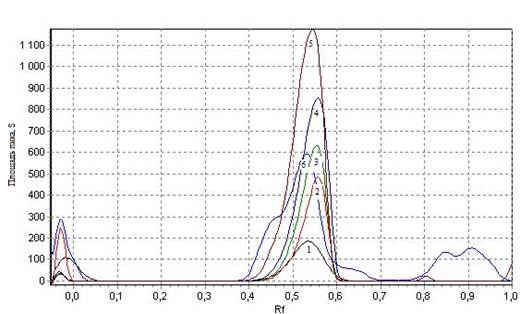
Рисунок 1 – Оцифрованная хроматограмма СО хлорогеновой кислоты и спиртового извлечения:
1 – 1 мкг/мкл; 2 – 1,5 мкг/мкл; 3 – 2 мкг/мкл; 4 – 2,5 мкг/мкл; 5 – 3 мкг/мкл; 6 – спиртовое извлечение
Линейность устанавливали по градуировочным графикам, полученным при компьютерной обработке хроматограмм в координатах площадь пика (S) – масса (m, мкг). Диапазон концентраций хлорогеновой кислоты 1,0-3,0 мкг/мкл. По данным градуировочных графиков рассчитывали статистические характеристики и коэффициент корреляции. Методом наименьших квадратов определяли значимость свободного члена линейной зависимости (а), углового коэффициента (b). Расчеты проводили с помощью программы Microsoft Excel. Градуировочный график по данным одной из пластин описывается уравнением y = (10,7х - 7,3)103, коэффициент корреляции r = 0,984 (рис. 2).
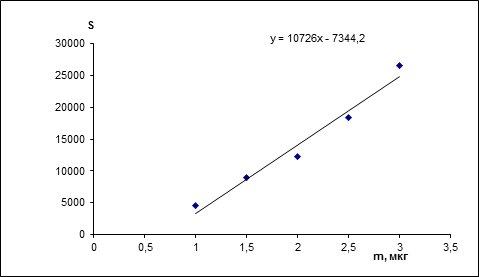
Рисунок 2 – Градуировочный график хлорогеновой кислоты
Правильность методики определяли методом «введено-найдено». По уравнению градуировочного графика рассчитывали содержание хлорогеновой кислоты на 5-и уровнях концентраций СО и рассчитывали метрологические характеристики (табл. 2).
Таблица 2 – Результаты определения открываемости хроматографической методики
|
Уровень |
Взято, мкг |
Найдено, мкг |
Открываемость, % |
Метрологические характеристики |
|
1 |
1,0 |
1,06 |
106 |
Хср = 100,7 DХ = 6,13 SD = 8,57 RSD% = 8,5% Е% =6,1% |
|
1 |
1,0 |
1,06 |
106 |
|
|
2 |
1,5 |
1.37 |
91 |
|
|
2 |
1,5 |
1,47 |
98 |
|
|
3 |
2,0 |
2,14 |
107 |
|
|
3 |
2,0 |
2,02 |
101 |
|
|
4 |
2,5 |
2,22 |
89 |
|
|
4 |
2,5 |
2,35 |
93 |
|
|
5 |
3,0 |
3,5 |
117 |
|
|
5 |
3,0 |
2,97 |
99 |
Сходимость методики оценивали по результатам повторного определения содержания хлорогеновой кислоты в растительном сырье (табл. 3).
Таблица 3 – Экспериментальные данные определения хлорогеновой кислоты
|
Результат расчета концентрации |
|||
|
Номер трека |
Стандарт/Проба |
Количество |
Rf |
|
1 |
Стандарт |
1,08 мкг |
0,56 |
|
2 |
Стандарт |
1,62 мкг |
0,58 |
|
3 |
Проба |
3900 мг/кг |
0,55 |
|
4 |
Стандарт |
2,16 мкг |
0,57 |
|
5 |
Проба |
3400 мг/кг |
0,56 |
|
6 |
Стандарт |
2,7 мкг |
0,58 |
|
7 |
Проба |
3700 мг/кг |
0,55 |
|
8 |
Стандарт |
3,24 мкг |
0,56 |
|
9 |
Проба |
3900 мг/кг |
0,53 |
Выводы. В результате проведённых исследований разработана методика идентификации и количественного определения хлорогеновой кислоты в растительном сырье методом планарной хроматографии на пластинках марки ПТСХ-П-В-УФ (г. Краснодар). Полученные данные свидетельствуют, что методика специфична, имеет достаточно высокую чувствительность и эффективность. Методика количественного определения отвечает необходимым требованиям по показателям линейность, правильность и сходимость.
Содержание хлорогеновой кислоты в корнях и корневищах любистка лекарственного, определённое данной методикой, составило 0,37% в пересчёте на воздушно сухое сырьё.
Рецензенты:
Компанцев В.А., д.ф.н., профессор кафедры неорганической химии Пятигорского медико-фармацевтический института – филиала ГБОУ ВПО ВолгГМУ Минздрава России, г.Пятигорск.
Кодониди И.П., д.ф.н., доцент кафедры органической химии Пятигорского медико-фармацевтический института – филиала ГБОУ ВПО ВолгГМУ Минздрава России, г.Пятигорск.



