Введение. Известно, что введение 2,4 – динитрофенола вызывает развитие острой тканевой гипоксии [4] из-за разобщения процессов окисления и фосфорилирования, что приводит к расстройству функции почек с нарушением главного энергозависимого процесса - реабсорбции ионов натрия, белка в проксимальном отделе нефрона, повреждения печени [1]. В развитии ранних механизмов повреждения печени и почек при данных условиях могут играть цитокины, продукты окислительной модификации белков с формированием синдромов транслокации и потери ионов натрия с мочой. Как средство патогенетической коррекции этих нарушений целесообразно использовать антиоксидант мелатонин.
Цель исследования. Выяснить ранние механизмы повреждения печени и почек при условии гипонатриевого рациона питания в условиях острой тканевой гипоксии, вызванной введением 2,4-динитрофенола с разработкой путей патогенетической коррекции выявленных нарушений путем использования мелатонина.
Материал и методы исследования
В экспериментах на 120 самцах белых нелинейных крыс массой 0,16-0,20 кг исследовали острую тканевую гипоксию, которую моделировали путем введения 0,1% раствора 2,4- динитрофенола внутрибрюшинно в дозе 3 мг/кг однократно [3]. Устойчивость крыс к острой гипоксии оценивали по времени потери позы на “высотном плато“ острой гипобарической гипоксии и временем общего пребывания животных от момента достижения “высоты“ 12000 м до появления второго агонального вдоха (время жизни или резервное время), а также с учетом времени восстановления позы с момента начала спуска. Выделяли 3 группы животных: высоко-, средне- и низкоустойчивые [2]. Все дальнейшие исследования проводили на среднеустойчивых крысах.
Участки тканей печени и почек фиксировали в течении 48 часов в 10% растворе нейтрального забуференного формалина, после чего проводили процедуру обезвоживания в восходящей батарее этанола и парафиновую заливку при температуре 580С. Для оценки окислительной модификации белков срезы гистохимически окрашивали бромфеноловым синим по Микель-Кальво. Компьютерную спектрометрию осуществляли при помощи компьютерной программы ColorPic (Graphic Art Tools, 2004). Способ гистохимического определения соотношения между основными и кислыми группами белков, основанный на измерении интенсивности красного и синего цветов спектра при компютерно-спектральном анализе цифровых изображений микроскопческих объектов и расчета коэфициента R/B, как соотношения между интенсивностью окрашивания в участке красного спектра (R) к интенсивности окрашивания в участке синего спектра (B) [6].
Функциональное состояние почек исследовали при условии водной нагрузки, для чего крысам внутрижелудочно, при помощи металлического зонда, вводили водопроводную воду подогретую до температуры 37оС в количестве 5% от массы тела. Величину диуреза (V) оценивали в мл/2 часа ּ100 г. После водной нагрузки с целью получения плазмы проводили эвтаназию животных путем декапитации под легким эфирным наркозом, кровь собирали в пробирки с гепарином. Скорость клубочковой фильтрации (Сcr) оценивали по клиренсу эндогенного креатинина, которую расчитывали по формуле:
Сcr = Ucr ּ V/Pcr
где Ucr и Pcr - концентрация креатинина в моче и плазме крови соответственно. Концентрации ионов натрия, калия в моче и плазме крови оценивали методом пламенной фотометрии, концентрацию белка мочи определяли сульфосалициловым методом. Исследовали проксимальную и дистальную реабсорбцию ионов натрия (ТрNa+, TdNa+). Расчеты проводили по формулам:
TpNa+ = (Ccr - V) ּ PNa+ ּ
TdNa+ = (PNa+- UNa+) ּ V [7]
Цитокины крови определяли иммуноферментным методом [2, 3, 4].
Экзогенный мелатонин вводили в дозе 3,5 мг/кг однократно [8].
Статистическую обработку полученных данных проводили на компютере с помощью программы “Statgrafics” и “Excell 7.0”. Все исследования выполнены на основании Конвенции Совета Европы по охране позвоночных животных, которых используют в экспериментах и других научных целях (от 18.03.1986 г.), Директивы ЕЭС № 609 (от 24.11.1986 г.), приказов МЗ Украины № 960 от 23.09.2009 г и № 944 от 14.12.2009 г.
Результаты исследования и их обсуждение. Результаты исследований показали возрастание концентраций фактора некроза опухолей-α, интерлейкина -1β, интерлейкина-6 в плазме крови (рис.1) через 2 часа после введения 2, 4 – динитрофенола в дозе 3 мг/кг в условиях гипонатриевого рациона питания.
При введении 2, 4 – динитрофенола величина мочевыделения снижалась, возрастала концентрация ионов калия, белка в моче, снижалась клубочковая фильтрация (табл. 1). Концентрации креатинина в плазме крови и моче не изменялись. Оценка транспорта ионов натрия при условии введения 2, 4 – динитрофенола характеризовалась возрастанием концентрации ионов натрия в моче. Проксимальная реабсорбция ионов натрия характеризовалась тенденцией к торможению, а дистальная реабсорбция этого электролита снижалась достоверно. Концентрация ионов натрия в плазме крови не изменялась.
На рис. 2 показан форест-график сравнительной оценки защитного влияния мелатонина на коэффициент R/B цитоплазмы эпителия проксимальних канальцев, экскрецию ионов натрия, клиренс ионов натрия, концентрационный индекс ионов натрия через 2 часа после введения 2, 4 – динитрофенола в дозе 3 мг/кг при условии гипонатриевого рациона питания при водном индуцированном диурезе в объеме 5% от массы тела. Контроль для всех исследований представлено в виде вертикальной линии и принято за 1.
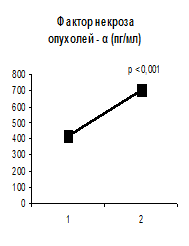
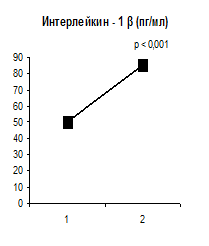
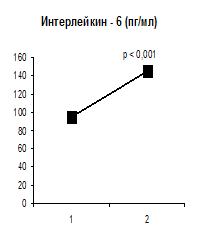
Рис.1. Концентрации фактора некроза опухолей- α, интерлейкина -1 β, интерлейкина - 6 в плазме крови (пг/мл) через 2 часа после введения 2, 4 – динитрофенола в дозе 3 мг/кг при условии гипонатриевого рациона питания при водном индуцированном диурезе в объеме 5% от массы тела.
1- контроль, 2 - введение 2, 4 – динитрофенола.
p – достоверность отличий в сравнении с контролем.
Таблица 1
Показатели функции почек через 2 часа после введения 2, 4 – динитрофенола в дозе 3 мг/кг при условии гипонатриевого рациона питания при водном индуцированном диурезе в объеме 5% от массы тела (x±Sx)
|
Показатели |
Контроль (n=10) |
2, 4 – динитро-фенол (n=10) |
|
Диурез, мл/2 час ∙ 100 г |
4,58±0,299 |
3,72±0,253 p< 0,05 |
|
Концентрация ионов калия в моче, ммоль/л |
15,30±1,963 |
26,90±4,394 p< 0,02 |
|
Концентрация креатинина в моче , ммоль/л |
1,46±0,086 |
1,41±0,058 |
|
Концентрация креатинина в плазме крови, ммоль/л |
53,50±3,106 |
47,10±2,030 |
|
Клубочковая фильтрация, мкл/мин ∙100 г |
1096,6±136,57 |
919,1±42,61 |
|
Концентрация белка в моче, г/л |
0,019±0,0037 |
0,032±0,0063 |
|
Концентрация ионов натрия в моче, ммоль/л |
0,37±0,053 |
0,76±0,061 p< 0,001 |
|
Концентрация ионов натрия в плазме крови, ммоль/л |
135,5±1,89 |
136,0±1,675 |
|
Дистальная реабсорбция ионов натрия, мкмоль/2 часа ∙ 100 г |
618,1±40,88 |
503,5±34,73 p< 0,05 |
|
Проксимальная реабсорбция ионов натрия, ммоль/2 часа ∙ 100 г |
17,29±2,293 |
14,53±0,811 |
p – достоверность отличий в сравнении с контролем; n - число наблюдений.
Как видно из приведенного графика найболее существенное протекторное влияние в условиях опыта мелатонин выявлял на концентрационный индекс ионов натрия.
Введение 2,4-динитрофенола приводило к усилению окислительной модификации белков по возрастанию показателя R/B в проксимальных канальцах, мозговых толстых восходящих отделах петли нефрона, собирательных канальцах сосочка почек, в белковых массах цитоплазмы гепатоцитов (табл. 2).
Таблица 2
Степень окислительной модификации белков по коеффициенту R/B (усл. ед.) при гистохимическом анализе срезов почек и печени крыс после введения 2, 4 – динитрофенола и при действии мелатонина (Х±Sx)
|
Структура, где измерялся показатель R/B |
Группы исследования |
||
|
Контроль, интактные животные (n = 8) |
Введение 2,4-динитрофенола (n = 8) |
Введение 2,4-динитрофенола на фоне мела-тонина (n =8) |
|
|
Цитоплазма эпителия проксимальных канальцев |
1,08±0,005 |
1,39±0,009 p < 0,001 |
1,24±0,008 р1< 0,001 |
|
Цитоплазма эпителия мозговых толстых восходящих частей петли нефрона |
1,04±0,004 |
1,18±0,007 p < 0,001 |
1,05±0,004 р1< 0,001 |
|
Цитоплазма эпителия трубочек сосочка |
1,03±0,004 |
1,15±0,008 p < 0,001 |
1,04±0,005 р1< 0,001 |
|
Белковые массы цитоплазмы гепатоцитов |
1,12±0,006 |
1,26±0,009 p < 0,001 |
1,19±0,008 р1< 0,001 |
р – достоверность отличий в сравнении с контролем, р1- достоверность отличий в сравнении с введением 2,4-динитрофенола, n – число наблюдений.
Введение 2, 4 – динитрофенола обусловливало снижение уровня АТФ в почечных канальцах в среднем в 2 раза [2] за счет расщепления окисления и фосфорилирования. Дефицит АТФ обусловливал нарушения главного энергозависимого процесса почечных канальцев – реабсорбции ионов натрия, что приводило к развитию синдрома потери исследуемого катиона. Обозначенное подтверджено ростом концентрации ионов натрия в моче. Тенденция к снижению проксимальной реабсорбции ионов натрия обусловлена “скрытым” повреждением проксимального отдела нефрона [7], а вероятное снижение дистальной реабсорбции исследуемого катиона обусловлено тем, что процессы транспорта в дистальном канальце есть более энергозависимы нежели в проксимальном отделе нефрона.
В тоже время, степень проявлений синдрома потери был несущественным, поскольку концентрация ионов натрия в плазме крови не менялась, а несущественная активация ренин-ангиотензин-альдостероновой системы вызывала только вероятное снижение диуреза, возрастание концентрации ионов калия в моче при наличии тенденции к торможению клубочковой фильтрации. Повреждение баръеров кишечника и печени на фоне энергодефицита приводило к транслокации эндотоксина с просвета кишечника в кровь [5], который обусловливал возрастание концентраций фактора некроза опухолей-α, интерлейкина-1β и интерлейкина-6, которые у свою очередь вызывали дополнительные реакции повреждения почечных канальцев с усилением проявления синдрома потери ионов натрия.
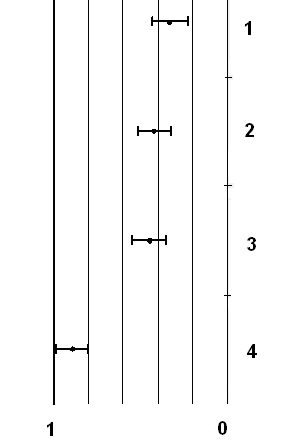
Рис. 2. Форест-график сравнительной оценки защитного влияния мелатонина на коеффициент R/B цитоплазмы эпителия проксимальных канальцев, экскрецию ионов натрия, клиренс ионов натрия, концентрационный индекс ионов натрия через 2 часа после введения 2, 4 – динитрофенола в дозе 3 мг/кг при условии гипонатриевого рациона питания при водном индуцированном диурезе в объеме 5% от массы тела.
1- концентрационный индекс ионов натрия (усл. ед.); 2- клиренс ионов натрия (мл/2 часа ∙ 100 г); 3- экскреция ионов натрия (мкмоль/2 часа ∙ 100 г); 4 – коефициент R/B цитоплазмы эпителия проксимальных канальцев – (усл. ед.); Контроль для всех исследований представлено в виде вертикальной линии и принято за 1.
При гипонатриевом рационе питания через 2 часа моделирования тканевой гипоксии после введения 2,4-динитрофенола установлено возрастание концентраций фактора некроза опухолей- α, интерлейкинов 1β и -6 в плазме крови, показано повышение степени окислительно-модифицированных белков в почках и печени крыс по коэфициенту R/B, которые вызывали повреждения печени и почек, нарушения энергетического обмена с развитием синдромов транслокации и потери ионов натрия с мочой с возрастанием его экскреции. Мелатонин за счет антиоксидантных свойств проявлял защитное влияние на течение псевдогепаторенального синдрома [9, 10] при тканевой гипоксии, который выявлял защитное влияние на степень окислительно-модифицированых белков в почках и печени крыс, уменьшал уровень коефициента R/B в проксимальных, дистальных отделах нефрона, собирательных канальцах сосочка почек и белковых массах цитоплазмы гепатоцитов в сравнении со значениями при интоксикации 2,4-динитрофенолом.
Вывод
В опытах на белых нелинейных половозрелых крысах-самцах при гипонатриевом рационе питания в условиях моделирования тканевой гипоксии с позиций доказательной медицины приведено теоретическое обобщение и новое решение научной задачи относительно ранних механизмов патогенеза псевдогепаторенального синдрома как основания ухудшения течения почечной и печеночной недостатности при разобщении окисления и фосфорилирования на фоне введения 2,4- динитрофенола.
Рецензенты:
Швец В.И., д.б.н., профессор, профессор кафедры физиологии имени Я.Д.Киршенблата Буковинского государственного медицинского университета МЗ Украины, г.Черновцы.
Заморский И.И., д.м.н., профессор, заведующий кафедрой фармакологии Буковинского государственного медицинского университета МЗ Украины, г.Черновцы.



