Вирусный гепатит С входит в число социально значимых заболеваний и является одной из основных причин хронической болезни печени. По оценкам ВОЗ, в мире 170 млн людей, или 3% населения, инфицированы вирусом гепатита С (HCV) [9]. В настоящее время «золотым стандартом» противовирусной терапии хронического гепатита С (ХГС) является пегилированный интерферон в сочетании с рибавирином. Комбинированная противовирусная терапия обеспечивает устойчивый вирусологический ответ в среднем у 50–60 % больных хроническим гепатитом С, в том числе у 40–50 % пациентов с генотипом 1 HCV и 70–80 % – с генотипами 2 и 3. Индивидуальный подход к лечению, своевременная профилактика и коррекция нежелательных явлений повышают эффективность лечения, однако почти в 40 % случаев противовирусная терапия оказывается неэффективной [1]. Появился генетический маркер, позволяющий отчасти прогнозировать ее результат: полиморфизм гена интерлейкина 28В (IL28B) определяет в известной степени чувствительность иммунной системы пациента к стимуляции интерфероном [2].
В 2009 г. D. Ge и соавт. обнаружили в 19 хромосоме однонуклеотидную замену в IL28В, которая, с учетом локализации, была обозначена как rs12979860. В зависимости от азотистого основания, располагающегося в данном локусе, были выделены 2 аллеля: rs12979860 С (цитозин) и rs12979860 Т (тимин). Исходя из комбинации аллелей, возможны 3 генотипических варианта полиморфизма гена IL28В: СС, СТ и ТТ. В зависимости от частоты в популяции аллель rs12979860 С является мажорным, т.е. встречающимся чаще, а аллель rs12979860 Т – минорным [6]. Доказано, что частота позитивного ответа на противовирусную терапию выше у пациентов с генотипами rs12979860 СС (70,5 %) и ниже у пациентов с генотипами rs12979860 СТ и ТТ (32,0 % и 23,3 %, соответственно) [10]. Носительство аллеля Т, повышающее вероятность отрицательного ответа на противовирусную терапию, имеет большее значение, чем «защитный эффект» аллеля С. Тем не менее генотип СС способствует элиминации вируса. Определение полиморфизма гена IL28В позволило прогнозировать вероятность достижения устойчивого вирусологического ответа с чувствительностью 65 % и специфичностью 78 % для маркера rs12979860 этого гена [6, 11].
Определение генетического полиморфизма этого маркера имеет наибольшее значение для пациентов с генотипом 1 HCV, учитывая более низкую частоту ответа на стандартную противовирусную терапию. В некоторых исследованиях не было выявлено четкой связи между полиморфизмом IL28В и частотой устойчивого вирусологического ответа у таких пациентов [7]. Определение генотипа IL28В имеет большое значение для оценки потенциального ответа на противовирусную терапию и отбора пациентов, у которых возможны более короткие курсы лечения. В целом полиморфизм IL28В – это один из факторов, позволяющих индивидуализировать лечение хронического гепатита С [10]. В литературе есть данные о том, что полиморфизм гена IL28В ассоциирован развитием с гепатоцеллюлярной карциномы, индуцированной HCV [5]. Таким образом, представляется интересным изучение взаимосвязи полиморфизма этого гена с тяжестью поражения печени, в частности с нарушениями функциональных печеночных проб, лабораторными тестами фиброза и регенерации печени, что поможет уточнить роль полиморфизма IL28В в патогенезе и прогрессировании ХГС.
Цель исследования – изучить взаимосвязь лабораторных маркеров цитолиза, холестаза, гиалуроновой кислоты (ГК), альфа-фетопротеина (АФП), уровня вирусной нагрузки (ВН) и генетического полиморфизма IL28B в участке rs12979860 у больных ХГC.
Материалы и методы. Обследовано 100 пациентов с ХГС в фазе реактивации, госпитализированных в Пермскую краевую инфекционную клиническую больницу для начала проведения комбинированной противовирусной терапии. Средний возраст больных составил 38,3±10,4 года, из них 48 мужчин и 52 женщины. Этиологическая верификация диагноза проводилась качественным и количественным определением в крови у пациентов РНК HCV с помощью полимеразной цепной реакции (ПЦР), а также серологических маркеров HCV. По генотипу HCV пациенты с ХГС разделились следующим образом: генотип 1 определен у 56 % больных, генотип 2 и 3 – у 44 %. Сопоставимая по полу контрольная группа включала 90 практически здоровых (доноров) лиц со средним возрастом 36,3±7,9 лет, не имеющих заболеваний печени.
Биохимические показатели в сыворотке крови определяли на автоматическом анализаторе «Architect-4000» (США). Уровень ГК – прямого маркера фиброза печени в сыворотке крови, оценивали с помощью набора ВСМ Diagnostics методом иммуноферментного анализа на анализаторе «Stat-Fax» (США) у 76 больных. Концентрацию АФП в сыворотке крови исследовали методом иммунохемилюминисцентного анализа с помощью набора "AFP" (Siemens) на анализаторе «Immulitе-1000» (Германия) у 44 больных. В группе контроля концентрацию ГК и АФП исследовали у 20 практически здоровых лиц.
Для выявления полиморфных вариантов маркера rs12979860 гена IL28B использовали аллель-специфическую ПЦР с детекцией продуктов в режиме реального времени. Дизайн праймеров и зондов осуществляли сотрудники ЗАО «Синтол» (г. Москва). Термоциклирование проводили на детектирующем амплификаторе «CFХ-96» Bio-Rad Laboratories, Inc. (США). Для определения генотипов указанного гена у всех пациентов с ХГС и 90 здоровых доноров проводилось выделение ДНК из цельной венозной крови, предварительно стабилизированной ЭДТА.
Статистическую обработку полученных результатов проводили с использованием программы Statistica 7.0 (StatSoft). Проверку распределения результатов проводили по критерию Колмогорова – Смирнова. Для описания полученных количественных признаков данные представляли в виде медианы (Ме) и 25, и 75 перцентиля, минимума (min) и максимума (max). Так как распределение показателей ГК и АФП отклонялось от нормального, для оценки значимости различий независимых групп использовали непараметрический критерий Манна – Уитни. Для описания соотношения частот генотипов и аллелей генов использовали равновесие Харди – Вайнберга. Исследуемые группы находились в равновесном (устойчивом) состоянии по частотам генотипов изученного гена (р>0.05). Различия в двух популяциях рассчитывались по отношению шансов (OR) с использованием подхода «случай-контроль» для различных моделей наследования: аддитивной, общей, мультипликативной, доминантной и рецессивной, и считались достоверными при р<0.05. Количественная оценка линейной связи между двумя независимыми величинами определялась с использованием коэффициента ранговой корреляции по Спирмену (r). Значимость взаимосвязей и различия между выборками считались достоверными при значении для р<0,05.
Результаты исследования и их обсуждение
С учетом биохимических показателей крови у пациентов с ХГС был выявлен синдром цитолиза, который характеризовался увеличением в сыворотке крови активности аланиновой (АЛТ) и аспарагиновой трансаминаз (АСТ), мезенхимально-воспалительный синдром (увеличение тимоловой пробы) и синдром холестаза (повышение активности щелочной фосфатазы, прямого билирубина).
В группе больных ХГС отмечено повышенное содержание ГК, что отражает активацию фиброза на фоне хронического воспалении печени, при этом медиана концентрации ГК в крови в 2 раза превышала уровень показателя в группе контроля (р=0,01) (табл. 1). Концентрация АФП, как маркера регенерации гепатоцитов, у больных ХГС также была достоверно выше, чем в контрольной группе.
Таблица 1
Гиалуроновая кислота и альфа-фетопротеин у больных ХГС и в контрольной группе
|
Показатель, единица измерения |
Значение медианы (25-75 % перцентилей); [Min- и Max- величины показателя] |
р |
|
|
Группа контроля |
Пациенты с ХГС |
||
|
ГК, нг/мл |
21(8,0-31,4); [0,0-63,0] |
40,5(24,15-80,5); [7,4-498,2] |
0,0023 |
|
АФП, МЕ/мл |
1,13(0,8-1,49); [0,5-2,64] |
2,2(1,66-2,92); [0,86-27,4] |
0,0002 |
р – значимость различий показателя в исследуемых группах рассчитана по тесту Манна –Уитни.
Вирусемия у больных ХГС демонстрировала большие разбросы показателей ВН. Уровень ВН у больных в 70 % был высокий – выше 2*106 копий/мл, в 30 % случаев низкий – ниже 2*106 копий/мл. При этом минимальная вирусемия составила 0,022*106, максимальная – 8800*106 копий/мл. Вариабельность вирусемии в группе обследованных при реактивации ХГС согласуется с литературными данными [8].
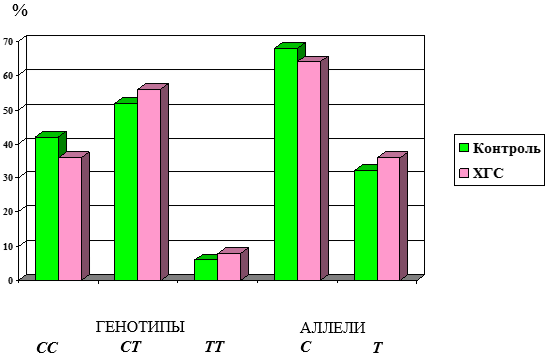
Рисунок 1. Распространенность генотипов и аллелей полиморфизма гена IL-28В (rs12979860) у больных ХГС и в группе контроля
Распространенности гомозигот по аллелю С (СС) в группе здоровых и больных ХГС достоверно не отличались (χ2=0,61; р=0,44) и составили соответственно 42 % и 36 % (рис. 1). Встречаемость патологических гомозигот ТТ в группе здоровых и больных ХГС составила соответственно 6 % и 8 % (χ2=0,35; р=0,55). В обеих группах преобладали гетерозиготы СТ (χ2=0,79; р=0,67). Соотношение частот аллелей изучаемого маркера в исследуемых группах также не характеризовалось различием. Встречаемость патологического минорного аллеля Т в группе с ХГС составила 36 %, в группе контроля 32 % (χ2=0,64; р=0,42). Полученные результаты по встречаемости генотипов и аллелей IL-28В (rs12979860) как для здоровых лиц, так и в группе ХГС среди популяции Пермского края практически не отличаются от данных других авторов. В частности, в России распространенность протективного аллеля С в популяции составляет 61–64 %, в наших исследованиях – 64 % у больных ХГС и 61 % в группе контроля [5, 10]. Таким образом, в ходе исследования не было установлено статистически значимого отличия частот генотипов и аллелей маркера IL-28В (rs12979860) между группами здоровых индивидуумов и лиц с ХГС. В группе больных ХГС частота аллеля риска Т составила 0,359, что достоверно не отличалось от его частоты 0,319 среди здоровых. Из 56 больных, инфицированных HCV-1, у 40 человек было выявлено неблагоприятное сочетание генотипов rs12979860 СТ и ТТ (35 и 5 соответственно), что значимо отличалось от группы контроля (χ2=4,55; р=0,03). Таким образом, потенциальный риск развития неустойчивого вирусологического ответа при 1 генотипе HCV составил 71,4 %.
При корреляционном анализе минорный аллель Т гена IL-28В (rs12979860) продемонстрировал достоверные взаимосвязи с функциональными печеночными тестами: АЛТ, АСТ, общим и прямым билирубином, что указывает на взаимосвязь полиморфизма гена и тяжести поражения печени. Эти данные также свидетельствуют о неблагоприятном влиянии выраженности цитолиза и холестаза на прогноз противовирусной терапии (табл. 2). Полученные результаты согласуются с данными исследования Agundez J.A. и соавт. (2009), которые выявили взаимосвязь генного полиморфизма с АЛТ, гамма-глютамилтранспептидазой, соотношением АСТ/АЛТ [3].
Таблица 2
Взаимосвязи минорного аллеля Т гена IL-28В (rs12979860) с функциональными печеночными пробами, гиалуроновой кислотой и альфа-фетопротеином при ХГС
|
Показатели |
r |
p |
|
Аллель Т гена IL-28В и АЛТ |
0,25 |
0,02 |
|
Аллель Т гена IL-28В и АСТ |
0,22 |
0,019 |
|
Аллель Т гена IL-28В и общий билирубин |
0,19 |
0,049 |
|
Аллель Т гена IL-28В и прямой билирубин |
0,25 |
0,02 |
|
Аллель Т гена IL-28В и ГК |
0,17 |
0,03 |
|
Аллель Т гена IL-28В и АФП |
0,25 |
0,02 |
|
Аллель Т гена IL-28В и уровень ВН |
0,25 |
0,021 |
r – взаимосвязь показателей; р – значимость корреляции.
Положительная достоверная корреляция аллеля Т и ГК указывает на то, что исследуемый ген может быть оценен как фактор прогрессирования фиброза печени. Корреляция с АФП предполагает также взаимосвязь полиморфизма гена с более выраженным поражением печени и риском гепатокарциномы. Eurich D. и соавт. (2012) выявили связь IL-28В с АФП при гепатокарциноме на фоне ХГС и с прогрессированием фиброза у пациентов с HCV-инфекцией после трансплантации печени [5]. Взаимосвязь аллеля Т с уровнем ВН может свидетельствовать о более тяжелом поражении гепатоцитов у пациентов с ХГС, что согласуется с выявленной взаимосвязью ГК и степени вирусемии [3]. В целом выявленные взаимосвязи минорного аллеля Т гена с изученными тестами указывают на тот факт, что генетический полиморфизмом IL-28В может реализоваться опосредованно через ряд параметров, участвующих в патогенезе ХГС и оказывающих влияние на эффективность противовирусной терапии. К этим факторам относятся наличие синдромов цитолиза и холестаза, выраженность фиброза печени, активация регенерации гепатоцитов и уровень ВН.
Таким образом, полиморфизм гена IL-28В (rs12979860) ассоциирован с тяжестью поражения печени у больных ХГС, что необходимо учитывать для решения вопроса об оптимизации лечения при неблагоприятном сочетании этих факторов, в особенности у пациентов с носительством минорного аллеля Т.
Выводы
1. У пациентов с ХГС в фазе реактивации выявлено повышение ГК и АФП, что свидетельствует об активации фиброза и регенерации в печени.
2. В ходе исследования не было установлено статистически значимого отличия частоты встречаемости генотипов и аллелей гена IL-28В (rs12979860) между группами здоровых индивидуумов и больных ХГС с различными генотипами вируса.
3. У 71,4 % больных, зараженных HCV-1, имело место неблагоприятное сочетание генотипов rs12979860 СТ и ТТ и соответственно потенциальный риск развития отрицательного ответа на противовирусную терапию с максимальным его проявлением у гомозигот ТТ.
4. У больных ХГС выявлена взаимосвязь минорного аллеля Т гена IL-28В (rs12979860) со степенью выраженности синдромов цитолиза и холестаза, маркерами фиброза и регенерации печени, а также с уровнем вирусемии.
5. Больным ХГС с 1 генотипом HCV для определения прогноза противовирусной терапии и решения вопроса оптимизации лечения необходимо оценивать совокупность факторов: выраженность цитолиза и холестаза, концентрацию ГК, АФП и исходный уровень виремии, в особенности у пациентов с носительством минорного аллеля Т гена IL-28В.
Рецензенты:
Устинова О.Ю., д.м.н., профессор, заместитель директора по лечебной работе ФБУН «Федеральный научный центр медико-профилактических технологий управления рисками здоровью населения», г. Пермь.
Гейн С.В., д.м.н., ведущий научный сотрудник лаборатории биохимии развития микроорганизмов Института экологии и генетики микроорганизмов УРО РАН, г. Пермь.



