Введение
Одним из наиболее перспективных методов получения аминокислот является их синтез с помощью микроорганизмов. Таким способом были получены аминокислоты, синтез которых из предшественников является экономически целесообразным. Поиск новых бактериальных продуцентов и путей увеличения выхода незаменимых аминокислот остается одним из наиболее перспективных направлений исследований в современной микробиологии и биотехнологии [4].
На сегодняшний день актуальной задачей является аналитическое сопровождение биотехнологического процесса для отработки оптимального режима работы ферментера и обеспечения всех условий технологии микробного синтеза, с целью повышению продуктивности продуцента.
Для микробиологического синтеза аминокислот, в том числе незаменимой – лизина, одним из лучших продуцентов является Corynebacterium glutamicum. Получение лизина представляет собой направленный и регулируемый процесс биосинтеза, эффективность которого зависит от ряда факторов, как генетических особенностей штамма, так и условий культивирования, в частности температуры, pH, состава питательной среды, витаминов и БАВ (факторов роста) [1,8,11].
Известно, что микроорганизмы имеют гибкие механизмы регуляции метаболизма, которые позволяют им быстро адаптироваться к меняющимся условиям окружающей среды. Одной из реакций адаптации бактерий является синтез внеклеточных ферментов, что, в свою очередь, в значительной степени определяется составом питательной среды и условиями культивирования [6,9].
В микробиологическом синтезе источником углерода, кроме традиционных углеводов (сахароза, глюкоза), могут служить и органические кислоты. В тоже время существует возможность регуляции метаболической активности микроорганизмов путем изменения углеродного питания. Известно, что органические кислоты, особенно кетокислоты, недоступны для большинства микроорганизмов. Однако, по мнению некоторых исследователей, органические кислоты могут успешно ими усваиваться [1,6]. В настоящее время уксусная кислота применяется в качестве основного или дополнительного источника углерода при биосинтезе L-лизина, L-глутаминовой кислоты, L-треонина, L-изолейцина [3,9].
При исследовании влияния совместного внесения глюкозы и ацетата, как фактора роста, для биосинтеза лизина Corynebacterium glutamicum RC 115 и анализе выхода лизина при других углеродных субстратах было обнаружено, что небольшие количества уксусной кислоты, вводимые с глюкозо-ацетатом при глубинной культивации в биореакторе, вызвало небольшое снижение коэффициенты поглощения глюкозы и роста бактерий. Но и значительное увеличение клетками удельной скорости синтеза лизина и тем самым увеличение общего выхода лизина. Введение в больших количествах ацетата, в отличие от первого эксперимента вызвало резкое снижение продукции лизина. Таким образом, было показано, что ацетат в низких концентрациях могут быть использованы совместно с глюкозой как подпитка для увеличения клетками удельной скорости синтеза лизина и общего выхода лизина C. glutamicum RC 115. Добавление ацетата выявлено перспективный способ увеличения синтеза лизина бактериальными клетками, выращенных с добавлением глюкозо-ацетатных подпиток [10,12].
Повышение эффективности технологии биосинтеза лизина может быть основана не только на подборе лучшего субстрата, то есть источника углеводородов, но и на основе использования биологически активных веществ, для повышения физиологической активности микроорганизмов-продуцентов [5,6,9].
Как правило, небольшое количество биологически активных веществ существенно улучшает физиологические процессы в клетке, и тем самым, дает более высокие показатели продуктивности культуры.
Очень важным фактором для увеличения эффективности биосинтеза лизина является наличие в среде, в достаточных концентрациях, витаминов группы В. Для развития культуры необходим тиамин в концентрации 200 мкг на 1 л среды. Важным регулятором процесса является также биотин. Corynebacterium glutamicum при концентрации биотина в среде, равной 1—4 мг/мл, продуцирует глутаминовую кислоту, а при концентрации 15— 20 мкг/л — лизин. Считают, что биотин изменяет проницаемость клеточной мембраны. При концентрации биотина 2,5 мг/л стимулируется также образование молочной кислоты [7,9].
Рядом авторов отмечено положительное влияние на рост культуры бактерий при добавлении их в жидкую питательную среду витаминов группы В и различных БАВ [3,6,9,7].
Цель работы – изучить влияние БАВ и витамина В2 на рост Corynebacterium glutamicum B-11167 на жидкой питательной среде LB.
Материалы и методы
В основу эксперимента положена методика культивирования бактерий продуцента лизина штамма Corynebacterium glutamicum B-11167, предложенная ФГУП «ГосНИИгенетика» [1].
Подготовка культуры.
Подготовка культуры для эксперимента включала пересев с чашек Петри после термостатирования при 30 0С 48 часов, затем вели отбор продуктивных клонов путем рассева типичных колоний на косой агар LB с глюкозой и биотином на 48-72 часа. Пробирки засевали в ламинарном шкафу микробиологической петлей из расчета две петли на колбу. содержащие 0,003 л стерильной ферментационной среды. Культуру с косого агара пересевали для выращивания посевного материала в жидкой питательной среде LB в шейкере-инкубаторе при скорости вращения 240 об/мин, температуре 30 0С в течение 24 ч. [1].
Готовый инокулят с оптической плотностью не менее 0,2 ед., при отсутствии посторонней микрофлоры и соответствии морфологических характеристик, использовали на следующей стадии эксперимента.
Приготовление среды.
Для определения влияния различных биологически активных веществ на рост микроорганизмов и синтез лизина бактерии выращивали на жидкой питательной среде LB, которую готовили по следующей методике:
1. В колбу вместимостью 1,0 л, наливали мерным цилиндром (0,700±0,001) л очищенной воды. Взвешивали на весах (0,0100±0,0001) кг триптона, (0,0050±0,0001) кг дрожжевого экстракта, (0,0050±0,0001) кг хлористого натрия и добавляли в колбу. Перемешивали с помощью магнитной мешалки, доливали очищенную воду до объема (1,00±0,01) л, доводили pH раствора (при необходимости) до (7,1±0,1) раствором 40 % гидроокиси натрия и еще раз перемешивали. Колбу закрывали ватно-марлевой пробкой и автоклавировали при температуре (116±2) оС, давлении 0,08 МПа в течение (40±1) мин.
Полученный посевной материал и жидкую питательную среду разливали стерильно в ламинарном шкафу в колбы по 25 мл стерильной ферментационной среды.
Во все образцы вносили по 1 мл глюкозы и 0,1 мл тиамина. Для оценки влияния витаминов и БАВ на рост C. glutamicum B-11167 в жидкую питательную среду добавляли по 1 мл растворов: 1 вариант - 4(индолил-3ил) масляной кислоты (ИМК) в концентрации 0,0004 мг/мл; 2 вариант – β-индолил-3-уксусной кислоты (ИУК) в концентрации 0,00005 мг/мл и по 0,5 мл: 3 вариант - арахидоновой кислоты (АК) с концентрацией раствора 0,0003; 4 вариант – раствор рибофлавина фосфата натрия (витамин В2) в концентрации 0,2 мг/мл. В качестве контроля использовали среду без добавления БАВ.
Культивирование в колбах вели в шейкер-инкубаторе, при скорости вращения 240 об/мин, температуре 300С. Эксперимент проводили в трехкратной повторности. Экспозиция составляла 20 и 40 часов роста культуры. В ходе эксперимента проводили контроль морфологических признаков роста бактерий на жидкой среде по характерной ярко-желтой окраске, тем самым, определяя чистоту культуры, т.е. отсутствие посторонней микрофлоры. Также фиксировали динамику роста бактерий определением оптической плотности среды (спектрофотометр при Siemens MicroScan Turbidity Meter, толщина кюветы 1 см) исходную - в момент посева и через 20 и 40 часов.
Результаты
Динамика роста культуры бактерий показала более активное размножение клеток во всех вариантах в первые 20 часов после посева культуры, далее рост несколько замедлялся, что видно на графике (рис. 1) и связано с расходом глюкозы, так как дополнительно в ходе эксперимента глюкоза не добавлялась.
В ходе эксперимента было выявлено положительное влияние добавления витамина В2 на рост C. glutamicum B-11167, причем в первые 20 часов роста после посева интенсивность была на 8 % выше, чем в контроле.
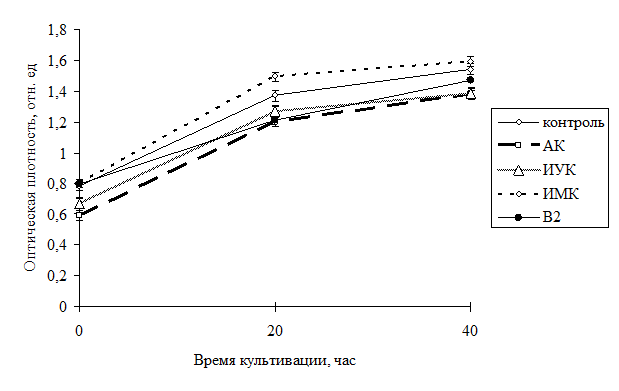
Рис 1. Динамика роста культуры С. glutamicum B-11167 в жидкой среде при добавлении различных БАВ и витамина В2.
При последующем росте (до 40 часов) превышение снизилось до 4 % относительно контроля, но по-прежнему оставалось выше контрольных данных.
Важным показателем является подбор более эффективной концентрации вещества, которое стимулирует процесс роста и деления клеток или биосинтеза веществ.
Так при используемой нами концентрации витамина В2 0,2 мг/мл наблюдался существенный рост культуры, что проявлялось в увеличении оптической плотности. При уменьшении концентрации действующего вещества до 0,08 мг/мл наблюдалось также увеличение биомассы культуры по сравнению с контрольными данными, однако, рост был менее выражен и оптическая плотность превышала контроль на 3 %, при уменьшении концентрации рибофлавина в среде до 0,04 мг/мл оптическая плотность соответствовала контрольным данным. В данном случае данные контроля соответствовали варианту с добавлением витамина В2.
Исследование влияния на рост и размножение культуры C. glutamicum в жидкой питательной среде органических кислот в наших исследованиях не дало положительного эффекта.
В вариантах с производными индолила ИУК и ИМК динамика роста культуры была близка к контрольным данным или несколько ниже. В варианте с ИУК было отмечено подавление роста бактерий, ниже контрольных значений на 5 % в первые 20 часов роста культуры, и на 2 % - в последующее время экспозиции.
Интенсивность роста бактерий при внесении в среду ИМК оказалась немного выше по сравнению с ИУК. При одинаковых условиях культивирования штаммы показали как разную динамику роста, так и нарастание биомассы.
Наибольшее подавление роста культуры было отмечено при добавлении АК, при этом уменьшение скорости размножения на протяжении всего времени экспозиции составило 8% от контрольных данных.
Таким образом, проведенные исследования показали, что повышение роста культуры бактерий вызывает добавление в жидкую питательную среду витамина В2. Динамика роста культуры бактерий с добавлением витамина В2 в концентрации 0,2 мг/мл показывает повышение оптической плотности на 8 %, и следовательно может дать повышение продуктивности по лизину. При концентрации витамина В2 до 0,08 мг/мл наблюдался менее выраженный стимулирующий эффект на культуру, что проявилось в снижении оптической плотности до 3 %, по сравнению с контролем.
Экспериментально определена наименьшая концентрация витамина В2 которая не оказывает стимулирующего влияния на рост и деление клеток C. glutamicum. Она составляет 0,04 мг/мл действующего вещества.
Влияние ИУК, ИМК и АК в использованных концентрациях, оказывала угнетающий эффект на рост бактерий или нейтральный, как в варианте с ИМК. Взятые нами концентрации этих органических кислот, производных индолила оказались не эффективными для стимулирования физиологических процессов и интенсивности деления в клетках культуры. Возможно, при других их концентрациях может проявиться положительный эффект на рост и деление культуры.
Полученные в ходе исследования новые данные показывают влияние биологически активных веществ на физиологические процессы роста и размножения культуры бактерий С. glutamicum B-11167 при выращивании на жидкой среде LB. Кроме того они являются показателем перспективности дальнейших исследований влияния ИУК, ИМК и витамина В2 в ферментере при глубинной ферментации на эффективность биосинтеза лизина.
Рецензенты:
Землянский О.А., д.м.н., профессор, профессор кафедры медико-профилактических дисциплин НИУ Белгородского государственного университета Министерства образования и науки РФ, г. Белгород.
Шапошников А.А., д.б.н., профессор, зав. кафедрой биохимии и фармакологии НИУ Белгородского государственного университета Министерства образования и науки РФ. г.Белгород.



