Введение
Каротидная эндартерэктомия (КЭАЭ) является в настоящее время единственным эффективным способом предупреждения ишемического инсульта (ИИ) при атеросклеротических стенозах внутренних сонных артерий (ВСА); при длительных сроках наблюдения она во много раз эффективнее, чем консервативное лечение, снижает риск развития инсульта [1-4; 6]. Преимущество использования заплаты для закрытия дефекта артериотомии подтверждено лучшими результатами, особенно в отдаленном периоде наблюдения [3; 5; 7; 8]. Последние европейские и национальные рекомендации однозначно говорят о необходимости ее применения. Однако там же сказано, что выбор материала для заплаты определяется опытом и предпочтениями оперирующего хирурга, а также традициями и опытом учреждения. При этом в литературе отсутствуют четкие показания к применению определенного вида пластического материала, приводимые исследования часто прослеживают результаты на непродолжительный отрезок времени. Мало работ, сравнительно изучающих на большом клиническом материале исходы КЭАЭ с пластикой заплатой из политетрафторэтилена (ПТФЭ) – достаточно распространенного синтетического материала в сердечно-сосудистой хирургии и фрагмента большой подкожной вены (БПВ) в отдаленном периоде.
Цель исследования
На основе анализа ближайших и отдаленных результатов КЭАЭ с заплатой из ПТФЭ и аутовены (БПВ) определить приоритетность использования определенного материала заплаты для пластики артериотомического отверстия сонных артерий (СА).
Материал и методы
Основой данного исследования явились результаты 196 КЭАЭ с заплатой у 192 пациентов. Все операции выполнены по поводу атеросклеротического поражения СА. В соответствии с видом материала заплаты больные разделены на две группы. Первую составили 82 пациента, у которых использовали фрагмент БПВ нижней конечности при 83 КЭАЭ. Следует отметить, что БПВ выделялась в проксимальной части бедра, участок вены с голени не использовался, несмотря на лучшую ее доступность в данном месте. Причина этого в том, что случаи более частого аневризматического расширения и разрыва заплаты из БПВ встречались при ее заборе с голени [8]. Во вторую группу вошли 110 человек, им выполнено 113 КЭАЭ с пластикой заплатой из микропористого ПТФЭ. Анализ сравниваемых групп начинался с оценки возраста и пола. По гендерному составу в обеих группах преобладали мужчины: в основной группе – 72,0%, в группе сравнения – 93,7%. Средний возраст составил 57,6±1,7 лет в основной группе, 59,5±2,4 лет в группе сравнения, р>0,05. Распределение больных по возрасту значимо не различается, р>0,05.
Оценивалась сопутствующая патология больных, из которой акцентировали внимание на частоте артериальной гипертензии, ишемической болезни сердца (ИБС) и атеросклеротического поражения терминального отдела аорты и артерий нижних конечностей, случаях реваскуляризации миокарда и артерий нижних конечностей, сахарного диабета 2 типа. Сравниваемые группы статистически однородны по указанной патологии (таблица 1).
Таблица 1
Частота сопутствующей патологии
|
Наименование показателя |
Группа 1 (n=82) |
Группа 2 (n=110) |
Эмпирические значения коэф. Фишера, φэмп |
Значимость различий |
|
ИБС, в т.ч. |
57 (69,5%) |
84 (76,4%) |
1,4 |
P>0,05 |
|
стенокардия напряжения I-II ФК |
50 (61,0%) |
65 (59,0%) |
0,06 |
P>0,05 |
|
стенокардия напряжения III-IV ФК |
7 (8,5%) |
19 (17,2%) |
1,6 |
P>0,05 |
|
Артериальная гипертензия |
78 (95,1%) |
102 (91,9%) |
0,8 |
P>0,05 |
|
Предшествующая реваскуляризация миокарда |
8 (9,8%) |
11 (9,9%) |
0,06 |
P>0,05 |
|
Атеросклероз аорты и артерий нижних конечностей |
46 (56,1%) |
68 (61,8%) |
0,7 |
P>0,05 |
|
Предшествующая реваскуляризация н/конечностей |
15 (18,3%) |
32 (29,1%) |
1,3 |
P>0,05 |
|
Фибрилляция предсердий |
3 (3,7%) |
5 (4,4%) |
0,1 |
P>0,05 |
|
Инфаркт миокарда в анамнезе |
23 (28,0%) |
27 (24,5%) |
0,5 |
P>0,05 |
|
Предшествующая реваскуляризация миокарда |
8 (9,9%) |
11 (9,8%) |
0,06 |
P>0,05 |
|
Дислипидемия |
25 (30,5%) |
38 (33,6%) |
0,4 |
P>0,05 |
|
Сахарный диабет 2 типа |
8 (9,7%) |
14 (12,7%) |
0,7 |
P>0,05 |
|
Язвенная болезнь желудка |
8 (9,8%) |
13 (11,5%) |
0,4 |
P>0,05 |
|
Хроническая обструктивная болезнь легких |
5 (6,1%) |
10 (8,8%) |
0,7 |
P>0,05 |
|
Мочекаменная болезнь |
2 (2,4%) |
5 (4,4%) |
0,7 |
P>0,05 |
|
Желчнокаменная болезнь |
- |
3 (2,7%) |
0,6 |
P>0,05 |
Для неврологической характеристики пациентов использовали классификацию хронической сосудисто-мозговой недостаточности (ХСМН) по А.В. Покровскому, в которой выделяют четыре степени (таблица 2).
Таблица 2
Неврологическая характеристика пациентов
|
Степень ХСМН |
Группа 1 (n=82) |
Группа 2 (n=110) |
Эмпирические значения коэф. Фишера, φэмп |
Значимость различий |
|
I – асимптомная |
18 (22,0%) |
39 (35,3%) |
2,0 |
P<0,05 |
|
II – преходящие нарушения мозгового кровообращения |
26 (31,7%) |
14 (12,8%) |
3,2 |
P<0,01 |
|
III – дисциркуляторная энцефалопатия |
8 (9,8%) |
33 (30,0%) |
3,6 |
P<0,01 |
|
IV – инсульт в анамнезе |
30 (36,5%) |
24 (21,9%) |
2,1 |
P<0,05 |
Так, пациентов с 2 и 4 степенью ХСМН (симптомные пациенты) было достоверно больше в первой группе, а асимптомных – во второй.
Для оценки степени поражения СА применяли инструментальные методы диагностики: ультразвуковое дуплексное сканирование (УЗДС), включая цветовое доплеровское картирование и ангиографическое исследование. УЗДС выполнялось всем пациентам как скрининговый метод, обладающий высокой чувствительностью и специфичностью, но являющийся достаточно субъективным. УЗ-диагностика осуществлялась на аппаратах Vivid 5 и Vivid 7 производства фирмы General Electric (США). Степень стеноза оценивали по методике, рекомендованной исследованием NASCET. В случае ипсилатеральной ВСА статистически значимых различий по степени стеноза не отмечено (р>0,05), однако окклюзия контралатеральной ВСА чаще встречалась у больных второй группы (р<0,05). Полученные данные отражены в таблице 3.
Таблица 3
Выраженность атеросклеротического поражения СА
|
Степень стеноза |
Группа 1 (n=82) |
Группа 2( n=110) |
Эмпирические значения коэф. Фишера, φэмп |
Значимость различий |
|
60-70% |
20 (24,3%) |
32 (29,0%) |
1,0 |
P>0,05 |
|
70-80% |
44 (53,6%) |
48 (43,6%) |
1,4 |
P>0,05 |
|
80-90% |
12 (14,6%) |
18 (16,3%) |
0,5 |
P>0,05 |
|
>90% |
6 (7,3%) |
11 (10,0%) |
0,6 |
P>0,05 |
|
Нестабильность бляшки |
30 (36,5%) |
32 (29,0%) |
1,1 |
P>0,05 |
|
Окклюзия контралатеральной ВСА |
6 (7,3%) |
16 (14,5%) |
1,7 |
P<0,05 |
Важным этапом исследования явился анализ отдаленных результатов КЭАЭ. Сроки отдаленного наблюдения первой группы пациентов составили в среднем 43±11,9 месяца, второй группы – 38±9,5 месяца.
Статистический анализ результатов исследования проводили с использованием программного обеспечения STATISTICA 6.0, а также пакета Microsoft Excel 5.0.
Результаты
Непосредственные результаты оценивались до момента выписки пациента из стационара. Периоперационный ИИ развился в 3,6% случаев после КЭАЭ с заплатой из аутовены и в 4,5% – после КЭАЭ с ПТФЭ, из них в первой группе летальным он оказался у 1,2% пациентов, нелетальным – 2,4%. Во второй группе в 1,8% и 2,7% случаев соответственно. Статистически различия не достоверны (таблица 4).
Таблица 4
Непосредственные неврологические исходы КЭАЭ с заплатой
|
Последствия |
Группа 1 (n=82) |
Группа 2 (n=110) |
Эмпирические значения коэф. Фишера, φэмп |
Значимость различий |
|
Летальный ИИ |
1 (1,2%) |
2 (1,8%) |
0,3 |
P>0,05 |
|
Нелетальный ИИ |
2 (2,4%) |
3 (2,7%) |
0,2 |
P>0,05 |
|
Транзиторные ишемические атаки |
1 (1,2%) |
3 (2,7%) |
0,8 |
P>0,05 |
|
Повреждение черепных нервов |
4 (4,8%) |
9 (8,1%) |
1,1 |
P>0,05 |
Больным с нелетальным инсультом выполнялось КТ головного мозга, они получали необходимую нейротропную, сосудистоактивную терапию и были выписаны с регрессом очаговой неврологической симптоматики.
Основным этапом исследования явился анализ отдаленных результатов хирургического лечения. Для диагностики состояния оперированных СА в отдаленном наблюдении применяли те же методы, что и в предоперационном периоде. Состояние СА после КЭАЭ удалось оценить у 75 человек первой группы и 96 – второй. Гемодинамически значимым считали рестеноз более 60%. У одного пациента (1,3%) после КЭАЭ с заплатой из аутовены развился рестеноз до 80%. От предложенного повторного вмешательства больной отказался и находится под нашим наблюдением. В группе, где использовались заплаты из ПТФЭ, рестеноз зарегистирирован у 10 человек (10,4%), причем в 4,1% наблюдали уже окклюзию СА. Различия статистически достоверны при р<0,01. У двух пациентов первой группы диагностировали дилатацию аутовенозной заплаты, что можно объяснить наличием у них артериальной гипертензии с трудно коррегируемым течением. Случаев аневризматического расширения, разрывов заплат не было (таблица 5).
Таблица 5
Состояние сонных артерий в отдаленном периоде
|
Рестенозы |
Группа 1 (n=75) |
Группа 2 (n=96) |
Эмпирические значения коэф. Фишера, φэмп |
Значимость различий |
|
60-70% |
– |
3 (3,1%) |
2,3 |
P<0,05 |
|
70-80% |
1 (1,3%) |
2 (2,0%) |
0,4 |
P>0,05 |
|
80-90% |
– |
1 (1,0%) |
1,3 |
P>0,05 |
|
Окклюзия оперированной СА |
– |
4 (4,1%) |
2,6 |
P<0,01 |
|
Всего |
1 (1,3%) |
10 (10,4%) |
2,7 |
P<0,01 |
|
Дилатация заплаты в области пластики |
2 (2,6%) |
– |
2,0 |
P<0,05 |
В отдаленном периоде в первой группе погибли 16 человек (19,5%). ИИ послужил причиной смерти трех пациентов (на стороне КЭАЭ – 1 (1,2%), в контралатеральной области – 2 (2,4%)), инфаркт миокарда – 7 человек (8,4%), онкологические заболевания – 4 (4,8%), пневмония – 1 (1,2%), геморрагический инсульт – 1 (1,2%). Помимо трех вышеупомянутых летальных ИИ, у одного человека произошел нелетальный инсульт в контралатеральной зоне КЭАЭ (1,2%). Следует подчеркнуть, что в отдаленном периоде не зарегистрировано нефатальных ИИ на стороне КЭАЭ с пластикой заплатой из аутовены. Коронарографии подверглись 15 больных (18,3%). Из этого числа в восьми случаях (9,8%) выполнена прямая реваскуляризация миокарда, в четырех (4,9%) – коронарная ангиопластика со стентированием. Реконструктивные операции на терминальном отделе аорты и артериях нижних конечностей осуществлены 9 пациентам (11,0%) (аорто-бифеморальное шунтирование – 3 человека (3,7%), аорто-бедренное шунтирование – 1 (1,2%), пластика бедренно-подколенного сегмента – 7 (8,5%).
После КЭАЭ с заплатой из ПТФЭ умерли 24 человека (21,8%). Летальный ИИ на стороне КЭАЭ развился у 3 больных (2,7%), состояние оперированной СА на момент смерти неизвестно. От инсульта в контралатеральном сосудистом бассейне погибли трое (2,7%). Нелетальные неврологические осложнения: ИИ на стороне операции – 4 пациента (3,5%), в противоположной области – 5 человек (4,4%). Реваскуляризации миокарда подверглись 10 человек (9,1%): в четырех случаях (3,6%) выполнено аорто-коронарное шунтирование, в шести остальных – стентирование коронарных артерий (5,5%). Операции на аорто-подвздошной зоне выполнены семи больным (6,4%), бедренно-подколенной – трем (2,7%).
Таким образом, летальность от ИИ на стороне операции в отдаленном периоде была статистически сопоставимой: 1,2% и 2,7% в первой и второй группах соответственно (р>0,05) (рис. 1).
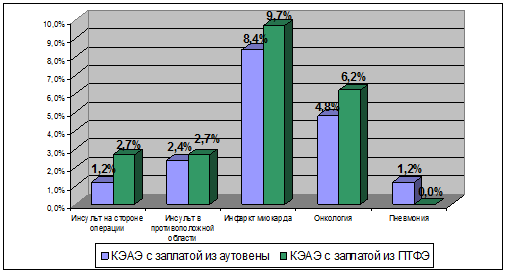
Примечание: p>0,05
Рис. 1. Структура летальных исходов в отдаленном периоде
Однако по частоте нелетальных ИИ на стороне КЭАЭ различие достоверно: при использовании заплаты из ПТФЭ инсульт регистрировался чаще, чем после КЭАЭ с аутовеной (3,5% и 0%, p<0,01) (таблица 6).
Таблица 6
Частота нелетального инсульта в отдаленном периоде
|
Показатель |
Группа 1 (n=82) |
Группа 2 (n=110) |
Эмпирические значения коэф. Фишера, φэмп |
Значимость различий |
|
Нелетальный инсульт на стороне операции |
0 |
4 (3,5%) |
2,5 |
P<0,01 |
|
Нелетальный инсульт в противоположной зоне |
1 (1,2%) |
5 (4,4%) |
1,4 |
P>0,05 |
Выводы
1. В ближайшем послеоперационном периоде вид материала заплаты достоверно не влияет на исходы КЭАЭ: частота ИИ в первой группе – 3,6%, во второй – 4,5% (р>0,05).
2. КЭАЭ с пластикой заплатой из аутовены и ПТФЭ демонстрирует хорошие стабильные результаты в отдаленном послеоперационном периоде: летальность от ИИ на стороне операции – 1,2% (аутовена), 2,7% (ПТФЭ), (р>0,05).
3. Вид материала заплаты оказал достоверное влияние на частоту развития нелетального инсульта в зоне операции в отдаленном периоде: при использовании аутовены данного осложнения не наблюдали, применение ПТФЭ вызвало формирование гемодинамически значимого рестеноза СА в 10,4% наблюдений, при этом 4 человека (3,5%) перенесли ИИ в ипсилатеральном сосудистом бассейне.
Таким образом, если возможно, предпочтительнее использовать аутовену из БПВ в качестве заплаты во время КЭАЭ. В случаях когда БПВ нельзя применять для этих целей (венэктомия в анамнезе, варикозное расширение вен нижних конечностей, изменение кожного покрова в месте забора в силу ряда причин, а также потенциальная потребность в БПВ для реваскуляризации нижних конечностей), можно выполнить КЭАЭ с пластикой ПТФЭ-заплатой.
Рецензенты:
Владимирский В.В., д.м.н., заведующий отделением сосудистой хирургии № 1 Государственного бюджетного учреждения здравоохранения «Челябинская областная клиническая больница», г.Челябинск.
Андриевских И.А., д.м.н., профессор, заведующий кафедрой госпитальной хирургии ГБОУ ВПО «Южно-Уральский государственный медицинский университет Минздрава России», г.Челябинск.



