Введение
Анилокаин [2-броманилид-З-диэтиламинопропановой кислоты гидрохлорид] – местный анестетик из группы замещенных амидов, синтезированный на кафедре органической химии Пермской государственной фармацевтической академии (ПГФА). Как лекарственное средство анилокаин зарегистрирован (рег. номер 97/292/2) приказом Минздрава РФ № 292 от 3.10.1997 года и внесен в Государственный реестр лекарственных средств России. Он обладает выраженной активностью при всех видах анестезии, превосходя по эффективности тримекаин. Анилокаин в 1,5 раза менее токсичен, чем лидокаин, характеризуется отсутствием отрицательного влияния на дыхание, кровообращение и ЦНС. Ценным свойством анилокаина является выраженное поверхностноанестезирующее действие, а также наличие противовоспалительной и умеренной антимикробной активности, чем он выгодно отличается от применяемых в медицинской практике других местных анестетиков [5,9]. Кроме того, исследования по изучению антиаритмического действия препарата показали его эффективность при предсердных, желудочковых и смешанных аритмиях. На модели нейрогенной фибрилляции предсердий анилокаин превосходит лидокаин по выраженности и продолжительности антиаритмического влияния [6]. На основе анилокаина разработаны и доведены до медицинского применения ряд лекарственных форм: 1% и 2% инъекционные растворы, 5% раствор для наружного применения, мазь «Аникол», перевязочные средства длительного действия. На кафедре фармацевтической технологии Пермской фармакадемии разработаны и другие лекарственные формы с перспективой внедрения их в медицинскую и ветеринарную практику (суппозитории, пленки лекарственные, обезболиваюший гель, аэрозоль и т.д.) [4].
Важной составляющей качества фармацевтической субстанции является чистота. Утвержденная в 1997 г. временная фармакопейная статья на субстанцию анилокаина предусматривает определение посторонних примесей методом тонкослойной хроматографии (ТСХ) [1]. Однако современные мировые фармакопеи для оценки примесей рекомендует замену метода ТСХ на более специфичный и точный метод высокоэффективной жидкостной хроматографии (ВЭЖХ) [2]. В связи с возрастающими требованиями к качеству фармацевтических субстанций целью настоящей работы явилась разработка условий определения посторонних примесей в субстанции анилокаина методом ВЭЖХ, а также проведение биологических испытаний для оценки безопасности примесей. Данные исследования необходимы на этапе разработки и валидации методики определения посторонних примесей при включении её в проект фармакопейной статьи на субстанцию.
Материалы и методы исследования
Разработка условий хроматографического определения посторонних примесей проводилась на жидкостном хроматографе Shimadzu LC-20 Prominence (Япония), оснащенном диодноматричным детектором (SPD-M20A). Хроматографическая колонка – Zorbax SB-C18 (4,6 мм × 250 мм, 5 мкм). Для приготовления подвижных фаз, а также для приготовления испытуемых и стандартных растворов были использованы реактивы квалификации «для ВЭЖХ».
Токсикологические исследования проведены в опытах на белых нелинейных мышах обоего пола массой 24-30 г, содержащихся на обычном рационе вивария. Определение средней летальной дозы (ЛД50) проводилось в соответствии с Руководством по проведению доклинических исследований лекарственных средств [8]. Исследуемые соединения вводили внутрибрюшинно в виде взвеси в 2% крахмальной слизи в возрастающих дозах. В каждой серии использовались 8 животных. Результаты обрабатывали по В.В. Прозоровскому с вычислением средней смертельной дозы при Р=0,05 [7].
В работе использованы серии субстанции анилокаина, синтезированные в ПГФА в период с 1988 по 2012 г, 2-броманилин (Aldrich), N-(2-бромфенил)акриламид (синтез вещества осуществлен по методике [3], хроматографическая чистота не менее 99%).
Результаты исследований и их обсуждение
Ранее проведенные исследования показали, что специфическими примесями в субстанции анилокаина могут являться N-(2-бромфенил)акриламид (продукт деструкции анилокаина в результате реакции ß-элиминирования) и 2-броманилин (как исходный продукт при синтезе и как продукт гидролитического расщепления анилокаина) (рис.1).

Рис. 1. Структура специфических примесей анилокаина
N-(2-бромфенил)акриламид (I) и 2-броманилин (II))
Подходы к определению и нормированию примесей зависят от токсичности примеси, ее фармакологической активности, длительности приема препарата и максимальной суточной дозы [2].
Установлено, что средняя летальная доза 2-броманилина составляет 355,0 (310,0 ÷ 400,0) мг/кг массы животного, что позволяет отнести данное соединение к умеренно токсичным. Средняя летальная доза N-(2-бромфенил)акриламида составила 650,0 (530,0 ÷ 800,0) мг/кг массы животного. Это также указывает на умеренную токсичность соединения.
На этапе выбора оптимальных условий разделения исследуемых веществ в режиме обращено-фазной жидкостной хроматографии нами апробированы элюенты на основе водно-ацетонитрильных смесей. В качестве модификаторов использовались фосфатные буферы с различными значениями рН.
В качестве аналитической выбрана длина волны 210 нм, поскольку в данной области спектра изучаемые вещества характеризуются максимальным поглощением (рис.2), что в итоге обеспечит наибольшую чувствительность методики при определении примесей.
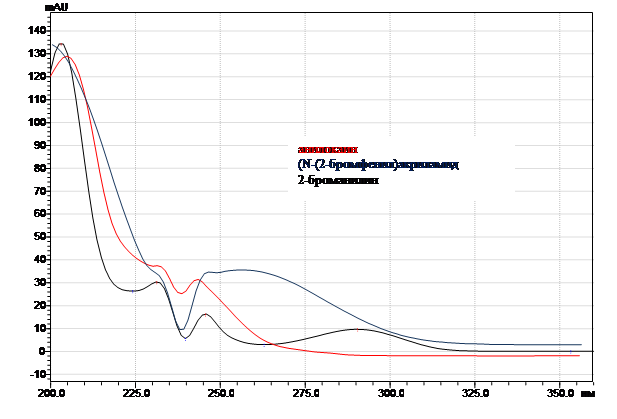
Рис.2. УФ-спектры исследуемых веществ
Европейская фармакопея для анализа субстанции лидокаина гидрохлорида (структурного аналога анилокаина) методом ВЭЖХ на наличие органических примесей рекомендует в качестве элюента смесь ацетонитрила и фосфатного буфера с рН 8 [10]. При использовании этой подвижной фазы в анализе модельной смеси анилокаина и его специфических примесей исследуемые вещества элюировались в следующем порядке: N-(2-бромфенил)акриламид со временем удерживания 8,8 мин., 2-броманилин – 11,3 мин. и анилокаин – 12,1 мин. Однако данные условия не позволили эффективно разделить анилокаин и 2-броманилин (коэффициент разделения пиков составил менее 2). Изменение соотношения компонентов в элюенте качественно не изменило ситуацию. Замена в составе подвижной фазы фосфатного буфера с рН 8 на фосфатные буферы с рН 5 и рН 3 привело к уменьшению удерживания анилокаина в колонке (время удерживания – 4,1 и 3,2 мин соответственно) и отличному разделению всех компонентов пробы. Времена удерживания пиков N-(2-бромфенил)акриламида и 2-броманилина не изменились. Пример хроматограммы модельной смеси приведен на рис.3 (концентрация компонентов 200 мкг/мл).
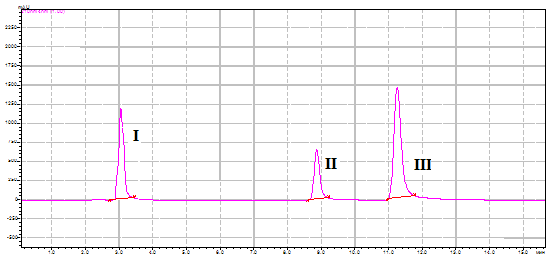
Рис.3. Хроматограмма модельной смеси анилокаина (I),
N-(2-бромфенил)акриламида (II) и 2-броманилина (III)
(элюент: ацетонитрил – фосфатный буфер с рН3 (40: 60), скорость потока: 1мл/мин.)
Хроматографическое исследование концентрированных растворов субстанций анилокаина (4000 мкг/мл) показало, что при использовании подвижной фазы на основе ацетонитрила и фосфатного буфера с рН 3 на хроматограммах обнаруживалась дополнительная неидентифицированная примесь с относительным временем удерживания по анилокаину около 1,9 (абсолютное время удерживания 6,2 мин.) (рис.4).
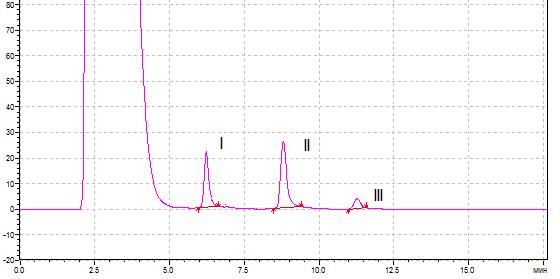
Рис. 4. Хроматограмма модельной смеси анилокаина (4000 мкг/мл), N-(2-бромфенил)акриламида (II) и 2-броманилина (III), I – неидентифицированная примесь
При применении элюентов с буферными растворами рН 5 и рН 8 примесь не обнаруживалась. Можно предположить, что в данных условиях примесь элюируется совместно с анилокаином.
Таким образом, проведенные исследования показали, что наиболее оптимальное разделение анилокаина и его возможных примесей (как идентифицированных, так и неидентифицированных) наблюдается в изократическом режиме ВЭЖХ при использовании элюента ацетонитрил – фосфатный буфер (рН 3). Скорость потока подвижной фазы – 1 мл/мин, длина волны детектирования – 210 нм. Время регистрации хроматограммы – 20 минут.
Данные условия были апробированы при анализе нескольких серийных образцов субстанции анилокаина (20.05.2012; 17.10.2011; 15.04.2008; 10.02.88). Для определения возможных примесей 0,1 г субстанции анилокаина помещали в мерную колбу вместимостью 25 мл и доводили до метки метанолом (испытуемый раствор). 20 мкл раствора вводили в инжектор хроматографа. Идентификацию и количественное определение идентифицированных примесей осуществляли с использованием стандартных растворов N-(2-бромфенил)акриламида и 2-броманилина. Для оценки содержания неидентифицированных примесей использовали разведения испытуемой субстанции. Полученные результаты представлены в таблице 1.
Таблица 1 – Результаты анализа серийных образцов анилокаина
|
Серия |
Содержание идентифицированных примесей (%) |
Содержание неидентифицированной примеси с относительным временем удерживания 1,9 |
Общее содержание примесей |
|
|
N-(2-бромфенил)акриламид |
2-броманилин |
|||
|
20.05.2012 |
0,0056% |
0,0010% |
Не более 0,2% |
Не более 0,5% |
|
17.10.2011 |
0,0026% |
0,0013% |
Не более 0,2% |
Не более 0,5% |
|
15.04.2008 |
0,0009% |
0,00025% |
Не более 0,2% |
Не более 0,5% |
|
10.02.88 |
0,0015% |
0,0047% |
Не более 0,2% |
Не более 0,5% |
На основании полученных данных предложено нормировать содержание в субстанции анилокаина: 2-броманилина – не более 0,01%; N-(2-бромфенил)акриламида – не более 0,1%; единичной неидентифицированной примеси с относительным временем удерживания 1,9 – не более 0,2%; любой другой примеси – не более 0,1%; общее содержание примесей – не более 0,5%.
Выводы
1. Для оценки безопасности идентифицированных специфических примесей в субстанции анилокаина (2-броманилина и N-(2-бромфенил)акриламида) установлены их величины ЛД50.
2. Определены условия определения посторонних примесей в субстанции анилокаина методом высокоэффективной жидкостной хроматографии.
3. На основании анализа нескольких серий субстанций анилокаина в разработанных хроматографических условиях проведено предварительное нормирование содержания посторонних примесей.
Рецензенты:
Вихарева Е.В., д.фарм.н., доцент, заведующий кафедрой аналитической химии ГБОУ ВПО ПГФА Минздрава России, г. Пермь.
Сыропятов Б.Я,, д.м.н., профессор, заведующий кафедрой физиологии с основами анатомии ГБОУ ВПО ПГФА Минздрава России, г. Пермь.



