Введение
Окислительное растворение металлов в жидкой фазе сопровождается образованием координационных соединений и протекает в присутствии окислителей. Простейшая схема этого синтеза может быть следующей [2]:
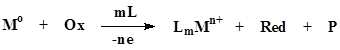
где М - металл, Ох - окислитель, L - комплексообразователь (лиганд), Red – восстановленная форма окислителя, Р - продукты взаимодействия компонентов среды.
Окислителями в данном случае могут выступать как галогены, так и галогеноводороды, и галогензамещенные углеводороды. Растворителями, также как и основаниями, в данных синтезах, являются О-, N-, S-доноры, которые входят в состав образующихся комплексов в качестве лигандов. Наиболее часто используются такие лиганды, как ацетонитрил, бензонитрил, диметилформамид, диметилацетамид, диметилсульфоксид, жирные, ароматические и гетероциклические амины и их N-оксиды [5,8].
Наиболее значимое преимущество такого способа окислительного растворения никеля является одностадийность, а также возможность вести направленное получение комплексов с различными составами и степенью окисления металлов.
В настоящей работе проводилось изучение влияния растворителя на процесс окислительного растворения никеля в системе бензилгалогенид – растворитель - кислород с целью установления зависимости скорости реакции от различных свойств растворителя.
Экспериментальная часть
Анализ продуктов реакции и количественное определение примесей в исходных соединениях методом ГЖХ (хроматограф "Цвет–800") и ионной хроматографии (хроматограф «Цвет 3006»), по методикам представленным в работе [1]. Органические продукты реакции выделяли с помощью препаративной жидкостной хроматографии на хроматографе "Цвет-304", снабженном УФ-детектором и стальной колонкой (l = 2,5 м, d = 4 мм); неподвижная фаза – Silasorb 600 (Chemapol, Чехия, размер частиц 15-25 мкм), элюент – смесь гексан : диэтиловый эфир 5:1. Анализ продуктов реакций методом хромато-масс-спектрометрии проводили на приборе фирмы «Hewlett Packard» (США) (масс-детектор НР-5972, хроматограф НР-5890) по описанной ранее методике [7]. Количественный анализ примесей в никеле проводили после растворения образцов металла в HNO3 и нейтрализации полученного раствора 25%-ным раствором аммиака методом атомно-абсорбционной спектрометрии на приборе GBC-908 АА (Австралия). Измерение удельного вращения плоскости поляризованного света проводили на автоматическом поляриметре ВНИЭКИпродмаш А-1 ЕПО (Россия, σ = 0,01˚) в кюветах различной толщины.
Никелевую проволоку (фирмы Goodfellow Corporation, США; марки NI005106, d = 0,025мм; l = 10 мм, содержание никеля: 99,9804%) применяли для определения кинетических параметров окислительного растворения никеля в системе бензилбромид –растворитель 1-25 – кислород. Никелевую проволоку (фирмы Goodfellow Corporation, США; марки NI005121, d = 0,25 мм; l = 80 мм, содержание никеля: 99,9936 %) применяли для определения кинетических параметров окислительного растворения никеля в системе бензилхлорид –растворитель 1-25 – кислород. Перед применением проволоку выдерживали в течение 5-10 секунд в 20%-ном растворе серной кислоты, промывали водой, ацетоном, а затем соответствующим растворителем.
В качестве объектов для исследования были использованы бензилбромид и бензилхлорид. Бензилбромид (Aldrich) и бензилхлорид (марка «ЧДА», РЕАХИМ, Россия) сушили плавленым CaCl2 и перегоняли. Бензилбромид Т. кип. 83,5-84оС (32 мм рт. ст.), nD20 1.4380. Бензилхлорид Т. кип. 63,5-64оС (12 мм рт. ст.), nD20 1.5386.
Все органические соединения были получены из коммерческих источников. Бензилгалогениды и все растворители освобождали от растворенных газов путем многократного замораживания и размораживания при пониженном давлении и хранили в ампулах без доступа воздуха.
Дегалогенирования бензилгалогенидов никелем в диполярной апротонном растворителе в присутствии кислорода проводили по следующей методике: к 0,02 моль порошка никеля прилили 20 мл диполярного апротонного растворителя и 0,1 моль бензилгалогенида. Реакцию проводили в присутствии сухого воздуха при 70°С. После растворения никеля реакционную смесь обработали 20 мл сухого диэтилового эфира. Выпавшие кристаллы комплексного соединения никеля (II) отделяли, промывали гексаном и сушили в вакууме.
Исследование кинетики процессов взаимодействия никеля с бензилгалогенидом в растворителе в присутствии кислорода проводили резистометрическим методом концентрация растворителя 1-25 составила 2 моль×л-1, а исходная концентрация бензилгалогенидов была равна 0,5 моль×л-1. Скорость вращения мешалки составляла 2500 об/мин. Начиная с 2000 об/мин скорость растворения никеля в изучаемых средах не зависела от скорости перемешивания, что указывало на кинетический режим исследования процесса.
Обсуждение результатов
Процесс дегалогенирования бензилгалогенидов никелем в диполярном апротонном растворителе в присутствии кислорода протекает по следующей схеме:
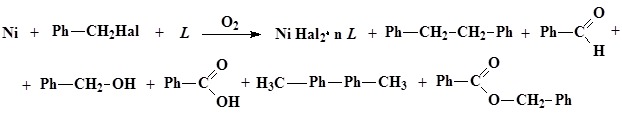
где Hal = Cl, Br, L = ДМФА, ДМАА, ДМСО, ГМФТА; n = 2, 3, 6.
Анализ продуктов методом хромато-масс-спектрометрии показал наличие в продуктах реакции 1,2-дифенилэтана и следовых количеств 4,4'-дитолила. Кроме того, были выделены бензальдегид и бензиловый спирт. Методом ионной хроматографии было показано, что при окислительном растворении никеля в данной системе образуются соединения Ni (II).
Изучение влияния растворителя на процесс окислительного растворения никеля в системе бензилгалогенид – растворитель – кислород проводили на основе 25 растворителей, параметры используемых растворителей представлены в таблице №1.
Таблица № 1.
Свойства растворителей 1-25 [6].
|
Растворитель |
e20 |
1/e20 |
nD20 |
Y (1) |
P (2) |
|
Гексан 1 |
1,89 |
0,529 |
1,3750 |
0,1862 |
0,3081 |
|
Бензол 2 |
1,924 |
0,520 |
1,3877 |
0,1906 |
0,3164 |
|
Нитробензол 4 |
34,82 |
0,029 |
1,5546 |
0,4788 |
0,4147 |
|
Бензонитрил 6 |
25,21 |
0,040 |
1,5282 |
0,4708 |
0,4004 |
|
АН 8 |
37,5 |
0,027 |
1,3416 |
0,4803 |
0,2857 |
|
1,4-Диоксан 9 |
2,209 |
0,453 |
1,4424 |
0,2231 |
0,3508 |
|
4-Метилдиоксолан-2-он 10 |
65,1 |
0,015 |
1,4189 |
0,4886 |
0,3363 |
|
Метилацетат 11 |
6,68 |
0,150 |
1,3619 |
0,3955 |
0,2994 |
|
Ацетон 12 |
20,74 |
0,048 |
1,3588 |
0,4647 |
0,2973 |
|
Этилацетат 13 |
6,2 |
0,161 |
1,3724 |
0,3881 |
0,3064 |
|
Диэтиловый эфир 15 |
4,335 |
0,231 |
1,3527 |
0,3449 |
0,2932 |
|
ТГФ 16 |
7,39 |
0,135 |
1,4076 |
0,4049 |
0,3292 |
|
Триметилфосфат 18 |
0 |
0 |
1,3960 |
0 |
0,3218 |
|
ТБФ 20 |
7,6 |
0,132 |
1,4050 |
0,4074 |
0,3275 |
|
ДМФА 21 |
36,7 |
0,027 |
1,4272 |
0,4798 |
0,3414 |
|
ДМАА 22 |
37,78 |
0,026 |
1,4356 |
0,4804 |
0,3466 |
|
ДМСО 23 |
45,0 |
0,022 |
1,4770 |
0,4835 |
0,3714 |
|
ГМФТА 25 |
29,6 |
0,034 |
1,4582 |
0,4751 |
0,3603 |
(1) Y=(e-1)/(2e+1) - полярность [6].
(2) P=(n2-1)/(n2+1) - поляризуемость [6].
Влияние природы растворителя на изучаемый процесс оценивали на основе изменения скорости реакций никеля с бензилгалогенидами в присутствии соответствующего растворителя при 353 К, при этом исходная концентрация растворителя 1-25 составила 2 моль×л-1, а исходная концентрация бензилгалогенидов была равна 0,5 моль×л-1.
Определение кинетических параметров реакции проводили резистометрическим методом, который успешно применяется при исследовании быстрых гетерогенных процессов [4]. Данный метод основан на измерении во время реакции электросопротивления исследуемого образца металла, взятого в виде проволоки. Исследуемый образец можно рассматривать как цилиндр. Считая, что растворение идет равномерно по всей поверхности образца, выражение для расчета скорости растворения металла будет выглядеть следующим образом:
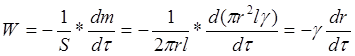
где W – скорость химической реакции (г/см2 ·сек), S – площадь поверхности образца (см2), m – масса образца (г), γ – плотность образца (г/см3), τ – время растворения (сек), r – радиус проволоки (см).
По мере растворения проволоки ее радиус уменьшается, что приводит к возрастанию электросопротивления R:
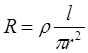
где ρ - удельное сопротивление (Ом·см).
Отсюда 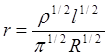
Таким образом, зная длину образца l и измеряя в ходе эксперимента его электросопротивление R можно рассчитать значение радиуса проволоки r в каждый момент времени. А по скорости изменения радиуса (тангенс угла наклона кривой r = f (τ)) можно вычислить скорость реакции.
Реакцию проводили в инертном растворителе, в качестве которого был выбран бензол.
Полученные результаты представлены в таблице №2.
Таблица №2.
Скорости процессов (w) окислительного растворения никеля в системе бензилгалогенид – растворитель 1-25 – кислород.
|
Растворитель |
DNSbCl5 кДж×моль-1 |
w×104, г×см-2×мин-1 |
|
|
Бензилхлорид |
Бензилбромид |
||
|
Гексан 1 |
0,00 |
0 |
0 |
|
Бензол 2 |
0,42 |
0 |
0 |
|
Нитрометан 3 |
11,30 |
0 |
0 |
|
Нитробензол 4 |
18,42 |
0 |
0 |
|
Анизол 5 |
37,68 |
0 |
0 |
|
Бензонитрил 6 |
49,81 |
0 |
0 |
|
Метилхлорацетат 7 |
54,43 |
0 |
0 |
|
АН 8 |
59,02 |
0,585 |
3,390 |
|
1,4-Диоксан 9 |
61,96 |
0,102 |
0,608 |
|
4-Метилдиоксолан-2-он 10 |
63,42 |
0,030 |
0,166 |
|
Метилацетат 11 |
69,06 |
0,012 |
0,091 |
|
Ацетон 12 |
71,15 |
0 |
0 |
|
Этилацетат 13 |
71,57 |
0 |
0 |
|
Дипропиловый эфир 14 |
75,36 |
0 |
0 |
|
Диэтиловый эфир 15 |
80,36 |
0,015 |
0,086 |
|
ТГФ 16 |
83,71 |
0,046 |
0,222 |
|
Тетрагидропиран 17 |
92,11 |
0,089 |
0,492 |
|
Триметилфосфат 18 |
96,00 |
0,118 |
0,654 |
|
ТБФ 19 |
99,20 |
0,177 |
1,027 |
|
Триэтилфосфат 20 |
108,86 |
1,324 |
7,502 |
|
ДМФА 21 |
111,33 |
1,692 |
9,618 |
|
ДМАА 22 |
116,36 |
0,188 |
1,066 |
|
ДМСО 23 |
124,73 |
0,115 |
0,661 |
|
Диэтилацетамид 24 |
134,80 |
0,111 |
0,602 |
|
ГМФТА 25 |
162,40 |
0,105 |
0,567 |
Как видно из таблицы №2, самая большая скорость реакции наблюдается в ДМФА 21, а реакция осуществляется в растворителях 8-11, 15-25. В случаи применения растворителей 1-7, 12-14 скорость реакции была ниже чувствительности прибора. Сравнение этих данных и свойств растворителем представленных в таблице №1 свидетельствует, что не существует линейной или другой простой зависимости между скоростью реакции и e, 1/e, Y, P, nD20. Отсутствие линейной зависимости свидетельствует, что в нашем случае происходит избирательная сольватация [3].
Анализ экспериментальных данных позволил предположить, что активность растворителя 1-25 определяется его донорным числом (DNSbCl5, кДж×моль-1). Зависимость скорости реакции окислительного растворения никеля в системе бензилгалогенид – растворитель 1-25 – кислород от донорного числа растворителя при 353 К представлена на рис. 1.

Рисунок 1. Зависимость скорости реакции окислительного растворения никеля в системах бензилгалогенид – растворитель – кислород от донорного числа растворителя при 353 К.
Зависимость скорости реакции от донорного числа растворителя (рис. 1) имеет экстремальный характер с максимумом в ДМФА 21. Реакция никеля с бензилгалогенидами осуществляется также в в растворителях 8-11, 15-25. Это свидетельствует об избирательном характере адсорбции растворителя на поверхности металла, что согласуется с данными работы [3] об адсорбции органических веществ на поверхности металлов и их оксидов.
Заключение
В результате исследования влияния растворителя на процесс окислительного растворения никеля в системе бензилгалогенид – растворитель - кислород было показано, что скорости реакции зависит от донорного числа растворителя и имеет экстремальный характер с экстремумом в 111,33 кДж∙моль-1 (ДМФА).
Рецензенты:
Вулах Е.Л., д.х.н., профессор, генеральный директор ООО «Фенил», г. Тула.
Левин Д.М., д.ф.-м.н., профессор, заведующий кафедрой физики ФГБОУ ВПО «Тульский государственный университет», г. Тула.



