Введение. Основными источниками отходящих газов, содержащих сернистый ангидрид, являются топливно-энергетические установки , на которых сжигаются серосодержащие угли. От режима работы установок и применяемого сырья зависит состав отходящего газа по серосодержащим соединениям, содержание которых в газах колеблется в пересчёте на SO2 от 0,5 до 5,0%(об). Кроме того, данные отходящие газы содержат в своём составе: кислород до 5%(об), диоксид углерода до 10 %(об), оксид азота до 0,05%(об). Одним из простых широко применяемых в промышленности методов очистки дымовых газов от диоксида серы является абсорбция его водной суспензией извести или известняка [4]. К недостаткам данного способа относят невысокую степень очистки газа от диоксида серы и трудности с регенерацией твёрдого осадка сульфата кальция полученного после абсорбции, а также большой расход исходного реагента. Более эффективной считается очистка дымовых газов от диоксида серы с помощью органических аминов. Технология очистки дымовых газов от диоксида серы ,основанная на контактировании газа, содержащего диоксид серы с водной суспензией меламина описана в работе [2,3]. К преимуществам этого процесса относится высокая эффективность процесса очистки газа от диоксида серы, достигаемая 95% , простая регенерация абсорбента, не требующая больших энергетических затрат.
Цель исследования: Снижение энергетических затрат на стадии регенерации сорбента в процессе разработки промышленно пригодного сорбента для очистки от диоксида серы отходящих и дымовых газов .
Материал и методы исследования. Исследование абсорбции диоксида серы из газовых смесей проводили на искусственно приготовленных смесях. Содержание диоксида серы,примесей в исходном и отходящем газе проводили йодометрическим и хроматографическим методами [1]. Анализ на диоксид серы в жидкой фазе проводили спектрофотометрически. Опыты проведены в барботажном режиме в аппарате, представлящем собой стеклянную колонку диаметром 20 мм со впаянной в нижнюю часть пористой перегородкой (фильтр Шотта №1) при температуре 200С ÷80 0С, расходе газа 0.4÷1 л/мин при соотношении твердое: жидкое в водной суспензии меламина, равном 1:10.
После окончания опыта, суспензию отфильтровывали и анализировали жидкую и твердую фазу на содержание диоксида серы общепринятыми методиками [1]. Степень очистки (α) газа от диоксида серы рассчитывали по формуле: α%=![]() , где Снач и Скон – концентрации SO2 в исходном и конечном газе (% масс.). Степень окисления диоксида серы в сульфат (β ) определяли: β(%)=
, где Снач и Скон – концентрации SO2 в исходном и конечном газе (% масс.). Степень окисления диоксида серы в сульфат (β ) определяли: β(%)=![]()
![]() ,где q - масса диоксида серы, окисленного до сульфата меламина, определяемая как: q=m - (n1+n2), где m –масса диоксида серы, поглощённая суспензией меламина (по разности содержания в газе до и после опыта) ;n1, n2 –масса диоксида серы определяемая в твёрдой и жидкой фазе.
,где q - масса диоксида серы, окисленного до сульфата меламина, определяемая как: q=m - (n1+n2), где m –масса диоксида серы, поглощённая суспензией меламина (по разности содержания в газе до и после опыта) ;n1, n2 –масса диоксида серы определяемая в твёрдой и жидкой фазе.
Десорбцию диоксида серы из твердой фазы осуществляли нагреванием осадка до 200 °С. Выделенный диоксид серы определяли хроматографически. Степень десорбции в проведенных опытах (γ) определяли: γ=![]() ,где G1- масса диоксида серы, выделившаяся при нагревании (г); G2 – масса диоксида серы, поглощенная твердой фазой (г).
,где G1- масса диоксида серы, выделившаяся при нагревании (г); G2 – масса диоксида серы, поглощенная твердой фазой (г).
Результаты исследования и их обсуждение. Очистка дымовых газов от соединений серы может быть осуществлена водной суспензией меламина по следующей реакции[5]:
2C3H6N6 + Н2SО 3+ 4H2O → (C3H6N6)2H2SO3 ∙ 4H2O (1 )
Чистый меламин имеет химическую формулу C3H6N6 , представляет бесцветные кристаллы с температурой плавления 354 0 С. Аминогруппы придают меламину основные свойства. Растворимость в воде невысока и составляет 0,3г/100г воды при температуре 20 0 С. Продуктом реакции(1) является сульфит меламина, который слабо растворяется в воде и окрашивает суспензию в бело-серый цвет.
Примеси, присутствующие в газах совместно с диоксидом серы, будут влиять и на величину степени абсорбции его суспензией меламина , на химический состав получаемого осадка и его физические свойства. Одновременно в дымовых газах могут присутствовать: CO,CO2,Н 2О, SO2,SO3,O2 ,NOx , поэтому в растворе протекают процессы окисления сульфита до сульфата меламина.Пpоведены исследования по влиянию объемной доли кислорода ,углеродсодержащих газов, оксидов азота разной степени окисленности на степень выделения SO2 из твёрдых осадков .Данные по влиянию кислорода , температуры опыта на десорбцию диоксида серы из твёрдого осадка представлены в таблице 1.Объёмная доля серы в газе в пересчёте на SO2 составляла 0.05 %÷ 1% ( об).
Таблица 1. Влияние кислорода и температуры исследования на величину десорбции SO2
|
Температура 0С |
Объемная доля кислорода в газе, % |
Массовая доля SO2, % |
Мольное отношение меламин: SO2 |
Степень, % |
|||
|
твердая фаза |
степень окисления, % |
фильт-рат |
Десорбции SO2 |
Очистки SO2 |
|||
|
20 |
0 |
14,2 |
0 |
0.01 |
2,3 |
97 |
94 |
|
5 |
14,1 |
4,0 |
0,66 |
2,5 |
94 |
92 |
|
|
10 |
13,0 |
10,0 |
0,40 |
2,9 |
87 |
90 |
|
|
15 |
11,2 |
20.0 |
0,36 |
3,2 |
77 |
91 |
|
|
50 |
0 |
14,2 |
0 |
0,88 |
2,3 |
96 |
94 |
|
5 |
13,9 |
5,0 |
0,71 |
2,5 |
92 |
92 |
|
|
10 |
13,4 |
14,0 |
0,52 |
2,9 |
83 |
90 |
|
|
15 |
13,1 |
22,0 |
0,38 |
3,2 |
72 |
89 |
|
|
80 |
0 |
13,8 |
0 |
1,20 |
2,5 |
95 |
92 |
|
5 |
13,7 |
7,0 |
0,80 |
2,6 |
88 |
89 |
|
|
10 |
13,2 |
18,0 |
0,70 |
2,9 |
78 |
87 |
|
|
15 |
13,0 |
23,0 |
0,70 |
3,2 |
71 |
87 |
|
Как видно из данных таблицы 1, с увеличением объемной доли кислорода в газе до 15 % (об) и температуры опыта с 200С до 800С степень десорбции диоксида серы снижается в среднем на 20%÷24 % по сравнению с газом, не содержащим кислорода. Степень очистки газа от диоксида серы суспензией меламина снижается незначительно примерно на 3 %÷5% при увеличении температуры от 200С до 80 0С,что связано с уменьшением времени контактирования газа с сорбентом при больших объёмах газовой смеси. С увеличением объёмной доли кислорода в газовой фазе возрастает степень окисления диоксида серы до триоксида, который далее поглощается суспензией меламина в виде сульфата меламина, по реакциям:
SO2 + 0,5O2=SO3 (2)
Н2О + SO3 = H2 SO4 (3)
2C 3H 6N6 + H2 SO4 + 2H2O → (C 3H 6N 6) 2 H2 SO4 ∙ 2H2O ( 4) При этом с увеличением концентрации кислорода в газе от 5 % до 15 % (об) и температуры суспензии от 20 0С до 800С наблюдается резкое снижение степени десорбции ввиду невозможности разложения сульфатов меламина в условиях регенерации суспензии .Увеличение температуры опыта от 500С до 80 °С при содержании в газе 15 % (об) кислорода мало сказывается на скорости окисления диоксида серы до сульфата меламина ,что говорит о том, что в данных условиях процесс абсорбции в целом определяется выработкой меламина из суспензии . Снижение степени десорбции при этом по сравнению с газом в отсутствии кислорода составляет равную величину 24%.
Результаты исследования по влиянию оксидов азота разной степени окисленности, содержащихся в исходном газе совместно с диоксидом серы на состав получаемого осадка, представленные в таблице 2 показали, что наличие оксида азота в газах в количестве 0.05%- 1.5% об способствует небольшому снижению степени окисленности диоксида серы до триоксида с последующим превращением его в сульфат меламина за счет вероятного окисления оксида азота (II) в оксид азота (IV). Степень десорбции диоксида серы из твердой фазы суспензии, полученной в результате абсорбции газа, содержащего оксиды азота увеличивается на 3 % . При увеличении объемной доли оксида азота в исходном газе в виде NOx от 0. 05% до 1,5% (об) в присутствии 5% (об) O2 снижается доля сульфата меламина в осадке и степень окисления диоксида серы до сульфата меламина с 3,21% (масс) до 2,1%(масс) и степень десорбции диоксида серы возрастает от 94% до 97% при температуре 20 0С и расходе газа 0, 4 л/мин. Степень очистки газа от SO2 в данной серии опытов оставалась неизменной на уровне 92%-94% и незначительное повышение степени очистки связано с увеличением мольного отношения меламин: SO2 в суспензии меламина.
Из опытов по влиянию объемной доли диоксида углерода в исходном газе, в присутствии 5%(об) кислорода ,как видно из данных табл.2, установлено, что с возрастанием объёмной доли диоксида углерода с 0,8 %(об) до 10 % (об) в газовой фазе степень десорбции осадка до SO2 снижалась на 5%,степень очистки снижалась на 4% по сравнению с газом в отсутствии диоксида углерода , что может быть связано с образованием карбонатов, и взаимодействием их с суспензий меламина. Содержание сульфитов меламина при этом в твёрдой фазе снижается с 14,3%(масс) SO2 до 13,5%(масс) SO2. Содержание SO2, определённого по разности между поглощённым SO2 и содержащимся в жидкой и твёрдой фазе, по материальному балансу возрастает с 1,1% до 9,3%,(масс), что может быть связано с побочными реакциями образования карбонатов меламина.
Таблица 2 .Результаты исследования по влиянию NOx , CO2 в исходном газе на показатели образования и разложения твёрдых осадков при температуре 200С, расходе газа 0,4л/мин, в присутствии 5 % O2
|
Объёмная доля NOx , % в газе |
Объёмная доля CO2 , % в газе |
Массовая доля, SO2. % |
Мольное отношение меламин: SO2. |
Степень,% |
|||
|
твёрдая фаза |
степень окисления, % |
Фильтрат |
Десорбции |
Очистки |
|||
|
0 |
− |
14,1 |
4,02 |
0,7 |
2,5 |
94 |
92 |
|
0,05 |
− |
14,1 |
3,21 |
0,96 |
2,5 |
94 |
93 |
|
1,0 |
− |
14.2 |
2,82 |
0,92 |
2,6 |
95 |
94 |
|
1,5 |
− |
14,3 |
2.10 |
1,03 |
2,6 |
97 |
94 |
|
− |
0,8 |
14.3 |
1.10 |
0,83 |
2.5 |
94 |
94 |
|
− |
3,5 |
14,1 |
0,34 |
0,82 |
2.5 |
94 |
93 |
|
− |
7,0 |
13.7 |
5,33 |
0,61 |
2,6 |
90 |
90 |
|
− |
10,0 |
13,5 |
9,30 |
0,52 |
2,6 |
89 |
88 |
Как показали результаты термогравиметрического анализа образцов твердой фазы сульфита и сульфата меламина после опыта, представленные на рис.1 со скоростью нагрева 30С /мин, отгонка диоксида серы может быть осуществлена с гораздо с меньшими энергетическими затратами.
Выделение диоксида серы в газовую фазу протекает совместно с кристаллизационной водой при температуре уже 75°С и заканчивается при температуре 1240С ÷150 °С. При температуре 261°С подвергается распаду регенерированный меламин. Уменьшение массы образца в проведенных опытах в среде воздуха составило 25 % масс при температуре 75÷ 150°С. Дериватограмма образца чистого меламина показала что начиная с температуры 260°С и заканчивая температурой 340°С убыль массы составила 95 % то есть достигается практически полное разложение образца. Разложение сульфатов меламина возможно лишь при температуре выше 500°С, тогда как десорбция твёрдого осадка до диоксида серы осуществляется при температуре до 200 °С
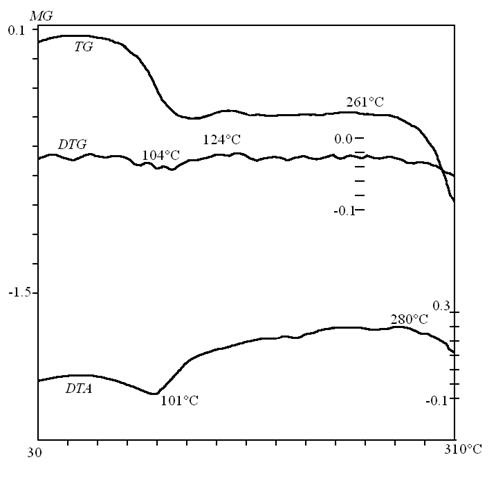
Рис.1. Дериватограмма твёрдого образца, полученного абсорбцией SO2 из газа суспензией меламина в присутствии кислорода.
Таким образом, исследования позволяют сделать следующие выводы.
1. При наличии кислорода в реальных газах ТЭЦ до 5% следует ожидать при температуре 200С преимущественное образование в осадке сульфита меламина и величину степени десорбции диоксида серы на уровне 94%÷95%.
2.Наличие в газах диоксида углерода до 10% (об) и оксида азота разной степени окисленности до 1,5% (об) не ухудшит технологический режим процесса. Степень очистки и десорбции диоксида серы остаётся довольно высокой на уровне 88% ÷ 89% соответственно при содержании в газе максимальных количеств примесей диоксида углерода и 94%÷97% при содержании в газе 1.5% (об) оксидов азота.
3. Как показали результаты дериватографического исследования, возможно проведение процесса десорбции SO2 с меньшими энергетическими затратами при температуре до 150°С.
4. Для достижения полной регенерации осадков сульфита и сульфата меламина возможно, как предлагают авторы работы [5], введение на стадии регенерации к осадкам водного раствора аммиака, в результате чего будет образовываться побочный продукт, сульфат аммония, используемый в качестве удобрения. Кроме того, вместо водного раствора аммиака возможно, по-видимому, использование отходящих газов аммиачного производства и сточных вод производства сульфата аммония, что будет являться предметом дальнейшего изучения данного процесса.
Рецензенты:
Никандров И.С. д.т.н., профессор кафедры АМТ ГОУВПО «НГТУ», г. Дзержинск
Сидягин А.А., д.т.н., профессор кафедры МАХПП ГОУВПО «НГТУ», г. Дзержинск.



