Введение
О целебных свойствах проростков знали еще наши предки. Славяне и другие народы, проживавшие на территориях современной России, готовили из ростков всевозможные похлебки, варево, уху, каши и кисели. Свидетельство тому – упоминания рецептов их приготовления в русском народном травнике. Наши предки прекрасно знали о целебных свойствах этого натурального продукта, регулярное употребление которого способствовало оздоровлению организма. При употреблении проростков в пищу нагрузка на пищеварительную систему человеческого организма уменьшается почти на 90%, поскольку вместе с проростками человек получает, с одной стороны, уже расщеплённые, простые вещества, с другой – дополнительную ферментную систему.
Для получения проростков используют разные зерновые культуры – пшеницу, рожь, овес, ячмень, просо, кукурузу, гречиху и др. Популярностью пользуются почти все зернобобовые – фасоль, горох, чечевица, соя и бобы. Для лечебного питания употребляют также дикорастущие растения: овсюг, пажитник, пырей и прочие. В России проращивание семян для регулярного употребления пока не распространено, поэтому представляет интерес разработка технологий выращивания и получаемый при этом результат в начальный период прорастания семян, а также разработка рецептур и технологий кулинарной продукции с использованием пророщенных семян.
По литературным данным, на энергию прорастания семян ячменя и кукурузы влияют некоторые соли, например, хлорид натрия и препарат 6-БАП (6-бензиламинопурин) [1]. Но исследований в этом направлении мало, поэтому необходимо расширение спектра экспериментальных работ по влиянию добавок на энергию развития проростков.
Цель исследования – изучение влияния некоторых препаратов, используемых при замачивании семян овса, и способа их применения на некоторые характеристики развития проростков.
Материалы и методы исследования
В качестве объектов исследования были использованы семена овса голосемянного, а в качестве препаратов для обработки – растворы хлорида натрия, препараты НВ-101 (концентрированный несинтезированный питательный состав, выработанный из экстрактов растений: гималайского кедра, кипариса, сосны и подорожника) и «Циркон» (иммуномодулятор, корнеобразователь, индуктор цветения – препарат широкого спектра действия с сильным фунгицидным и антистрессовым действием; нормализует обмен веществ растений. Изготавливается из природного сырья – эхинацеи пурпурной).
Для проращивания семян была использована следующая технология: по 5 г семян помещали в химические стаканы объемом 100 мл, заливали 50 мл водопроводной воды и оставляли на 12 часов, затем воду из стаканов сливали через слой марли. Для изучения влияния препаратов на качество полученных проростков образцы семян заливали на 40 минут растворами в соотношении 1 : 10: NaCl (концентрации 50 и 100 ммоль/л), препарата НВ-101 (концентрация – 2 капли на 1 л воды) и препарата «Циркон» (концентрация 0,1 мг/л). Одну часть образцов далее через каждые 12 часов промывали водопроводной водой, а другую часть образцов и далее раз в сутки заливали на 40 минут соответствующими растворами препаратов.
Водные экстракты из готовых высушенных проростков готовили следующим образом: образцы проростков, полученные на 3, 4 и 5 сутки от начала замачивания, высушивали в сушильном шкафу (при 40°С). Высушенные семена измельчали до гомогенности в бытовой кофемолке. Навеску образца заливали водой и выдерживали в течение суток при периодическом встряхивании. Экстракт отделяли от остатка фильтрованием через бумажный фильтр.
Концентрацию водорастворимых растворимых сахаров в экстракте определяли рефрактометрическим методом, а для определения концентрации полифенольных соединений использовали реактив Фолина-Чокальтеу.
Результаты исследования и их обсуждение
В предварительных опытах по проращиванию семян нами было установлено, что добавки хлорида натрия и препаратов НВ-101 и «Циркон» способствовали набору массы семенами при проращивании по сравнению с результатами, полученными при использовании дистиллированной воды. Эти результаты стали причиной выбора этих препаратов при замачивании при проращивании семян овса. В процессе проращивания (до появления хлорофилла и начала фотосинтеза) масса семян может определяться несколькими процессами. Первый из них – простое поглощение воды при набухании семян: набухание должно приводить и действительно приводило к значительному росту массы – более двух кратному к 4-ому дню проращивания для всех вариантов обработки семян, использованных в работе. При этом:
1) набор массы практически не зависел от концентрации хлорида натрия в растворе, использованном при первичном замачивании семян (в диапазоне от 0,05 до 1,0 моль/л), но повторное замачивание уже в дистиллированной воде было благоприятнее, чем замачивание в том же растворе соли (рисунок 1).
На рисунке 1 незакрашенные столбцы относились к результатам определения массы семян для случая использования чистой воды при повторном замачивании, закрашенные – для результатов, полученных при каждом повторном замачивании 0,1 М раствором NaCl. Отсюда следует то, что добавки соли после первой стадии «инициации» проращивания могут угнетать развитие биохимических процессов;
2) статистически неотличимые результаты были получены в опытах с использованием препарата НВ-101, но набор массы при использовании препарата «Циркон» был примерно на 5% ниже.
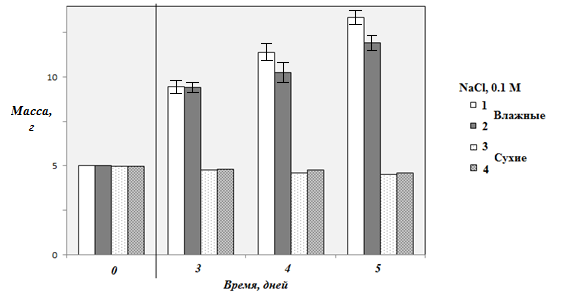
Рисунок 1 – Динамика изменения массы проростков овса голосемянного
Однако очевидно также и то, что по мере прорастания должны начать работу ферменты, расщепляющие полисахариды, переводя их в биодоступное (водорастворимое) состояние, что с одной стороны, (из-за присоединения воды) также должно привести к росту массы. Но замачивание может быть сопряжено и с частичной потерей водорастворимых соединений, переходящих в раствор замачивания. Понятно, что для семян с целостной (полупроницаемой) оболочкой такой процесс маловероятен, что косвенно подтверждается данными по определению масс семян после их высушивания, также приведенных на рисунке 1. Небольшое уменьшение массы (не более 7-10% к четвертому дню проращивания), скорее всего, связано с использованием проростками сахаров для обеспечения процессов роста энергией. Известно, что в высших растениях глюкоза и сахароза используются не только как питательные вещества, но и как «сигнальные» соединения, контролирующие нормальное развитие клеток [5]. Так, например, необходимый уровень сахаров, определяющий осмотическое давление, на определенной стадии способствует дифференциации клеток, а высокая концентрация гексоз, по всей видимости, позволяет клеткам сохранить способность к делению. Следовательно, контроль концентрации водорастворимых сахаров отражает характер развития семян и поэтому имеет принципиальное значение.
Рефрактометрический метод, использованный в настоящей работе, позволил проконтролировать изменение содержания водорастворимых углеводов в водных экстрактах одинаковых навесок размолотых семян (рисунок 2). Для данного показателя получены наиболее различающиеся результаты. Так, при использовании при замачивании 0,10 М раствора хлорида натрия концентрация сахаров в экстракте вначале (до четвертых суток) быстро возрастает, и затем наступает некоторая стабилизация. При этом в случае постоянного замачивания в растворе соли концентрация сахаров оказывается значительно меньшей, что может быть объяснено диффузией хлорида натрия в развивающиеся семена со внесением своего вклада в обеспечение нужного уровня осмотического давления. В случае меньшей концентрации хлорида натрия, во-первых, рост концентрации сахаров наблюдался и спустя четверо суток, при этом различие в результатах для двух аналогичных методов замачивания заметно снизилось, что свидетельствует в пользу выдвинутой ранее гипотезы о роли хлорида натрия.
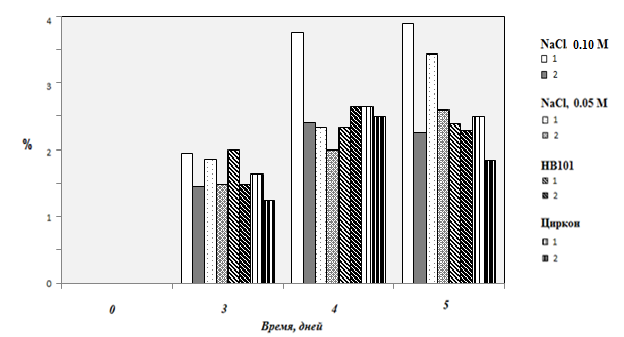
Рисунок 2 – Динамика изменения концентрации водорастворимых сахаров в водных экстрактах проростках овса голосемянного в зависимости от способа обработки семян (однократной и многократной) и используемых для обработки реагентов
Для препарата HB-101, в котором минеральные соли не являются основными компонентами, концентрация сахаров определялась в основном временем проращивания. При этом концентрации этих соединений были заметно ниже, чем при обработке растворами хлорида натрия. Малая зависимость определяемого в данном случае препарата от способа замачивания может свидетельствовать о том, что поглощение активных компонентов препарата HB-101 если и происходит, то только на первом этапе замачивания. Близкие результаты были получены и для препарата «Циркон», но в этом случае концентрация сахаров была немного ниже и избыток препарата заметно негативно сказывался на развитии проростков.
При исследовании антиоксидантной активности экстрактов проростков пшеницы, выполненной нами ранее с использованием амперометрического метода на приборе Цвет Яуза-А01 [3], был установлен монотонный рост этого параметра со временем проращивания. Это также достаточно важный параметр, характеризующий развитие семян, поскольку, например, к числу важнейших веществ, вовлеченных и определяющих развитие семян при проращивании относится витамин С [4]. Для контроля антиоксидантной активности экстрактов семян в настоящей работе был использован метод Фолина-Чокальтеу (рисунок 3). Этот метод обычно применяют для определения флавоноидов, но, по сути, он определяет все восстановители, обеспечивающие образование молибденовой сини, включая фенольные соединения и аскорбиновую кислоту. Различные типы фенольных соединений играют важную роль в растительном метаболизме и очень широко распространены в высших растениях. Их содержание в растениях зависит от многих факторов, включая генетические особенности, условия произрастания, степень зрелости и способ хранения, что затрудняет определение норм пищевого потребления [2].
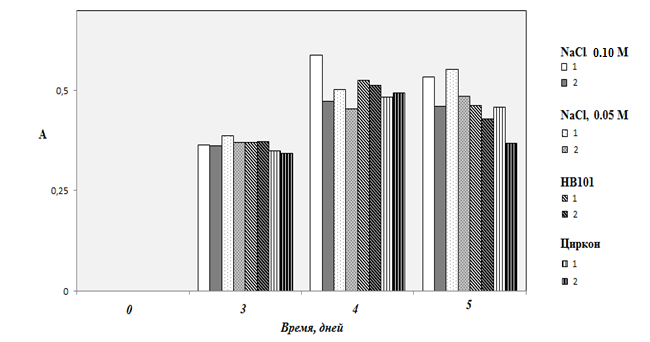
Рисунок 3 – Динамика изменения суммарного количества водорастворимых флавоноидов и аскорбиновой кислоты в проростках овса голосемянного в зависимости от способа обработки семян (однократной и многократной) и используемых для обработки реагентов
Холостой опыт, в котором экстракт готовили на размолотых семенах до проращивания, показал полное отсутствие фенольных соединений в нем, что, скорее всего, свидетельствовало о прочном включении этих веществ в белковые и полисахаридные матрицы. В остальных случаях этот параметр оказался наиболее гомогенным из всех, хотя различия все-таки видны. Проращивание семян, сопровождающееся расщеплением «оболочек», скрывающих запасенные вещества под действием активирующихся ферментов, приводит к разрушению этих матриц и к увеличению биодоступности запасенных соединений, включая фенольные соединения. Антиоксидантная активность также зависит и от биосинтеза аскорбиновой кислоты в развивающихся семенах [4].
В проростках овса, как видно из рисунка 4, водорастворимые фенольные соединения присутствуют в значительных количествах, причем для всех видов обработки максимальное содержание флавоноидов в проростках было найдено на 4 и 5 сутки, достигая уровня 0,12-0,16 мг/г в пересчете на аскорбиновую кислоту.
Некоторое снижение суммарной антиоксидантной активности на 5-е сутки при обработке препаратами НВ-101 и «Циркон» может быть следствием инфильтрации некоторых органических соединений (типа органических кислот) компонентов из них в клетки проростка, – процесс, экспериментально доказанный в работе [4].
Выводы
Таким образом, проведенные исследования показали, что наиболее эффективным из использованных в работе реактивов, стимулирующих развитие семян при проращивании, является раствор хлорида натрия. Причем из двух методов первоначальное замачивание в растворе реактива с последующим (ежедневным) замачиванием в водопроводной воде оказывается более эффективным по сравнению с использованием раствора реактива при каждом замачивании. Наиболее ярко этот эффект метода обработки сказывается на наборе влажной массы проростков и концентрации водорастворимых углеводов, тогда как антиоксидантная активность при этом изменяется заметно меньше. Полученные проростки содержат максимальное количество водорастворимых флаваноидов и аскорбиновой кислоты и водорастворимых сахаров на 4-ые и 5-ые сутки.
Работа выполнена в рамках реализации программы «Развитие научного потенциала высшей школы», тема проекта «Разработка ассортимента кулинарной продукции повышенной пищевой и биологической ценности с использованием пророщенных семян», регистрационный № 7.2077.2011.
Рецензенты:
Ткаченко И.К., д.с.-х.н., профессор, профессор кафедры анатомии и физиологии живых организмов Биолого-химического факультета Белгородского государственного университета Министерства образования и науки РФ, г. Белгород.
Лазарев А.В., д.б.н., доцент, профессор кафедры биотехнологии и микробиологии Биолого-химического факультета Белгородского государственного университета Министерства образования и науки РФ, г. Белгород.



