Актуальность. Рак лёгкого прочно занимает лидирующую позицию в структуре онкологической смертности – на это заболевание приходится почти каждый третий летальный исход от злокачественной патологии. Подавляющее большинство карцином лёгкого выявляются на неоперабельных стадиях, это приводит к тому, что средняя продолжительность жизни при раке легкого измеряется месяцами [3,4,5,6,7].
Ежегодно число новых случаев выявления рака во всех странах мира составляет около 6 млн. человек. Уровни заболеваемости и смертности от злокачественных опухолей в разных странах и даже регионах этих стран вариабельны. Поэтому роль исследований в области диагностики и лечения данной патологии очень велика [1,2,3,4,7,6].
Цель исследования – изучить изменение состояния глюкокортикоидной рецепции при анестезиологическом обеспечении симультанных операций в онкопульмонологии. Для достижения поставленной цели были решены следующие задачи: проведен анализ периоперационной защиты симультанных операций в онкопульмонологической и кардиохирургической практике при применении тотальной внутривенной анестезии и высокой грудной эпидуральной анестезии.
Материалы и методы исследования. Определение уровня плазменного кортизола радиоиммунными методами. Исследования показателей проводились на следующих семи этапах: 1-й – при поступлении в стационар (исходный уровень); 2-й – утром в день операции при проведении премедикации; 3-й – при поступлении в операционную; 4-й – во время проведения разреза; 5-й – во время наиболее травматических моментов операции; 6-й – по окончании операции на стадии ушивания раны; 7-й – через 6 часов после операции. В исследование был включен 181 пациент. Из них 148 (82%) были прооперированы в один этап, 33 пациента в два этапа (табл.1).
Таблица 1
Распределение пациентов с симультанными операциями оперированных из полного, продольного стернотомного доступа
|
Характеристика больных |
Абс. (n) |
% |
|
Рак легких |
129 |
71,0 |
|
Mts в легкие |
21 |
13,0 |
|
Туберкулома |
14 |
8,0 |
|
Хондрома |
9 |
5,0 |
|
Невринома заднего средостения |
2 |
1,0 |
|
Загрудинный зоб |
1 |
0,5 |
|
Тимома |
3 |
1,5 |
|
Лейомиома пищевода |
2 |
1,0 |
Результаты исследования и их обсуждение. Все пациенты, которые были прооперированы, в зависимости от варианта анестезиологического обеспечения были поделены на 2 группы. У пациентов с доброкачественной патологией выполнено: при туберкуломах – 4 прецизионных удаления, у 5 – сегментарные атипичные резекции; все хондромы были энуклеированы; удалены невринома грудной стенки и энуклеировано 2 лейомиомы пищевода, справа и слева с последующей пластикой пищевода (обе операции из стернотомного доступа).
У пациентов 1-ой группы анестезиологическое обеспечение проводилось методом тотальной внутривенной анестезии (ТВА). У пациентов второй группы ТВА дополнялась высокой грудной эпидуральной анестезией (ВГЭА).
Премедикация для больных обеих групп была стереотипной. За 10-15 мин. до вводной анестезии больным в/в вводили атропина сульфат в дозе 0,01 мг/кг, димедрол в дозе 0,3 мг/кг, промедол в дозе 0,2-0,3 мг/кг и диазепам в дозе 0,1-0,2 мг/кг, в ряде случаев клофелин 0,001+0,0002 мг/кг. Общая анестезия у пациентов 1-й группы осуществлялась следующим образом. Вводный наркоз осуществляли внутривенным введением тиопентала натрия в дозе 4-7 мг/кг. После введения дитилина (2 мг/кг) производили интубацию трахеи и начинали ИВЛ воздушно-кислородной смесью (FiO2 – 0,5) в режиме умеренной гипервентиляции. Миоплегию поддерживали дробным введением ардуана в общепринятых дозах. Перед кожным разрезом вводили фентанил в дозе 4-6 мкг/кг и дроперидол в дозе 0,1-0,2 мг/кг. Поддержание анестезии осуществляли в/в капельным введением пропофола в дозе 2,0‑3,2 мг/кг/час и в/в фракционным введением тиопентала натрия в дозе 1,8‑3,5 мг/кг/час, фентанила в дозе 2,4‑3 мкг/кг/час, дроперидола в дозе 0,1 мг/кг и в ряде случаев морфина 0,09-0,12 мг/кг и клофелина в дозе 0,001+0,0003 мг/кг.
Во второй группе ТВА дополняли ВГЭА. После стабилизации параметров вентиляции начинали дробное введение 0,375% раствора бупивакаина в эпидуральный катетер. Первоначально за 20-30 минут до хирургического пневмоторакса вводилась нагрузочная доза бупивакаина 0,05-0,1 мл/кг, но не более 10 мл 0,375% раствора (в среднем 21,1+2,4 мг/кг), затем путем инфузии бупивакаин вводился перфузором со скоростью от 3 до 10 мл/ч. Выбранная концентрация бупивакаина подбиралась для создания симпатической и анальгетической сегментарной блокады на уровне иннервации корня легкого, органов средостения, париетальной и висцеральной плевры. Общая доза использованного бупивакаина не превышала максимально допустимую и составила 1,22+0,05 мг/кг (0,22+0,02 мг/кг/ч).
Глюкокортикоидную рецепцию изучали с позиций исследования стресс-реализующих и стресс-лимитирующих механизомв. Исследования стресс-реализующей системы включали: а) определение уровня плазменного кортизола радиоиммунными методами, б) определение «истинных» глюкокортикоидных рецепторов II типа, реализующих эффект кортизола. Оценка стресс-лимитирующих механизмов иммунокомпетентных клеток включала исследование активности глюкокортикоидных рецепторов III типа, ингибирующих эффект кортизола.
Изучение уровня кортизола в сыворотке крови больных, оперированных с использованием ТВА, на различных этапах оперативного вмешательства показало выраженную гиперкортизолемию на ряде значимых этапах оперативного вмешательства (табл. 2). У пациентов уже во время разреза уровень кортизола в плазме крови – 717,5+16,8 нмоль/л достоверно превышал исходный уровень при поступлении в стационар в 451,2+10,9 нмоль/л (p<0,05). Такая же закономерность наблюдалась и во время наиболее травматических моментов операции – 739,2+21,2 нмоль/л (p<0,05 по сравнению с исходным уровнем). К концу операции уровень кортизола достоверно снижался, но не достигал исходного значения – 647,2+14,2 нмоль/л (p<0,05). И только через 6 часов после операции уровень кортизола возвращался к исходным значениям 492,2+29,0 нмоль/л.
Активность ГКР-2 менялась следующим образом (табл.5.1). Уже во время разреза активность ГКР-2 – 1,41+0,02 у.е. достоверно превышала исходный уровень в 1,18+0,09 у.е. (p<0,05). Такая же закономерность наблюдалась и во время наиболее травматических моментов операции – 1,39+0,05 у.е. (p<0,05). И только к концу операции активность ГКР-2 возвращалась к исходным значениям – 1,10+0,10 у.е. (p>0,05 по сравнению с исходным уровнем).
Таблица 2
Состояние глюкокортикоидной рецепции в группе пациентов, оперированных с использованием ТВА
|
Показатель |
Этапы исследования |
||||||
|
1 |
2 |
3 |
4 |
5 |
6 |
7 |
|
|
Кортизол нмоль /л |
451,2 +10,9 |
473,3 +19,5 |
499,4 +18,4 |
717,5 +16,8* |
739,2 +21,2* |
647,2 +14,2* |
492,2 +29,0 |
|
Актив-ность ГКР-2 (у.е.) |
1,18 +0,09 |
1,02 +0,06 |
1,07 +0,06 |
1,41 +0,02* |
1,39 +0,05* |
1,10 +0,10 |
1,02 +0,15 |
|
Актив-ность ГКР-3 (у.е.) |
1,04 +0,07 |
1,01 +0,07 |
1,15 +0,17 |
0,84 +0,11* |
1,01 +0,14 |
0,98 +0,09 |
1,04 +0,13 |
|
ГКР-3/ ГКР-2 (у.е.) |
0,85 +0,09 |
0,99 +0,05 |
1,07 +0,18 |
0,61 +0,04* |
0,68 +0,08* |
0,86 +0,03 |
1,01 +0,11 |
* - p<0,05 по сравнению с 1-м этапом.
Активность ГКР-3 во время разреза, напротив, снижалась – до 0,84+0,11 у.е. по сравнению с исходным уровнем – 1,04+0,07 (p<0,05) (табл.5.1). И только через 6 часов после операции возвращалась к исходному уровню – 1,04+0,13 у.е. Соответственно, динамика соотношения ГКР-3/ГКР-2 была таковой: на этапах разреза и во время наиболее травматичных моментов операции соотношение ГКР-3/ГКР-2 составило 0,61+0,04 у.е. и 0,68+0,08 у.е. соответственно и было достоверно меньше (p<0,05) по сравнению с исходным уровнем (0,85+0,09 у.е.).
Таким образом, хирургическая агрессия на фоне ТВА приводила к выраженной активации стресс-реализующих механизмов в начале вмешательства и на наиболее травматичных его этапах.
Динамика уровня кортизола в сыворотке крови больных, оперированных с использованием ТВА+ВГЭА, на различных этапах оперативного вмешательства была следующей (табл. 3). Уже во время разреза уровень кортизола в плазме крови – 777,8+17,0 нмоль/л достоверно превышал исходный уровень в 486,2+17,2 нмоль/л (p<0,05). Во время наиболее травматических моментов операции наблюдалась такая же закономерность – 776,9+18,3 нмоль/л (p<0,05 по сравнению с исходным уровнем). К концу операции и через 6 часов после окончания операции уровень кортизола снижался, но не достигал исходного значения – 520,5+22,4 нмоль/л и 506,13+28,0 соответственно. В процессе анестезиологического обеспечения и операции у пациентов, оперированных с использованием ТВА+ВГЭА, достоверной динамики активности ГКР-2 не наблюдалось. Также достоверно не изменялась активность ГКР-3. Соответственно, достоверно не изменялось и соотношение ГКР-3/ГКР-2 (табл.3).
Таблица 3
Состояние глюкокортикоидной рецепции в группе пациентов, оперированных с использованием ТВА+ВГЭА
|
Пока-затель |
Этапы исследования |
||||||
|
1 |
2 |
3 |
4 |
5 |
6 |
7 |
|
|
Кортизол нмоль /л |
486,2 +17,2 |
488,2 +16,1 |
504,3 +24,1 |
777,8 +17,0* |
776,9 +18,3* |
520,5 +22,4 |
506,13 +28,0 |
|
Активность ГКР-2 (у.е.) |
1,01 +0,07 |
1,04 +0,06 |
1,13 +0,12 |
1,22 +0,20 |
1,25 +0,12 |
1,00 +0,08 |
1,13 +0,05 |
|
Активность ГКР-3 (у.е.) |
1,01 +0,07 |
1,13 +0,06 |
1,07 +0,10 |
1,12 +0,09 |
1,13 +0,08 |
1,03 +0,04 |
1,08 +0,05 |
|
ГКР-3/ ГКР-2 (у.е.) |
1,01 +0,05 |
1,08 +0,06 |
0,97 +0,15 |
0,90 +0,16 |
0,91 +0,14 |
1,01 +0,08 |
0,91 +0,07 |
* - p<0,05 по сравнению с 1-м этапом.
Таким образом, хирургическая агрессия с использованием ТВА+ВГЭА приводит к активации стресс-реализующих механизмов в начале вмешательства и на наиболее травматичных его этапах, при этом активность стресс-лимитирующих механизмов достоверно не изменялась.
Нами также проведен сравнительный анализ активности стресс-реализующей системы и стресс-лимитирующих механизмов у больных, оперированных с использованием ТВА и ТВА+ВГЭА на разных этапах исследования (рис.1).
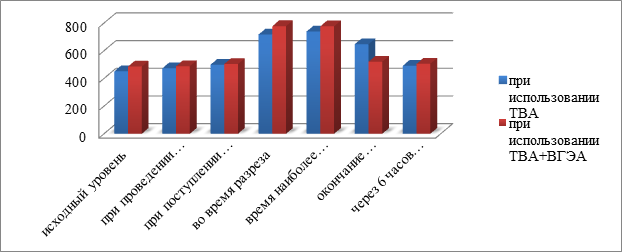
Рис. 1 Сравнительный анализ уровня кортизола в сыворотке крови больных, оперированных при использовании ТВА и ТВА+ВГЭА.
Как видно из рис. 2, исходный уровень кортизола у больных обеих групп был примерно одинаков. При разрезе и на этапе наиболее травматических моментов операции уровень кортизола у пациентов обеих групп резко увеличивался и снижался к исходному уровню только через 6 часов после окончания операции. При этом уровень кортизола у пациентов, оперированных с использованием ТВА+ВГЭА, приближался к исходному уже на этапе окончания оперативного лечения.
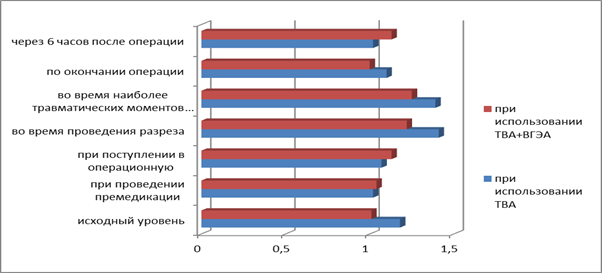
Рис.2. Сравнительный анализ уровня ГКР-2 в сыворотке крови больных, оперированных при использовании ТВА и ТВА+ВГЭА, на разных этапах исследования.
Как видно из рис. 3, уровень «истинных» глюкокортикоидных рецепторов II типа (ГКР-2) увеличивался при разрезе и на этапе наиболее травматических моментов операции, при этом уровень ГКР-2 у пациентов, у которых использовали ТВА, повышался более значительно. Следует отметить, что на этапе окончания операции уровень ГКР-2 у пациентов с использованием ТВА+ВГЭА приближался к исходному уровню, тогда как уровень у пациентов с использованием ТВА на этом же этапе был меньше исходного уровня.
Что касается ГКР-3, то, как видно из рис. 4, при использовании ТВА уровень ГКР-3, наоборот, во время проведения разреза резко падал и возвращался к исходному только через 6 часов после оперативного лечения. При использовании ТВА+ВГЭА уровень ГКР-3 поднимался уже во время премедикации и имел тенденцию к снижению только во время окончания операции.
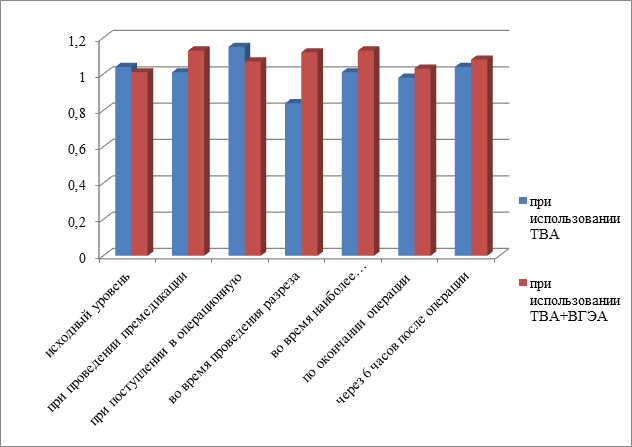
Рис.3 Сравнительный анализ уровня ГКР-3 в сыворотке крови больных, оперированных при использовании ТВА и ТВА+ВГЭА, на разных этапах исследования.
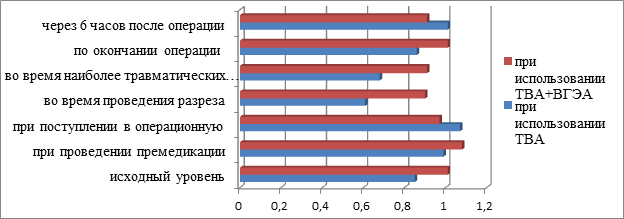
Рис.4 Сравнительный анализ динамики ГКР-2/ГКР-3 у больных, оперированных при использовании ТВА и ТВА+ВГЭА.
Динамика соотношения ГКР-2/ГКР-3 у больных, оперированных при использовании ТВА, показала резкое снижение ГКР-2/ГКР-3 во время проведения разреза и во время наиболее травматических моментов оперативного лечения и возвращение к исходным значениям только по окончании оперативного лечения. При использовании ТВА+ ВГЭА соотношение ГКР-2/ГКР-3 также снижалось во время проведения разреза и во время наиболее травматических моментов операции, но менее чем при использовании ТВА. Также к моменту окончания оперативного лечения при использовании ТВА+ ВГЭА уровень ГКР-2/ГКР-3 возвращался к исходному.
Вывод: использование ТВА+ВГЭА позволяет сохранять оптимальное состояние стресс-реализующих и стресс-лимитирующих механизмов иммунокомпетентных клеток у пациентов не только с раком легкого, но и у пациентов с тяжелой сердечно-сосудистой патологией, также требующей хирургической коррекции. Что показывает возможность применения данного вида анестезии у пациентов с сочетанной патологией легких, грудной стенки, пищевода и сердца, представляющих группу особо высокого операционно-анестезиологического риска.
Рецензенты:
Прощаев К.И., д.м.н., профессор, директор АНО «НИМЦ «ГЕРОНТОЛОГИЯ», г. Москва.
Павлова Т.В., д.м.н., профессор, заведующая кафедрой патологической анатомии ФГАОУ ВПО «Белгородский государственный национальный исследовательский университет», г.Белгород.



