Введение
Микотоксины представляют собой вторичные метаболиты плесневых грибов, которые характеризуются отличаются высокой токсичностью, обладают мутагенными, тератогенными, канцерогенными, иммунодепрессивными свойствами [5]. Контаминации микотоксинами подвергается большинство продуктов растительного происхождения, в первую очередь зерно, крупы, орехи, бобы. Это обуславливает необходимость мониторинга данных соединений на всех этапах производства – от хранения и транспортировки сырья до конечного товара.
Для детектирования микотоксинов используют как различные физико-химические, так и иммунохимические методы анализа [1,2,9]. Среди биосенсорных систем особое место занимают устройства, основанные на эффекте поверхностного плазмонного резонанса (ППР), принципиальным достоинством которых является возможность проводить измерения в режиме реального времени с низким пределом обнаружения специфических комплексов и на основе полученных зависимостей (сенсограмм) рассчитывать кинетические характеристики взаимодействия и содержание определяемого соединения [6,10].
Иммуноанализ на основе поверхностного плазмонного резонанса может быть проведен с использованием очень малого объема пробы: единицы–десятки микролитров. Чувствительный элемент - чип с иммобилизованным иммунореагентом - может быть регенерирован и использован многократно. К недостаткам метода относится высокая чувствительность к примесям в анализируемом образце и, как следствие, необходимость тщательной пробоподготовки.
В настоящее время данный подход воплощен в автоматизированные системы (прежде всего – серии Biacore) [6,8]. Первая работа с использованием ППР для иммуноанализа микотоксинов появилась в 1998 г.; Mullett, Lai и Yeung на лабораторной установке добились для прямого определения фумонизина предела обнаружения, равного 50 нг/мл [7]. Первая работа с применением коммерческой системы Biacore вышла на два года позже [4]. В ней использовалась конкурентная схема анализа и минимальная дететируемая концентрация афлатоксина составила 3 нг/мл. Однако работы по применению данного типа биосенсоров для контроля токсичных контаминант остаются единичными, а вопросы по выбору оптимальной комплектации иммуноаналитических систем - открытыми.
Поэтому целью нашего исследования была разработка и сопоставление двух вариантов иммунохимического определения охратоксина А (ОТА) с использованием оптического сенсора Biacore, отличающихся иммобилизацией разных иммунореагентов - антигенов либо антител. Данная разработка может быть крайне востребованной для скрининга пищевых и кормовых продуктов на содержание микотоксинов.
Материалы и методы
1. Реагенты и оборудование
Использованы бычий сывороточный альбумин (БСА) и N,N-диметилформамид (ДМФА) (MP Biomedicals, США), охратоксин А, конъюгат охратоксин А – БСА (ОТА-БСА), азид натрия, Тритон X-100, Твин-20, додецилсульфат натрия (Sigma-Aldrich, США), сурфактант P20, N-гидроксисукцинимид (NHS), 1-этил-3-(3-диметиламинопропил) карбодиимида гидрохлорид (EDC), этаноламин, сенсорный чип СМ5 (Biacore AB, Швеция), Антитела козы против иммуноглобулинов мыши производства Arista Biologicals (США). Все остальные реагенты квалификации чда и выше. Измерения проводили с использованием оптического биосенсора Biacore X (Biacore AB, Швеция).
2. Иммобилизация лиганда на чип
В предварительных экспериментах в ячейку биосенсора последовательно вводили реагенты (антитела или конъюгат ОТА-БСА) (концентрация 50 мкг/мл, объем 10 мкл) в 10 мМ ацетатном буфере с разными значениями pH (4,0; 4,5; 5,0; 5.5). Иммобилизацию реагентов на поверхности сенсорного чипа СМ5 согласно стандартной процедуре [3]. Чип активировали, используя раствор (70 мкл) EDC и NHS (1:1) при скорости потока 5 мкл/мин. Затем при той же скорости пропускали раствор (70 мкл) иммобилизуемого реагента в выбранном буфере и концентрации. Непрореагировавшие активные группы чипа блокировали 1 М этаноламином, pH 8,5 (70 мкл) при скорости потока 5 мкл/мин. Все эксперименты, включавшие взаимодействие антиген-антитело, проводили в HEPES-P буфере (10 мM HEPES, pH 7,4, содержащий 150 мM NaCl и 0,005% сурфактанта P20).
3. Проведение анализа и построение градуировочной кривой
Через ячейку прибора пропускали свободные антитела или антиген, либо их смесь в известных концентрациях (объем 50 мкл, скорость потока 5 мкл/мин). На основе полученных сенсограмм строили зависимость сигнала сенсора на 800-й секунде измерений от концентрации исследуемого реагента. Для регенерации чипа в ячейку вводили 5 мкл 100 мМ глицин-HCl буфер, рН 2,0, что приводило к разрушению комплекса антиген-антитело, на поверхности чипа оставался только ковалентно иммобилизованный компонент. Измерения проводили относительно контрольной ячейки, поверхность которой блокировали этаноламином (вместо иммобилизации лиганда), а остальные реагенты вносили так же, как и в опытную ячейку.
Обработка полученных данных проводилась с использованием программы Biaevaluation (Biacore AB, Швеция), в режимах «1:1 (Langmuir) binding» или «Steady state affinity».
Результаты и обсуждение
1. Выбор условий для проведения ковалентной иммобилизации на поверхности СМ5 чипа
Основным элементом системы Biacore является сенсорный чип, представляющий собой стеклянную пластину, покрытую тонким слоем золота (примерно 50 нм). Золотая поверхность модифицирована монослоем молекул карбоксиметилированного декстрана, благодаря которому можно проводить иммобилизацию различных лигандов через амино-, тиольные или альдегидные группы. Гибкость декстранового матрикса толщиной 100 нм обеспечивает мобильность иммобилизованных молекул в разных направлениях.
Система Biacore крайне чувствительна к изменениям показателя преломления приповерхностного слоя, изменяющимся при иммобилизации или взаимодействии объекта с поверхностью чипа. Однако при детекции низкомолекулярных соединений, таких как ОТА, изменения очень невелики и достоверная регистрация сигнала невозможна. Перспективнее использовать конкурентные схемы анализа, при которых регистрируется взаимодействие на поверхности чипа «тяжелых» белковых молекул. Реализовать конкурентный иммуноанализ можно двумя способами:
1) иммобилизовать антитела и провести конкуренцию свободного ОТА в пробе с ОТА, конъюгированным с белком;
2) иммобилизовать на поверхности чипа ОТА и провести конкуренцию со свободным ОТА в пробе за центры связывания свободных антител.
Мы использовали декстрановые чипы СМ5. Поскольку изначально декстрановый матрикс заряжен отрицательно, иммобилизуемый объект для успешной иммобилизации должен иметь положительный заряд. Определение оптимального pH иммобилизации проводят в условиях взаимодействия неактивной поверхности декстранового матрикса с белковым лигандом при различных рН, а следовательно, при различном заряде молекулы белка, с целью определения условий наиболее эффективного связывания с поверхностью чипа. Чем выше отклик системы, тем эффективнее связывание лиганда и поверхности чипа при данном значении рН.
На рис. 1 представлена сенсограмма для определения оптимального режима иммобилизации антител, в которой каждый пик соответствует отклику на внесение 10 мкл исследуемого антитела в соответствующем буфере. Наименьший отклик зафиксирован при введении антител в ацетатном буфере с рН 5,5 – 30700 RU, максимальный отклик при рН 4,5 – 33500 единиц. Поэтому для ковалентной иммобилизации выбран рН 4,5.
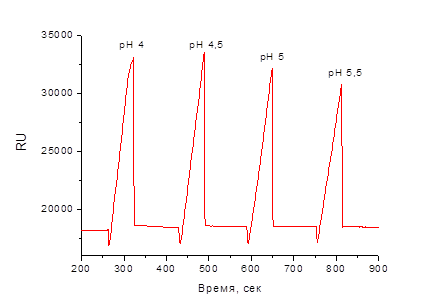
Рис. 1. Адсорбционная иммобилизация антител на поверхности чипа при разных рН
2. Ковалентная иммобилизация антител на поверхности СМ5 чипа и определение концентрации ОТА-БСА для конкурентного анализа
Прибор Biacore X имеет две проточные ячейки, соединенные последовательно друг с другом. Первая ячейка (аналитическая) используется для определения аналита (на ее поверхности иммобилизован специфический иммунореагент), вторая – для контроля уровня неспецифического взаимодействия в отсутствие иммобилизованного иммунореагента.
Для реализации первого варианта конкурентного иммуноанализа мы провели иммобилизацию специфических антител в рабочей ячейке (см. Материалы и методы, раздел 2.2). Уровень иммобилизованных антител соответствовал отклику сенсора, равному 9200 RU (рис. 2). Во вторую ячейку сразу после активации вводили этаноламин, используя его в качестве блокирующего средства для исключения последующего неспецифического связывания с компонентами среды.
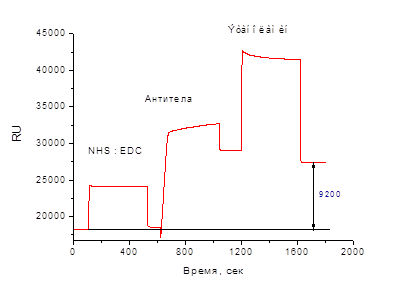
Рис. 2. Сенсограмма ковалентной иммобилизации антител на поверхности чипа
После иммобилизации антител и блокирования второй ячейки определяли оптимальное количество ОТА-БСА для проведения конкурентного анализа. С этой целью в ячейки последовательно вводили ряд разведений конъюгата ОТА-БСА. Типичный вид сенсограммы взаимодействия антител, иммобилизованных на поверхности чипа, и конъюгата ОТА-БСА представлен на рис. 3.
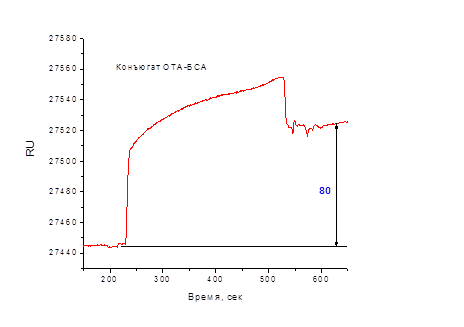
Рис. 3. Сенсограмма взаимодействия антител, иммобилизованных на поверхности чипа, и конъюгата ОТА-БСА (50 мкг/мл, 50 мкл) в растворе
Как видно из рис. 3, конъюгат ОТА-БСА взаимодействовал с антителами, иммобилизованными на поверхности чипа. Для подготовки чипа к следующему взаимодействию проводили регенерацию поверхности буферным раствором 100 мМ глицин-HCl, pH 2,0. В этих условиях иммунный комплекс антитело: ОТА-БСА полностью диссоциирует.
Следует отметить низкий сигнал сенсора в данной схеме: максимальный отклик (80 RU) зафиксирован при концентрации антигена 50 мкг/мл; при концентрации 0,4 мкг/мл отклик составлял 5 RU. Вероятно, этот результат обусловлен неоптимальной ориентацией иммобилизованных антител, что снижает эффективность иммунохимического взаимодействия. Использование данной схемы для анализа ОТА нецелесообразно.
3. Ковалентная иммобилизация конъюгата ОТА-БСА на поверхности СМ5 чипа и определение концентрации антител для конкурентного анализа
В экспериментах по определению условий ковалентной иммобилизации конъюгата ОТА-БСА на поверхности СМ5 чипа выбран рН 5,0. Для реализации второго варианта конкурентного иммуноанализа на поверхности чипа ковалентно иммобилизовали конъюгат ОТА-БСА (см. Материалы и методы, раздел 2.2). Отклик сенсора после иммобилизации конъюгата возрос до 15100 RU, что свидетельствует о высокой эффективности иммобилизации.
Необходимо было определить минимальное регистрируемое количество антител, связывающихся с поверхностью чипа. С этой целью использовали ряд последовательных разведений антител (от 105 до 102 нг/мл). На рис. 4 представлены кинетические кривые взаимодействия антител в растворе и иммобилизованного конъюгата ОТА-БСА. Максимальный отклик (4200 RU) зафиксирован при наибольшей концентрации антител - 100 мкг/мл.
Полученные данные были использованы для расчета констант иммунохимического взаимодействия. Среднее значение кинетической константы ассоциации (ka) – 3,5·104 М-1s-1; среднее значение кинетической константы диссоциации (kd) – 2,4·10-4 s-1; среднее значение равновесной константы (КD) – 1,5·108 М-1. Измеренные константы характеризуют антитела как высокоаффинные.
Была построена зависимость значений сигнала сенсора на 800-й секунде сенсограммы от концентрации антител. Система с конъюгатом, иммобилизованным на поверхности чипа, характеризуется низким пределом обнаружения антител. Вторая система (иммобилизован конъюгат ОТА-БСА) безусловно, более перспективна. Для достоверной конкурентной детекции сигнал сенсора в отсутствии конкурента должен быть не менее 70–80 RU, при несоблюдении этого условия воспроизводимость измерений и расчетов существенно снижается. Для второй схемы это условие выполняется, но требует использовать антитела, иммобилизуемые из концентрации не менее 200 нг/мл.

Рис. 4. Сенсограммы взаимодействия антител к ОТА в растворе и иммобилизованного конъюгата ОТА-БСА
4. Построение калибровочной кривой иммуносенсорного определения охратоексина А
Используя выбранную схему конкурентного иммуноанализа и определенные для нее оптимальные концентрации компонентов, провели иммуносенсорный анализ проб с разным содержанием ОТА. На основании сенсограмм получена зависимость сигнала сенсора (на 800-й секунде) от концентрации ОТА в пробе, представленная на рис. 5. Все точки градуировочной зависимости получены на одном чипе. По проведении более чем 60 измерений динамика сигнала и регистрируемые значения ΔRU не изменялись. Следует отметить, что продолжительность одного цикла измерений, включающего собственно анализ пробы и регенерацию поверхности чипа, составляет 12 мин. Предел обнаружения ОТА составил 0,4 нг/мл, что на порядок ниже соответствующих характеристик иммунохроматографического и иммуноферментного анализа с теми же реагентами [2]. В рабочем диапазоне – 0.5–20 нг/мл – среднеквадратичное отклонение сигнала (n=3) не превышало 7%, наибольшие значения получены в диапазоне высоких концентраций.
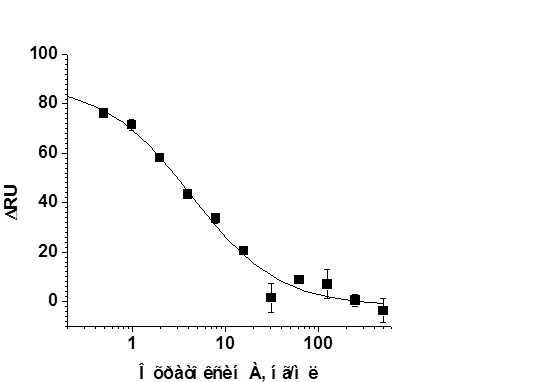
Рис. 5. Градуировочная кривая иммунохимического определения охратоксина А с использованием оптического биосенсора Biacore X
Выводы
Разработаны две схемы конкурентной иммунодетекции ОТА с использованием оптического биосенсора Biacore: (1) антитела иммобилизованы, конкуренция свободного ОТА и конъюгата ОТА-БСА в растворе; (2) конъюгат ОТА-БСА иммобилизован, конкуренция свободного ОТА и иммобилизованного ОТА в конъюгате за центры связывания специфических антител. В результате предложен экспрессный (время анализа 12 мин) и чувствительный (предел обнаружения 0,4 нг/мл) метод иммунохимического анализа ОТА с использованием оптической биосенсорной системы Biacore.
Работа выполнена при финансовой поддержке Министерства образования и науки РФ в рамках Федеральной целевой программы «Научные и научно-педагогические кадры инновационной России» на 2009-2013 годы, соглашение от 10 августа 2012 г. № 8284.
Рецензенты:
Ерёмин С.А., д.х.н., профессор кафедры химической энзимологии Химического факультета Московского Государственного Университета им. М.В. Ломоносова, г.Москва.
Ярополов А.И., д.х.н., профессор, заведующий лабораторией химической энзимологии Института биохимии им. А.Н.Баха РАН, г.Москва.



