В настоящее время в отечественной научной медицине практическое применение находит можжевельник обыкновенный – JuniperuscommunisL., его плоды (шишкоягоды) включены в ГФ XI изд. в качестве диуретического средства. Использование плодов других видов можжевельников не предусмотрено документацией [1].
Наиболее важной в практическом отношении группой биологически активных веществ большинства представителей рода JuniperusL. является эфирное масло. Однако фармакологическое действие можжевельников проявляется не только за счёт эфирных масел, но и комплекса полифенолов. Среди флавоноидных структур, свойственных для этого рода, характерно присутствие 6-гидроксифлавонов, а также бифлавонов [3, 4].
В качестве объекта исследования нами выбран можжевельник длиннохвойный - JuniperusoblongaBieb. J. oblongaBieb.– представитель секции Oxycedrus. На Кавказе данный представитель используется подобно J. communisL. [5]. В официальной медицине настоящий объект не применяется по причине недостаточной химической и фармакологической изученности. Шишкоягоды его употребляются при болезнях почек, мочевого пузыря, дизурии и почечнокаменной болезни. Плоды проявляют сильное мочегонное действие, а также используются как противоцинготное средство [2].
Ранее нами изучен состав полифенолов плодов J. oblongaBieb. классическими методами анализа. Использование современных методов для анализа полифенолов данного объекта не применялось. Поэтому целью настоящего исследования является химическое изучение полифенолов шишкоягод J. oblongaBieb.
Хроматографические исследования полифенолов проводили на хроматографическом приборе «AgilentTechnologies 1200 Infinity». Детекцию осуществляли с помощью диодно-матричного детектора серии Agilent 1200 (диапазон длин волн от 190 до 950 нм, кювета с длиной оптического пути 10 мм; объемом 13 мкл), шаг сканирования - 2 нм.
Сумму полифенолов подвергали хроматографическому разделению в следующих условиях: подвижная фаза: 0,5%-ный водный раствор кислоты уксусной (А) – ацетонитрил (Б) в градиентном режиме элюирования; колонка: AscentisexpressC182,7μм × 100 мм × 4,6 мм; скорость подвижной фазы – 0,5 мл/мин; температура колонки +35 оС; объём вводимой пробы 1 μl. Детектирование осуществляли: для флавонов и флавонолов 360 нм, оксикоричных кислот 325 нм.
Состав подвижной фазы программировали в условиях, указанных в таблице 1.
Таблица 1 - Условия градиентного элюирования полифенолов плодов
J. oblongaBieb.
|
Время, мин |
А,% |
Б,% |
|
0 |
90 |
10 |
|
10 |
80 |
20 |
|
20 |
70 |
30 |
|
30 |
50 |
50 |
|
40 |
10 |
90 |
Хроматографический анализ полифенолов плодов J. oblongaBieb.методом ОФ ВЭЖХ показал присутствие исключительно толькофлавоноидов (рисунок 1).
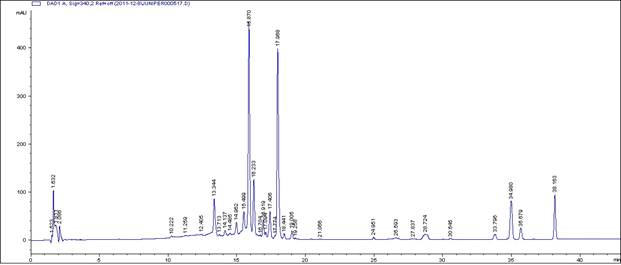
Рисунок 1 - Хроматограмма разделения флавоноидовJ. oblongaBieb.
Критерии пригодности хроматографической системы, рассчитанные по результатам хроматографирования, представлены в таблице 2.
Таблица 2 - Показатели пригодности хроматографической системы для определения полифенолов J. oblongaBieb.
|
tR |
S |
N |
HETP |
Rs |
Tf |
Wb |
|
13,344 |
796 |
137776 |
1,08 |
5,6 |
1,128 |
0,1438 |
|
15,87 |
3095 |
339795 |
0,44 |
3,3 |
0,833 |
0,1089 |
|
16,233 |
803 |
323851 |
0,46 |
3,2 |
0,941 |
0,1141 |
|
17,968 |
3063 |
375425 |
0,4 |
2,04 |
0,727 |
0,1173 |
tR- абсолютное время удерживания, S - площадь пика, N - число теоретических тарелок, HETP - высота, эквивалентная теоретической тарелке, Rs- коэффициент разделения пиков, Tf - коэффициент асимметрии, Wb - ширина пика на базовой линии
Данные таблицы 2 свидетельствуют, что данная хроматографическая система подходит для анализа полифенолов J. oblongaBieb., поскольку все критерии пригодности (N>5000, Rs>1,5, Tf<2) лежат в пределах допустимых значений.
Компонентный состав полифенольного комплекса плодов J. oblongaBieb. по результатам диодно-матричного детектирования представлен в таблице 3.
Таблица 3 - Компонентный состав полифенолов плодов J. oblongaBieb.
|
Время удерживания, мин |
УФ-спектр |
Содержание в сумме, % |
Идентифицированный компонент |
|
9,479 |
|
15,8 |
Бифлавоноид |
|
9,71 |
|
2,4 |
Кверцетин-3-глюкозид |
|
9,91 |
|
3,1 |
Лютеолин-6-С-глюкозид |
|
12,45 |
|
40,7 |
Бифлавоноид |
|
14,09 |
|
8,0 |
Лютеолин-7-глюкозид |
|
15,45 |
|
21,4 |
Скутелляреин-8-О-глюкозид |
|
16,92 |
|
1,0 |
Апигенин-7-глюкозид |
Результаты анализа таблицы 3 свидетельствуют, что полифенолы плодов J. oblongaBieb.представлены исключительно флавоноидами. Их процентное распределение представлено на рисунке 2.
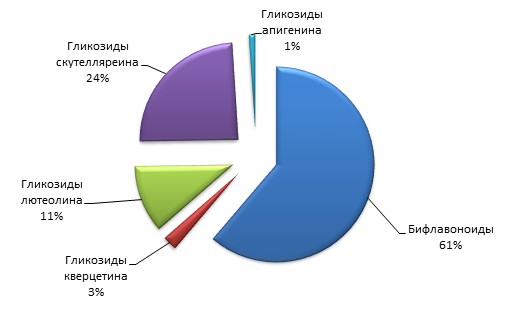
Рисунок 2 - Процентное распределение флавоноидов J. oblongaBieb.
На представленной диаграмме видно, что преобладающими группами флавоноидов являются бифлавоноиды (61,0%) и гликозиды скутелляреина (24,0%).
Масс-спектры полифенолов фиксировали на приборе «AutoflexII» «MALDITOF/TOF» фирмы BrukerDaltonicsGmbH производства Германии. В качестве матрицы использовали α-цианокоричную кислоту, регистрацию спектров вели с помощью программы «FlexControl», обработку данных осуществляли в программе «FlexAnalis», в отражённом режиме при положительной полярности (ReflexPositive).
В масс-спектре полифенольного комплекса плодов J. oblongaBieb наблюдаются интенсивные пики молекулярных ионов гликозидов флавоноидов с m/z = 435, 449 и 465, фрагментирующиеся с образованием агликонов, имеющих пики молекулярных ионов с m/z = 271 287 и 303, принадлежащие апигенину, лютеолину и скутелляреину (рисунок 3).
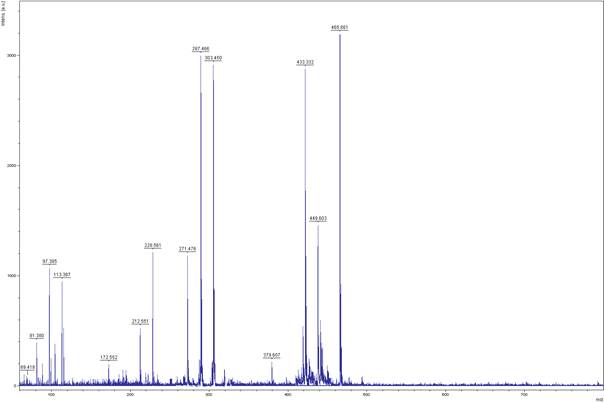
Рисунок 3 - Масс-спектр суммы полифенолов J. oblongaBieb.
В ходе проведённых экспериментов изучен химический состав плодов J. oblongaBieb. Установлено, что полифенольный состав представлен исключительно флавоноидами, а именно гликозидами апигенина, лютеолина, кверцетина, скутелляреина и бифлавоноидами. Основная масса флавоноидов приходится на бифлавоноиды (61,0%) и скутелляреин (24,0%).
Рецензенты:
Шомаров В.К., д.фарм.н., профессор кафедры фармацевтической, токсикологической и аналитической химии Курского государственного медицинского университета, г .Курск.
Будко Е.В., д.фарм.н., профессор кафедры фармацевтической, токсикологической и аналитической химии Курского государственного медицинского университета, г .Курск.










