Введение. Основным методом лечения шизофрении является антипсихотическая терапия, которая наряду с основным клиническим антипсихотическим действием может вызывать различные побочные эффекты [8]. Традиционные (типичные) нейролептики обладают общим механизмом действия, снижая передачу нервных импульсов в тех или иных системах мозга, где передатчиком нервных импульсов является дофамин. При этом снижение передачи нервных импульсов в дофаминовых системах мезолимбической области мозга является необходимым условием антипсихотического действия, в то время как снижение передачи нервных импульсов в экстрапирамидной и тубероинфундибулярной системе гипоталамус-гипофиз является нежелательным эффектом, ответственным за экстрапирамидные побочные явления [8].
Среди экстрапирамидных двигательных расстройств, вызываемых типичными антипсихотическими препаратами, отдельно выделяют позднюю или тардивную дискинезию (ПД), возникающую в их случае длительного применения. Под поздней дискинезией понимают любой гиперкинез, если он удовлетворяет двум основным критериям: во-первых, возникает вследствие длительного приема антипсихотика, во-вторых, стойко сохраняется после отмены препарата [8]. Позднюю дискинезию вызывают традиционные антипсихотики, блокирующие D2-рецепторы (галоперидол, хлорпротиксен, хлорпромазин и др.) и некоторые из атипичных нейролептиков, обладающих сродством к этим рецепторам (рисперидон). Непреднамеренные двигательные расстройства существенно снижают качество жизни больного, зачастую являясь причиной для отказа от приема антипсихотиков, что диктует необходимость поиска биомаркеров для прогноза возникновения риска развития [2].
Вследствие развития дисбаланса в нейротрансмиттерной системе при шизофрении активируются процессы окислительного стресса [2,3,4]. Традиционные антипсихотики могут также индуцировать свободнорадикальное окисление [9]. Снижение антиоксидантной защиты и окислительный стресс способствуют гибели нейронов и развитию тардивной дискинезии [7,10]. Использование клеток периферической крови представляется удобной моделью для оценки различных процессов, протекающих в организме пациентов [1].
Целью исследования явилось изучение активности антиоксидантных ферментов в эритроцитах крови больных шизофренией с поздней дискинезией.
Материалы и методы исследования. Было проведено комплексное клинико-биологическое обследование 26 больных шизофренией, проходивших курс лечения в клиниках ФГБУ НИИПЗ СО РАМН и длительно получающих терапию антипсихотическими препаратами. Исследование проведено с соблюдением протокола, утвержденного комитетом по биомедицинской этике НИИПЗ СО РАМН и в соответствии с Хельсинской Декларацией для экспериментов, включающих людей. Психопатологическая симптоматика описывалась согласно руководству «Оценочный перечень симптомов и глоссарий для психических расстройств» для МКБ–10. В группу обследуемых лиц были включены пациенты с диагнозами: параноидная шизофрения - F20.0 и простая шизофрения – F20.6. В качестве психотропной терапии пациенты получали препараты в виде монотерапии или их комбинаций: традиционные антипсихотики (галоперидол, хлорпротиксен и т.д.), либо атипичный нейролептик (рисперидон). Выраженность побочных двигательных расстройств на фоне проводимой фармакотерапии оценивалась по шкале AIMS (оценка патологических непреднамеренных движений). Больные были разделены на две группы: с поздней дискинезией (10 пациентов) и пациенты без двигательных расстройств (16 больных). В группе пациентов с поздней дискинезией средний возраст составлял 32,6±5,75 года от 25 до 50 лет, средняя продолжительность заболевания 5,78±3,72 лет. Средний возраст больных без ПД составлял 30,9±3,78 лет от 20 до 47 лет, средняя продолжительность заболевания 5,19±2,88 лет.
Определение активности ферментов проводили в эритроцитах периферической венозной крови пациентов согласно стандартным биохимическим методам. Активность глутатионпероксидазы в эритроцитах крови определяли по окислению НАДФ-Н в сопряженной глутатионредуктазной реакции восстановления гидроперекиси третичного бутила. Активность глутатионредуктазы определяли по окислению НАДФ-Н в реакции восстановления окисленного глутатиона. Активность глутатион-S-трансферазы определяли по образованию хромогенных коньюгатов глутатиона с 1-хлоро-2,4-динитробензолом. Содержание белка в исследуемых образцах определяли по методу Лоури. Статистическая обработка проводилась с помощью пакета программ Statistica 6.0 for Windows.
Результаты исследования и обсуждение. Внутриклеточная глутатионзависимая антиоксидантная система периферической крови является чувствительным индикатором окислительного стресса в организме. У больных с поздней дискинезией выявлено достоверное снижение активности глутатионпероксидазы в эритроцитах крови по сравнению с группой больных шизофренией без побочных эффектов терапии (р<0,05) (рис.1).
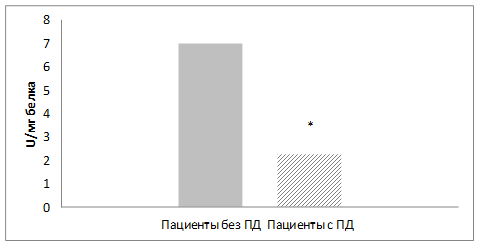
Рис. 1. Активность глутатионпероксидазы в эритроцитах больных шизофренией с поздней дискинезией и без поздней дискинезии.
Примечание: U = мкмоль НАДФН/мин; * - достоверные различия между группами (p<0,05)
Активность фермента глутатионредуктазы в группе пациентов с ПД снижена практически в два раза по сравнению с пациентами без двигательных расстройств и составляет 0,53 ± 0,08 U/мг белка (у пациентов без ПД - 0,99 ± 0,1 U/мг белка, р<0,05) (Рис.2).
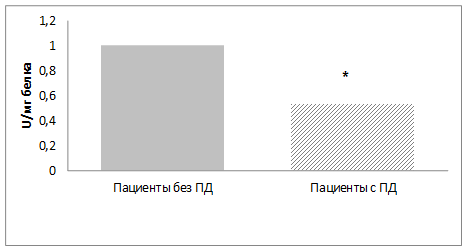
Рис.2. Активность глутатионредуктазы в эритроцитах больных шизофренией с поздней дискинезией и без поздней дискинезии.
Примечание: U = мкмоль НАДФН/мин; * - достоверные различия между группами (p<0,05)
Аналогичная динамика у пациентов выявлена и при анализе активности фермента глутатионтрансферазы: 1,56±0,21 U/мг белка – в группе пациентов без ПД; 0,49±0,08 U/мг белка - в группе пациентов с ПД (p<0,05) (рис.3).
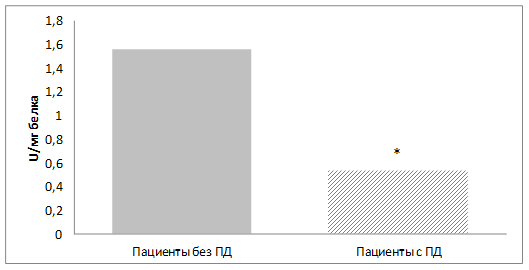
Рис.3. Активность глутатион-S-трансферазы в эритроцитах больных шизофренией с поздней дискинезией и без поздней дискинезии.
Примечание: U = мкмоль ХДНБ-GSH/мин; * - достоверные различия между группами (p<0,05)
В результате проведенного исследования выявлено, что на фоне выраженных двигательных побочных расстройств у больных шизофренией наблюдается снижение активности глатутионзависимых антиоксидантых ферментов: ведущего фермента антиоксидантной защиты глутатионпероксидазы, активности глутатионредуктазы, непосредственно отвечающей за синтез восстановленного глутатиона и глутатионтрансферазы, фермента, выполняющего как антиоксидантную функцию, так и детоксикационную, участвуя в метаболизме ксенобиотиков. Глутатионтрансфераза осуществляет конъюгацию сульфгидрильной (SH) группы глутатиона с ксенобиотиками или их метаболитами, образовавшимися в первой фазе биотрансформации. Данная реакция играет ведущую роль в защите клеток от свободных радикалов.
В целом, полученные результаты согласуются с литературными данными, демонстрирующими, что высокий уровень ПОЛ и снижение антиоксидантных ферментов чаще всего наблюдается при применении типичных нейролептиков [9]. Различия в действии антипсихотиков первого и второго поколения на про- и антиоксидантный баланс по мнению некоторых авторов могут являться причиной развития двигательных побочных эффектов, вызываемых типичными антипсихотиками [5,9]. В патогенез тардивной дискинезии может быть вовлечена высокая липидная пероксидация, лежащая в основе нейротоксичности и связанные с этим нарушение активности антиоксидантных ферментов [10]. Кроме того, определенную роль в дисрегуляцию активности ферментов могут привносить и генетические факторы, связанные с нарушением функциональной активности ферментов у пациентов, носителей определенных полиморфных вариантов генов этих энзимов [7].
Возможно, что нарушения активности ферментов может быть связано непосредственно с антипсихотическим действием традиционных антипсихотиков, которые связывают преимущественно с блокадой D2-дофаминовых рецепторов и изменением дофаминергической нейротрансмиссии [6, 8]. Гиперпродукция дофамина в некоторых структурах мозга приводит к образованию высокотоксичных свободных радикалов, способных вызвать повреждение нейронов. Непосредственно сами препараты могут обладать нейротоксическим действием, например галоперидол в эксперименте вызывает шестикратное увеличение продукции активных форм кислорода в митохондриях, некоторые промежуточные продукты метаболизма антипсихотиков первого поколения обладают цитостатическим эффектом и потенциально связаны с лекарственно-индуцированными экстрапирамидными расстройствами [5].
Заключение. Таким образом, проведенное нами исследование показало снижение активности ферментов в эритроцитах периферической крови у больных шизофренией с двигательными нарушениями, развившимися на фоне длительной антипсихотической терапии. Выявленные особенности в активности антиоксидантных ферментов могут служить основой для разработки способа прогнозирования риска развития поздней дискинезии при шизофрении. Актуальность дальнейших исследований в области изучения механизмов нежелательных лекарственных реакций не вызывает сомнения, поскольку полученные результаты позволяют не только приблизиться к их пониманию молекулярно-биологических основ, но и в дальнейшем открывают перспективы прогнозирования и профилактики развития лекарственных осложнений.
Рецензенты:
Аксенов М.М., д.м.н., профессор кафедры психологии развития личности ФГБОУ ВПО «Томский государственный педагогический университет» Министерства образования и науки РФ, г. Томск.
Невидимова Т.И., д.м.н., профессор кафедры нормальной физиологии Государственного бюджетного образовательного учреждения высшего профессионального образования «Сибирский государственный медицинский университет» Министерства здравоохранения Российской Федерации, г. Томск.



