Введение
Структура и клеточный состав лимфоузлов человека исследовались многими авторами [1; 2; 10]. Непаренхиматозный компонент лимфатических узлов представлен стромальными элементами, характеризующимися структурными и функциональными особенностями. Это, прежде всего, собственно стромальные образования, выполняющие в основном опорную и трофическую функцию. В лимфатических узлах они представлены фибробластами, фиброцитами, миоцитами, эндотелиоцитами сосудов, нейрогенными элементами. Наряду с указанными образованиями непаренхиматозные структуры лимфоидной ткани включают в себя группу ретикулярных клеток, которые совместно с выше указанными элементами стромы, а также в сочетании с экстрацеллюлярным матриксом формируют лимфоидное микроокружение, обеспечивающее развитие лимфоидных клеток [1]. При этом необходимо заметить, что ключевая роль развития лимфоидных предшественников принадлежит ретикулярным клеткам, эндотелиоцитам и экстрацеллюлярному матриксу. Остальные элементы стромы играют вспомогательную роль.
Как и в костном мозге, система кровеносных сосудов является важным компонентом лимфатического узла, поскольку из крови в его ткань и обратно осуществляется интенсивная миграция лимфоцитов. Проникшие в узел через его ворота кровеносные сосуды ветвятся в мозговом и корковом слоях. В корковом слое располагаются мелкие венулы, в которые переходят капилляры. Эндотелий посткапиллярных венул построен из высоких клеток, в их цитоплазме часто обнаруживаются лимфоциты. В ходе миграции лимфоциты проходят как между эндотелиальными клетками, так и через их цитоплазму, затем через базальную мембрану и попадают в ткань глубокого кортекса.
Существует множество установленных и предполагаемых взаимодействий между клетками стромы и паренхимы гемопоэтической и лимфатической систем [2; 4; 10]. Хорошо известно, что клетки стромы костного мозга играют ключевую роль в хоуминге, пролиферации и дифференцировке клеток-предшественниц гемолимфопоэза. Таким же образом эпителиальные клетки тимуса модулируют пролиферацию и дифференцировку Т-лимфоцитов. Что касается лимфатических узлов, значительные исследования были посвящены дендритным клеткам, которые презентируют антиген и участвуют в инициации Т - зависимых клеточных ответов.
Данные о вовлечении в патологический процесс дендритных ретикулярных клеток при неходжкинских лимфомах были подтверждены при иммуногистохимических и экспериментальных исследованиях. Дендритные клетки (ДК) играют в норме важную роль в формировании микроокружения кроветворных клеток костного мозга и лимфоидной ткани. ДК регулируют функциональную активность лимфоидных клеток посредством выработки цитокинов, презентируют опухолевые антигены натуральным киллерам и цитотоксическим клеткам [3].
В-ХЛЛ характеризуется большим количеством CD5+ долгоживущих клеток в костном мозге, крови и вторичных лимфоидных органах [7]. На сегодняшний день принято считать, что устойчивость к апоптозу и избирательное выживание опухолевых клеток не только автономная характеристика, но зависит от внешних антиапоптозных стимулов. Это подтверждается тем фактом, что, несмотря на их долгую жизнь in vivo, опухолевые клетки часто уходят в апоптоз в условиях in vitro. Это также позволяет предположить, что в условиях in vitro клетки не получают сигналов выживания, которые присутствуют в микроокружении in vivo [5; 7].
Цель работы – установить особенности структурной организации стромы лимфатических узлов с акцентом на состояние фолликулярных дендритных клеток и микроциркуляторного русла у больных ХЛЛ с поражением лимфоидной ткани.
Материал и методы исследования
Материалом исследования послужили биоптаты лимфатических узлов 57 больных с впервые выявленным ХЛЛ в возрасте 49-73 лет, полученные до начала лечения. Контрольную группу составили биоптаты лимфатических узлов 20 лиц в возрасте 48-70 лет с неопухолевой реактивной неспецифической лимфаденопатией. Биоптаты лимфатических узлов фиксировались в 10%-ном нейтральном забуференном формалине. Объем фиксирующей жидкости в 20 раз превышал объем фиксируемого объекта. Общее время фиксации при комнатной температуре (около 20 ºС) было не менее 24 часов. Затем биоптаты лимфатических узлов обезвоживались и пропитывались парафином по общепринятой стандартной методике. Гистологическая проводка осуществлялась с помощью автоматического процессора Tissue-Tek Vip 5Jr. Приготовлялись гистологические препараты толщиной 3-5 мкм, которые окрашивались гематоксилин-эозином. Ретикулиновые волокна выявлялись на основе импрегнации серебром. Степень опухолевой инфильтрации оценивалась на основании иммуногистохимических (ИГХ) исследований с использованием панели RTU антител фирмы DAKO: CD 20, CD 79α, CD5, CD 10, CD 23, Cyclin D1. Панель ИГХ-реакций для лимфатических узлов при оценке состояния сосудистого русла и фолликулярных дендритных клеток составили антитела DAKO: CD34 Class II, Collagen IV, Anti-laminin, Anti-human follicular dendritic cell CAN.42, CD21, CD23, Anti-fascin. Морфометрические исследования проводились с использованием пакета программ VideoTest® («Видеотест», Санкт-Петербург).
Результаты
В качестве группы сравнения были взяты биоптаты лимфатических узлов пациентов с неспецифическими хроническими лимфаденопатиями. Характер лимфаденопатии у пациентов контрольной группы отличался (неспецифическое воспаление; лимфаденопатия, связанная с основным заболеванием, и прочее), тем не менее выявленные нами изменения в строении лимфатических узлов лежали в пределах допустимых норм. В гистологических препаратах различалась капсула, кортикальная зона, лимфоидные фолликулы в большинстве случаев с наличием светлых реактивных центров, паракортикальная зона, мозговые тяжи, лимфатические синусы, сосудистая сеть (рис. 1).
Общая структура и клеточный состав паренхимы лимфоузлов не отличались качественным содержанием, имелись в различной степени изменения количественных соотношений. Капсула исследованных лимфатических узлов была представлена плотными коллагеновыми волокнами с наличием небольшого числа фиброцитов, гладкомышечных волокон. Инфильтративные процессы отсутствовали. Внутрь паренхимы от капсулы распространялись соединительнотканные трабекулы, содержащие сосуды. Кортикальная зона в изученных препаратах была расширена, содержала различной величины лимфоидные фолликулы, чаще с центрами размножения.
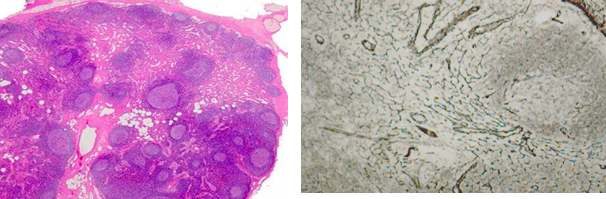
Рис. 1. Лимфатический узел пациента с неспецифической хронической лимфаденопатией. 1 - гематоксилин-эозин, ув. 40х; 2 - импрегнация серебром, ув. 100х
Фолликулы содержали центробласты, центроциты, макрофаги, выявленные при иммуногистохимических исследованиях фолликулярные дендритные клетки. Имелись митозы, четкая зона мантии. Паракортикальная зона содержала лимфоциты малых и крупных размеров, гистиоциты. Синусы лимфатических узлов имели обычную структуру, признаков синусового гистиоцитоза обнаружено не было. Учитывая цель работы, объектами анализа были нишеобразующие элементы стромы – фолликулярные дендритные клетки и сосуды микроциркуляции – их характеристике было уделено основное внимание. Фолликулярные дендритные клетки (ФДК) определялись при помощи панели моноклональных антител DAKO: CD 21, CD 23, Anti-FDC CAN.42, Anti-fascin. Поэтому интерпретация результатов проходила на основе комплексного анализа результатов окрашивания со всей панелью антител. ИГХ-исследования показали наличие ФДК в специфичных для них местах – первичные и вторичные фолликулы лимфатических узлов (рис. 2). При окраске с антителами Anti-fascin, помимо ФДК в фолликулах, были выявлены интердигитальные ретикулярные клетки в Т-зависимой зоне (рис. 2.4). Морфология дендритных клеток не была изменена.
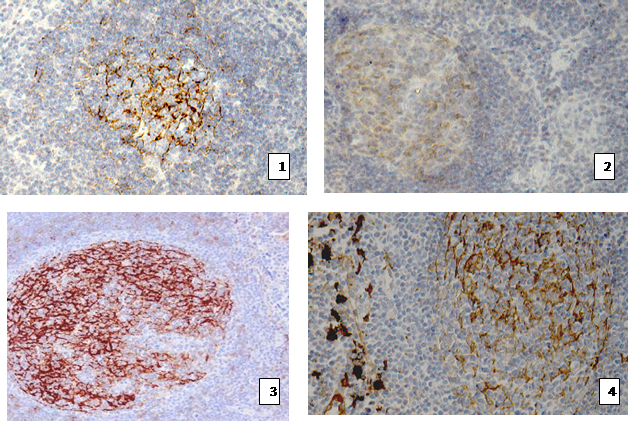
Рис. 2. Выявление фолликулярных дендритных клеток иммуногистохимическим методом с антителами к 1 - CD 21, ув. 200х; 2 - Anti-FDC CAN.42, ув. 200х; 3- CD 23, ув. 100х; 4 - Anti-fascin, ув. 200х.
ИГХ-выявление сосудов и синусов лимфатических узлов проводилось с использованием моноклональных антител Dako CD 34 class II. Наибольшее количество сосудов определялось в паракортикальной зоне, единичные в фолликулах (рис. 3). Иммуногистохимия с антителами anti-collagen IV показала каркас синусов лимфоузлов и крупные сосуды с базальной мембраной. Морфометрические измерения с помощью программы VideoTest® показали, что площадь сосудов 6,5±0,5% (табл. 1).
При импрегнации препаратов лимфатических узлов серебром ретикулиновый каркас был представлен отдельными нитями ретикулиновых волокон, ориентированных в разных направлениях и не имевших пересечений. Ретикулиновые нити образовывали утолщенные тяжи возле сосудов (рис. 1.2).
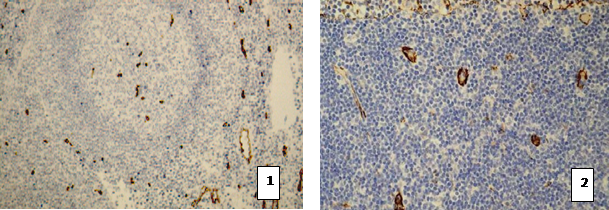
Рис. 3. Лимфатический узел ИГХ с антителами CD 34 class II. 1 - ув. 100х; 2- ув. 200х.
При морфологическом исследовании биоптатов лимфоузлов больных ХЛЛ во всех случаях отмечались нарушение гистоархитектоники всех компонентов лимфоидной ткани и диффузная инфильтрация лимфоцитами (рис. 4.1). Импрегнация препаратов серебром показала деструктивные изменения в ретикулиновой сети лимфатических узлов, причем в двух противоположных направлениях – дезорганизация ретикулиновых волокон с уменьшением их количества, относительно площади лимфоидной ткани, и второй тип – образование более грубой сети с очагами ретикулинового склероза (рис. 4.2).
Фолликулярные дендритные клетки также определялись при помощи панели моноклональных антител DAKO: CD 21, CD 23, Anti-FDC CAN.42, Anti-fascin. Результаты окрашивания представлены на рис. 5. Стоит отметить, что маркеры CD 21 и CD 23 при данном варианте лимфопролиферативного заболевания присутствуют на опухолевых клетках, а CD 23 является диагностически значимым при установке диагноза ХЛЛ. Anti-FDC CAN.42 и Anti-fascin показали незначительное количество разрозненно лежащих клеток, без образования сетчатой структуры. Представленные результаты свидетельствуют о дезорганизации сети ФДК при ХЛЛ, с общим сокращением количества дендритных клеток.
ИГХ-исследование сосудов проводилось с использованием моноклональных антител Dako CD34 class II, Anti-laminin, Anti-collagen IV типа. ИГХ-исследования с антителами CD34 class II показало, что на фоне инфильтрации лимфоузлов зрелыми лимфоцитами обнаруживалось увеличение количества мелких сосудов, а также сосудов с выбухающими в просвет эндотелиоцитами с крупными ядрами, хорошо очерченными ядрышками и фибробластоподобными клетками по периферии сосудов (рис. 6). Структура эндотелиоцитов указанных сосудов была характерна для клеток с высокой функциональной активностью. Морфометрические измерения с помощью программы VideoTest® показали, что площадь сосудов составила 12,8±0,3% при ХЛЛ по сравнению с 6,5±0,5% в контрольной группе (табл. 1). Иммуногистохимия с антителами к ламинину и коллагену IV типа выявила прерывистую или отсутствующую базальную мембрану у большинства сосудов.
Таблица 1. Морфометрические показатели структур лимфатических узлов (М±м).
|
Структура лимфатического узла |
ХЛЛ |
Контроль |
|
Сосуды (площадь, %) |
12,8±0,3 |
6,5±0,5 |
|
Дендритные клетки (площадь, %) |
7,2±1,3 |
23±3,1 |
Представленные нами данные свидетельствуют о значительных перестройках в структурной организации лимфатических узлов при ХЛЛ, которые затрагивают как паренхиматозный, так и стромальный компонент. Нарушения состояния нишеобразующих элементов стромы могут приводить к изменению сигнальных путей регуляции пролиферации и дифференцировки нормальных лимфоидных предшественников. В связи с этим снижается противоопухолевый потенциал лимфоидной ткани и создаются условия для неопластической прогрессии.
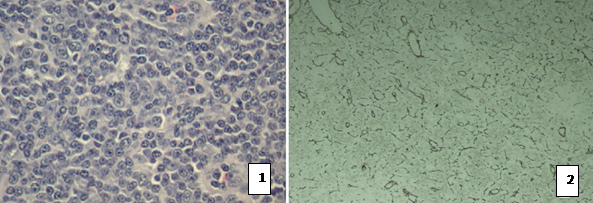
Рис. 4. Лимфатический узел при ХЛЛ. 1 – гематоксилин-эозин, ув. 200х; 2 – импрегнация серебром ув. 100х.

Рис. 5. Лимфатический узел при ХЛЛ. Выявление фолликулярных дендритных клеток иммуногистохимическим методом с антителами к 1 - CD 21, ув. 100х; 2 - Anti-FDC CAN.42, ув. 100х; 3- CD 23, ув. 100х; 4 - Anti-fascin, ув. 200х.
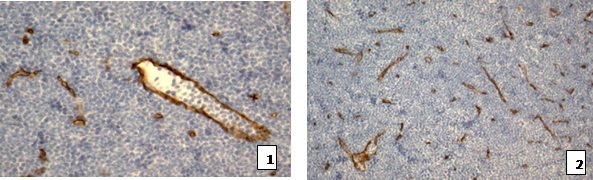
Рис. 6. Лимфатический узел при ХЛЛ, ИГХ с антителами CD 34 class II. 1 - ув. 200х;
2 – ув. 100х.
Обсуждение
Представленные выше данные морфологических исследований свидетельствуют о нарушении паренхиматозно-стромальных взаимоотношений в ткани лимфатических узлов больных ХЛЛ. Взаимоотношения «строма – паренхима» в системе гемолимфопоэза являются базисными для развития и созревания миелоидных и лимфоидных клеток в норме и, как сейчас доказано, стромальные дефекты могут играть ключевую роль в развитии гемобластозов, включая заболевания, обусловленные малигнизацией гемолимфопоэза [2; 4; 7].
Важная роль в регуляции пролиферации и дифференцировки лимфоидных предшественников принадлежит стромальным клеткам лимфоидных органов, включая эндотелиоциты микроциркуляторного русла (МЦР) и ретикулярные клетки.
Широкий круг исследований, проведенный в последние годы, показал, что процесс образования новых кровеносных сосудов наблюдается практически при всех заболеваниях. Примерами могут служить такие нозологии, как злокачественные опухоли, ревматоидный артрит, сахарный диабет, атеросклероз, ишемическая болезнь сердца, язвенная болезнь, туберкулез, некоторые аутоиммунные заболевания и т.д. [6]. Одной из причин повышенного интереса к механизмам ангиогенеза явилось наличие некоторых нарушений данного процесса в отличие от нормального физиологического ангиогенеза. Особенности строения кровеносных сосудов на разных стадиях их формирования определяются уровнем экспрессии и характером взаимодействия различных ангиогенных факторов. В результате реализации аутокринных и паракринных механизмов регуляции уровня ангиогенных факторов, секретируемых эндотелиальными клетками и клетками экстрацеллюлярного матрикса, происходит формирование «локальных очагов васкуляризации», в которых происходит активное прорастание ткани кровеносными капиллярами как в норме, так и при патологии. В качестве регуляторов ангиогенеза могут выступать соединения различного строения и биологической активности, продуцируемые различными клетками — лимфоцитами, макрофагами, тучными, эндотелиальными клетками, опухолевыми и др. Известно, что ангиогенез в опухоли происходит в условиях нарушенных межклеточных и паренхиматозно-стромальных взаимоотношений. Наряду с факторами роста в процессе ангиогенеза имеет большое значение состав экстрацеллюлярного матрикса стромы опухоли. Благоприятным является содержание в нем компонентов базальных мембран – ламинина, фибронектина и коллагена IV типа [6].
Формирование сосудов в опухолях происходит на фоне измененной стимуляции и измененного экстрацеллюлярного матрикса. Это приводит к развитию неполноценных сосудов преимущественно капиллярного типа, имеющих нередко прерывистую базальную мембрану и нарушенную эндотелиальную выстилку. Эндотелий может замещаться опухолевыми клетками, а иногда и вовсе отсутствовать. В лимфатических узлах при ХЛЛ нами показано увеличение количества мелких сосудов на фоне сниженной экспрессии белков внеклеточного матрикса – коллагена IV типа, ламинина и десмина. Для многих опухолей показана корреляция плотности микрососудов с прогрессией заболевания. Полученные нами данные подтверждают эту гипотезу, но требуются статистические доказательства этой корреляции.
Ключевая роль развития лимфоидных предшественников в лимфатических узлах принадлежит ретикулярным клеткам и экстрацеллюлярному матриксу. Исследования последних лет показали изменения количества дендритных ретикулярных клеток в зависимости от гистологического варианта лимфом. Так, лимфомы фолликулярного типа сопровождаются увеличением количества ретикулярных клеток, в то время как при диффузных лимфомах отмечено уменьшение их числа и значительные деструктивные изменения. Данные о вовлечении в патологический процесс дендритных ретикулярных клеток при неходжкинских лимфомах были подтверждены при иммуногистохимических и экспериментальных исследованиях [1].
При изучении факторов, способствующих «выживанию» опухолевых клеток больных ХЛЛ in vitro, было обнаружено, что стромальные клетки способны предохранять клетки ХЛЛ от апоптоза, индуцированного глюкокортикоидами.
Работы, посвященные изучению дендритных клеток при некоторых формах опухолей, показали, что количество и иммунофенотип дендритных клеток, их распределение в опухолевой и непораженной ткани отражаются на прогнозе этих новообразований [3; 9]. Нами показана дезинтеграция фолликулярных дендритных клеток лимфоузлов и уменьшение их количества в лимфоидной паренхиме при ХЛЛ. Фолликулярные дендритные клетки считаются наиболее важным фактором, определяющим состав лимфоидной популяции и влияющим на регулирование функциональной активности лимфоидных клеток. Они могут создавать не только противоопухолевые, но и проопухолевые стимулы. С другой стороны, они не только презентируют опухолевые антигены натуральным киллерам и цитотоксическим клеткам, которые обеспечивают противоопухолевый иммунитет, но и принимают непосредственное участие в элиминации опухолевых клеток.
Как отмечалось ранее, ХЛЛ характеризуется накоплением CD5+ долгоживущих клеток, устойчивых к апоптозу [5-7]. Несмотря на их долгую жизнь in vivo, ХЛЛ клетки часто уходят в апоптоз в условиях in vitro - клетки не получают сигналов выживания, которые присутствуют в микроокружении in vivo. Сокращение числа фолликулярных дендритных клеток в лимфатических узлах больных ХЛЛ может являться благоприятным фактором для выживания и прогрессии лейкозного клона. Возможно, опухолевые клетки создают условия для подавления системы фолликулярных дендритных клеток на цитокиновом уровне.
С другой стороны, при некоторых вариантах лимфом показано увеличение количества дендритных клеток как в опухолевых инфильтратах, так и в непораженных участках лимфатических узлов. Исследователи предполагают, что дендритные клетки совместно с другими компонентами стромы лимфатических узлов могут изменять свою морфологию и выполняемые функции и обеспечивать поддержание лейкозного клона, создавать условия для пролиферации и быстрого роста опухолевой массы [9].
Биологическое значение этого факта еще предстоит выяснить, но уже сейчас можно предположить вовлеченность дендритных клеток в генез неопластической трансформации лимфоидных предшественников и поддержание лейкозного клона.
Таким образом, выяснение характера воздействия стромы на гемолимфопоэз остается актуальной задачей. Для решения проблемы регуляторных воздействий одних морфологических методов недостаточно, однако факты, полученные с применением морфологических методов в норме и при нарушениях кроветворения, могут способствовать дальнейшей конкретизации роли отдельных компонентов кроветворной и лимфоидной стромы в нормальном и малигнизированном гемолимфопоэзе. В условиях малигнизации миелоидных и лимфоидных предшественников характер перестроек нишеобразующих структур костного мозга и лимфоидной ткани имеет важное практическое значение при определении тактики лечения, оценке его эффективности и прогнозировании возможных путей развития системных заболеваний кроветворной и лимфоидной ткани.
Выводы
1. У больных ХЛЛ малигнизация лимфоидных клеток сопровождается перестройкой структурной организации ключевых регуляторных элементов лимфопоэза – фолликулярных дендритных клеток и сосудов микроциркуляции.
2. В лимфатических узлах больных ХЛЛ наблюдается дезинтеграция фолликулярных дендритных клеток и уменьшение их количества.
3. Усиленный ангиогенез является неотъемлемой частью опухолевой инфильтрации лимфатических узлов при ХЛЛ.
4. Установленные качественные и количественные изменения нишеобразующих структур лимфоидной стромы свидетельствуют о вовлечении стромального микроокружения в генез ХЛЛ и могут непосредственно влиять на появление и поддержание лейкозного клона.
Рецензенты:
Колосков А.В., д.м.н., профессор кафедры трансфузиологии ГБОУ ВПО «Северо-Западный государственный медицинский университет им. И.И. Мечникова», г. Санкт-Петербург.
Грицаев С.В., д.м.н., главный научный сотрудник клинического отдела «Гематология» ФГБУ «РосНИИ гематологии и трансфузиологии ФМБА», г. Санкт-Петербург.



