Введение
Сибирский федеральный округ располагает наибольшим фондом рыбохозяйственных водоемов в Российской Федерации. В связи с этим, Западная Сибирь является одним из перспективных регионов для реализации основного направления современной аквакультуры - прудового рыбоводства [10]. Однако, в условиях Западной Сибири, эта деятельность сопряжена с двумя важными особенностями. Первая обусловлена природно-климатическими условиями Сибирского региона и принадлежностью Сибирского федерального округа к первой рыбоводной зоне. Это означает, что совокупность градусодней лимитирует возможность выращивания объектов аквакультуры от икры до товарной рыбы за весенне-осенний период. Несмотря на огромное количество водоемов в Западной Сибири, их преимущественное большинство является депрессивными, что определяет вторую особенность ведения рыбохозяйственной деятельности в условиях данного региона. В рамках реализации стратегии развития аквакультуры в Российской Федерации на период до 2020 года важная роль в развитии прудового и озерного рыбоводства отводится малым аквакультурным предприятиям [10]. Как правило, для таких предприятий технологии выращивания рыбопосадочного материала предполагают использование воды для инкубации икры и подращивания личинок из естественных водоемов, характеризующихся нестабильным гидрохимическим режимом [2]. Важно отметить, что активное использование фитопланктоном кислорода воды в ночное время суток приводит к гипоксии тканей эмбрионов и молоди рыб, развитию окислительного стресса. Это требует разработки научно обоснованных подходов к обеспечению антирадикальной защиты рыб с использованием антиоксидантных соединений уже при переходе личинок на экзогенное питание искусственными стартовыми кормами. По данным литературного анализа в условиях несформированной в морфофункциональном отношении пищеварительной системы личинок рыб переход на искусственные пищевые субстраты приводит к развитию заболеваний органов желудочно-кишечного тракта (ЖКТ) [1, 3, 4, 6]. Одним из важных, но наименее освещенных в литературных источниках механизмах нарушений структуры и функций органов пищеварения является свободнорадикальный. Кроме того, несоблюдение требований при хранении кормов и сроков их использования приводит к окислению липидов корма и, как следствие, развитию патологических процессов в организме с повышением уровня свободнорадикальных процессов [5]. Основываясь на возможности свободнорадикального повреждения пищеварительной системы личинок рыб активными кислородными метаболитами (АКМ) при гипоксии, а также прямого повреждения токсическими продуктами окисления липидов в ингредиентах стартовых кормов, использование антиоксиданта «Тиофан» для защиты тканей органов пищеварительной системы личинок карпа явились основанием для проведения настоящего исследования.
Цель исследования - изучить эффективность применения антиоксиданта «Тиофан» в составе стартового корма для оптимизации антиоксидантного статуса клеток органов пищеварительной системы сеголетков карпа при выращивании в условиях нестабильного гидрохимического режима водоёмов.
Материалы и методы исследования
Опытная часть работы проводилась на базе рыбоводного предприятия ООО «Маяк» Алтайского края. В соответствии с технологическим регламентом данного рыбоводного предприятия через 3 суток после вылупления личинок рыб кормили науплиусами артемии 3 суток в расчёте 100% от массы тела личинок каждый час, в последующем в течение всего периода подращивания (12 суток) личинок кормили декапсулированной артемией, снижая суточную норму кормления к окончанию периода подращивания от 50% до 30% от массы тела личинок. Затем согласно дизайну эксперимента было создано две группы животных. Рыбы опытной группы 3 раза в сутки вместо декапсулированной артемии получали стартовый корм марки AQUAREX с содержанием антиоксиданта «Тиофан», суточная доза которого составила 100 мг/кг массы тела. Рыбы контрольной группы по аналогичной схеме 3 раза в сутки получали стартовый корм марки AQUAREX, не содержащий антиоксиданта «Тиофан». Кратность кормления составляла каждые 2 часа в течение суток. Личинки рыб всех групп содержались в рыбоводных садках с проточной водой, подаваемой из естественных водоёмов. Средняя температура воды в течение всего периода наблюдения составила 23,30С, а суточные колебания содержания кислорода в воде от 4,5 г/л в ночное время суток до 10 г/л днём. Количество личинок в каждом садке составило 500 тысяч особей. После окончания периода подращивания личинок всех групп высаживали в выростные пруды и их дальнейшее содержание осуществлялось без кормления искусственными кормами, а исключительно за счёт естественных ресурсов каждого из водоёмов. Рыбы всех групп были рассажены в равные по площади, гидрохимическому режиму воды, количеству и качеству кормовой базы водоёмы. Плотность посадки в каждом из водоёмов составила 20 тысяч личинок на гектар.
Через четыре месяца после начала эксперимента пруды сливались, а сеголетков карпа перемещали в зимовальные пруды. Рыб по 100 особей из каждой группы отбирали для проведения морфометрического анализа по Правдину И. Ф. [8]. У сеголетков контрольной (n=10) и опытной (n=10) групп забирали все отделы кишечника и гепатопанкреас для проведения морфологического и биохимического анализов. Образцы тканей ЖКТ фиксировали в 10% нейтральном формалине, проводили по стандартной методике, заливали в парафин и изучали методами световой микроскопии [7]. В гомогенатах тканей определяли содержание продуктов перекисного окисления липидов – малонового диальдегида (МДА) и диеновых конъюгатов (ДК), а также активность ключевых звеньев системы антиоксидантной защиты – каталазы (КАТ) и супероксиддисмутазы (СОД) [9].
Статистическую обработку данных проводили с использованием t-критерия Стьюдента и считали достоверной при значении р ≤ 0,05, р ≤ 0,01.
Результаты исследований и их обсуждение
Анализ морфометрических данных по семи основным пластическим признакам из рекомендации И. Ф. Правдина, приведённых в таблице 1 показывает, что по массе тела, высоте, ширине и обхвату тела сеголетки карпа опытной группы превышают указанные показатели рыб контрольной группой на 38,83%, 46,48%, 28,46% и 40,26% соответственно.
Таблица 1. Основные пластические признаки сеголетков карпа
|
Показатель |
Контрольная группа |
Опытная группа |
|
Масса тела, г |
35,73±3,08 |
58,41±8,23** |
|
Длина общая, см |
13,05±1,46 |
15,04±2,21 |
|
Длина туловища, см |
10,75±2,14 |
12,40±3,08 |
|
Длина головы, см |
3,57±0,64 |
4,04±0,87 |
|
Высота тела, см |
3,95±0,72 |
7,38±0,98** |
|
Ширина тела, см |
1,71±0,22 |
2,39±0,14** |
|
Обхват, см |
9,38±1,41 |
15,7±1,79** |
Примечание: достоверные различия по сравнению с контролем при **p≤0,01.
Увеличение линейных размеров животных и массы их тела, как известно, во многом зависит от способности органов пищеварительной системы обеспечивать процессы деградации пищи и всасывания переваренных компонентов. Для обоснования различий рыб контрольной и опытной групп по морфометрическим показателям был проведён гистологический анализ образцов всех отделов кишечника рыб методом световой микроскопии.
При анализе печени рыб контрольной группы обнаруживаются признаки изменения гистоархитектоники её паренхимы. В центролобулярной и интермедиарной зонах дольки печени заметна дискомплектация печёночных балок. На гистологических препаратах данные участки печени характеризуются чрезмерно расширенными синусоидными капиллярами, которые, как правило, заполнены плазмой крови (рисунок 1 А). На обзорных препаратах гепатопанкреаса рыб опытной группы заметно, что паренхима печени сохраняет типичное балочное строение. Клетки эндотелия имеют признаки набухания. Характерным признаком является наличие локальных участков, где заметно расширение синусоидных капилляров (рисунок 1 Б). В области дискомплектации печёночных балок печени рыб контрольной группы гепатоциты имеют полигональную форму и характеризуются наличием в цитоплазме крупных оптически прозрачных вакуолей, которые отдавливают ядро к периферии клетки. При постановке гистохимической реакции с суданом III на липиды данные вакуоли идентифицируются как крупные липидные капли (рисунок 1 В). Совокупность данных морфологических признаки позволяет признать наличие в печени животных контрольной группы фокальной крупнокапельной жировой дистрофии. Следует отметить, что при детальном морфологическом исследовании структурной организации центролобулярной и интермедиарной зон дольки печени опытной группы обнаруживаются признаки мелкокапельной жировой дистрофии. Это определяется по наличию мелких оптически прозрачных вакуолей цитоплазмы. При гистохимической идентификации вакуолей последние преимущественно заполнены водой или мелкими каплями нейтральных жиров (рисунок 1 Г). При дифференциальной оценке степени повреждения гепатоцитов обнаруживается, что преимущественно данный процесс затрагивает гепатоциты центролобулярной зоны долек печени особей контрольной группы. При этом наличие признаков данных повреждений в светлых гепатоцитах центролобулярной зоны свидетельствует о развитии сублетальных повреждений клеток, ответственных, как известно, за детоксикацию и синтез ферментов антиоксидантной защиты.
В связи с тем, что в условиях депрессивных водоёмов сеголетки в течение всего летнего периода были подвержены действию суточного колебания содержания кислорода в диапазоне от 4,5 до 8 мг/л и, как следствие гипоксии, данное состояние рассматривается нами в качестве основного этиологического фактора, обуславливающего повреждение клеток паренхимы печени. В основе нарушения жирового обмена в клетках печени, с нашей точки зрения, лежит единый морфогенетический механизм – свободнорадикальное перекисное окисление липидов (СПОЛ). Одним из доказательств свободнорадикального повреждения структурных элементов печени является наличие отчётливо идентифицируемых признаков нарушения водно-ионного гомеостаза в строме данного органа на участке локализации поджелудочной железы у рыб контрольной группы (рисунок 1 Д). Окружающая поджелудочную железу соединительная ткань содержит обширные участки, заполненные водой. При этом признаков аналогичных повреждений на препаратах печени рыб опытной группы не обнаружено (рисунок 1 Е).
Изучение препаратов кишечника животных обеих групп позволяет определить схожие с печенью закономерности в нарушении структурно-функциональной организации слизистой оболочки кишечника карпов контрольной группы. Обнаруженные морфологические признаки в эпителии и соединительной ткани собственной пластинки слизистой оболочки позволяют считать, что в основе повреждения структурных элементов кишечной трубки лежит нарушение водно-ионного гомеостаза в тканях кишечника. При сравнительном анализе образцов переднего отдела кишечника рыб опытной и контрольной группы выраженных различий на светооптическом уровне не обнаруживается. (рисунок 2 А, Б). По аналогии с кишечником личинок вакуоли в эпителии слизистой у рыб обеих групп могут являться ультраструктурным эквивалентом липидных капель, что отражает дефицит транспорта в клетку кишечника белков.
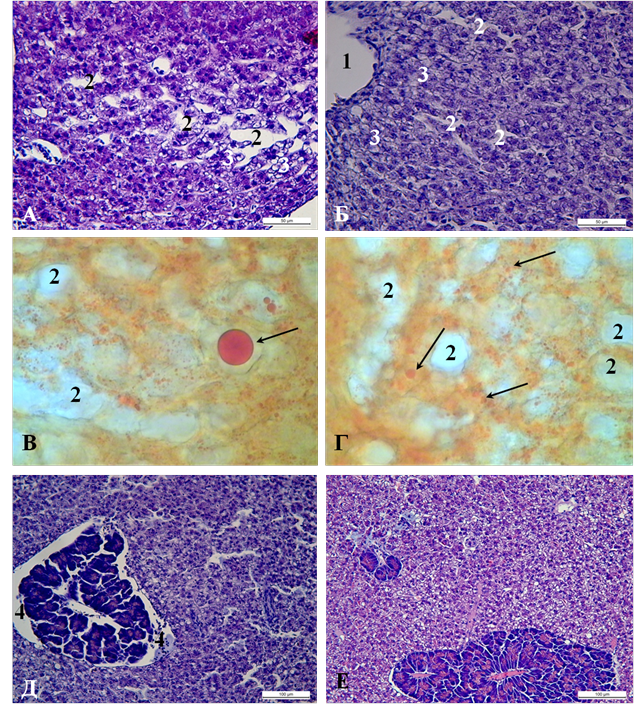
Рисунок 1. Гепатопанкреас сеголетков карпа. А, В, Д – контрольная группа; Б, Г, Е – опытная группа. Окраска гематоксилином и эозином и суданом III Ув. 400. 1 – печёночная вена; 2 – синусоидный капилляр; 3 – печёночная балка; 4 – участок нарушения водно-ионного обмена в строме гепатопанкреаса. Тёмной стрелкой обозначены липидные капли.
В среднем отделе, который отвечает не только за процессы пищеварения, но и всасывания продуктов деградации органических соединений наблюдаются признаки наиболее выраженного нарушения структуры кишечника в образцах рыб контрольной группы. Нарушение полярности строения эпителия, локальное разрушение базальной мембраны эпителия и отёк межклеточного вещества собственной пластинки являются типичными признаками для образцов рыб данной группы (рисунок 2 В, Д). В аналогичных образцах кишечника рыб опытной группы признаки нарушения водно-ионного гомеостаза определяются лишь в цитоплазме эпителиоцитов. На высокую функциональную активность данного отдела у рыб опытной группы указывает расширение капилляров собственной пластинки при отсутствии повреждения базальной мембраны эпителия слизистой оболочки и отёка стромы эпителия кишечных ворсин (рисунок 2 Г, Е). Особенностью морфологии среднего отдела кишечника животных обеих групп является минимальная вакуолизация цитоплазмы эпителиоцитов. Морфологических различий в структуре заднего отдела кишечной трубки у животных обеих групп не обнаружено.
Полученные результаты позволяют считать, что использование антиоксиданта «Тиофан» в период подращивания личинок в условиях колебания содержания кислорода от 4,5 г/л в ночное время до 10 г/л в дневное время суток обеспечивает антиоксидантную защиту организма рыб и даёт преимущества на старте в формировании структуры и функций органов, в том числе пищеварительной системы.
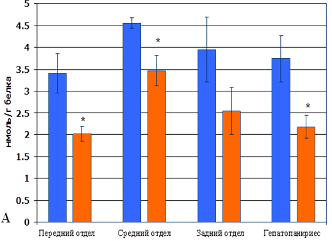
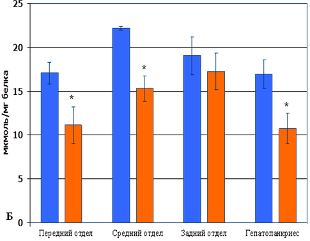
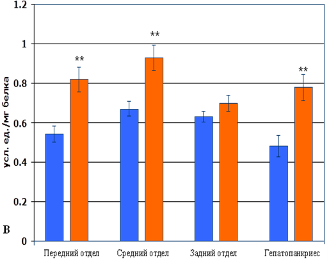
Кроме того, в условиях несформированной системы антиоксидантной защиты личинок рыб использование антиоксиданта «Тиофан» обеспечивает преимущества в формировании собственной системы антиоксидантной защиты у рыб опытной группы по сравнению с контролем. Это определяет устойчивость рыб к гипоксии и повреждению АКМ органов пищеварительной системы сеголетков в течение летнего периода. Данное заключение убедительно доказывается результатами биохимического анализа. Результаты исследования показали, что содержание первичных (ДК) и вторичных (МДА) продуктов СПОЛ в гомогенатах печени рыб опытной группы достоверно ниже на 42% и 37% соответственно. Активность ключевых ферментов системы антиоксидантной защиты СОД и КАТ в гепатопанкреасе рыб опытной группы превышает аналогичные показатели рыб контрольной группы на 38% и 42% соответственно. При этом суммарное содержание ДК и МДА в переднем и среднем отделе кишечника рыб опытной группы на 31% и 33% соответственно ниже, чем в контроле (рисунок 3 А, Б). Суммарная активность СОД и КАТ в переднем и среднем отделе кишечника у рыб опытной группы превышает аналогичные показатели образцов рыб контрольной группы на 30% и 37% соответственно.
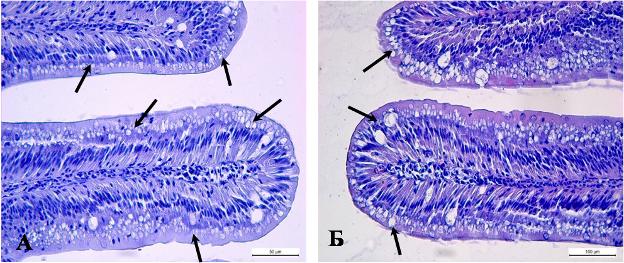
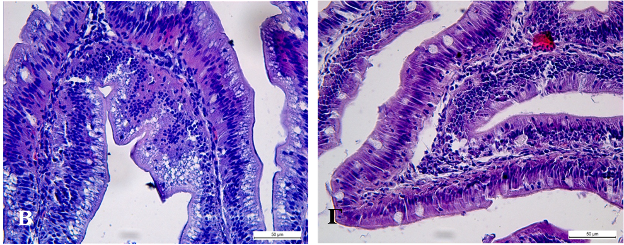
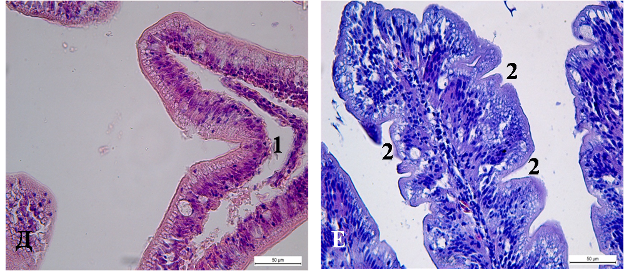
Рисунок 2. Кишечник сеголетков карпа. А – передний отдел кишечника рыб контрольной группы; Б – передний отдел кишечника рыб опытной группы.. В, Д – средний отдел кишечника рыб контрольной группы; Г, Е - средний отдел кишечника рыб опытной группы. Окраска гематоксилином и эозином. 1 – отёк стромы кишечных ворсин; 2 – ундуляции кишечных ворсин; стрелками обозначены оптически прозрачные вакуоли в цитоплазме эпителиоцитов.
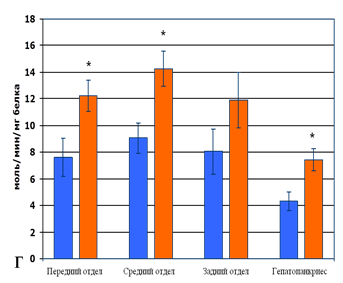
В заднем отделе кишечника рыб опытной группы так же прослеживается тенденция на уменьшение содержания МДА и ДК, повышение концентрации КАТ в ткани и активности СОД по сравнению с контролем, однако данные не достоверны (рисунок 3 В, Г). Это объясняется функциональными особенностями ректума, который осуществляет адсорбцию воды. Вода, в отличие от крупномолекулярных нутриентов пищи, всасываются в кишечнике путём пассивного транспорта через диффузию без затрат энергии и изменения конформации мембраны.
![]()
Рис. 3. Содержание продуктов свободнорадикального окисления и показатели активности системы антиоксидантной защиты в гомогенатах тканей разных отделов кишечника и гепатопанкриеса рыб: А – содержание малонового диальдегида; Б – содержание диеновых конъюгатов; В – активность супероксиддисмутазы; Г – активность каталазы. Примечание – достоверное различие опытной группы относительно контрольной группы (* р ≤ 0,05; ** р ≤ 0,01).
Полученные результаты позволяют вполне обоснованно утверждать, что применение антиоксиданта «Тиофан» в личиночный период развития карпа является эффективным методом защиты тканей органов пищеварительной системы от АКМ в условиях суточных колебаний содержания кислорода в воде. Полученные преимущества в части повышения антиоксидантного статуса рыб сохраняется в течение последующих 4 месяцев жизни сеголетков.
Рецензенты:
Вартапетов Л.Г., д.б.н., заместитель директора по научной работе Федерального государственного бюджетного учреждения науки «Институт систематики и экологии животных» Сибирского отделения Российской Академии наук (ИСиЭЖ СО РАН), г.Новосибирск.
Ефремов А.В., д.м.н., профессор, зав. кафедрой патофизиологии Государственного бюджетного образовательного учреждения высшего профессионального образования «Новосибирский государственный медицинский университет» Министерства здравоохранения Российской Федерации, г.Новосибирск.



