Интерес к изучению микроокружения клеток злокачественных новообразований и в том числе к тумор-ассоциированным макрофагам (tumor-associatedmacrophages) (ТАМ) сохраняется на протяжении последних десятилетий [1,2,4,7,12,13,14]. По современным представлениям ТАМ играют ключевую роль в туморогенезе и прогрессии рака. Посредством секреции многочисленных медиаторов, таких как: факторы роста (bFGF, GM-CSF, TGF-α, IGF-I, PDGF, VEGF/VPF, TGF-β), цитокины и монокины (IL-1, IL-6, IL-8, TNF-α, субстанция P, простагландины, интерфероны, тромбоспондин 1), протеазы (ММР-2, ММР-9) ТАМ способны вызывать пролиферацию опухолевых клеток, ремоделировать строму, индуцировать ангиогенез, стимулировать инвазию и метастазирование опухоли [9].
В литературе имеется небольшое количество работ, посвященных прогностическому значению ТАМ при ПКР. Высокое содержание ТАМ в опухоли, по данным некоторых авторов, при раке почки коррелирует с возникновением метастазов [5,8]. По данным TogeH. и соавт. [11] высокое число ТАМ в карциномах было взаимосвязано с развитием рецидивов. В то же время Hutterer G.C. и соавт. [6] показали, что присутствие TAM в опухоли было статистически значимо ассоциировано с благоприятными прогностическими параметрами, включая низкую клиническую стадию, малый размер опухолевого узла, негативные лимфатические узлы и низкую градацию опухоли по Fuhrman. При этом 5-летняя послеоперационная выживаемость пациентов с высокими значениями TAM в опухоли составляла 93,5 %, по сравнению с 72,5 % в группе больных с отсутствием TAM в опухоли.
Таким образом, работы, посвященные изучению прогностическому значению исследования ТАМ при ПКР, немногочисленны и противоречивы, и поэтому данный элемент микроокружения опухоли нуждается дальнейшем изучении.
Целью работы стало исследование значения ТАМ при ПКР, поиск взаимосвязей с важными клинико-анатомическими факторами прогноза и послеоперационной выживаемостью больных.
Материал и методы исследования
Изучен операционный материал 56 больных ПКР. Средний возраст пациентов составил 58,8±1,1 лет. Мужчин было 27 (48,2 %), женщин – 29 (51,6 %). Во всех наблюдениях ПКР был классифицирован в соответствии с классификацией ВОЗ 2004 г. По гистологическому строению опухоли были представлены следующим образом: светлоклеточный рак – 42; папиллярный рак –3; хромофобный рак – 9; веретеноклеточный (саркоматоидный) рак –2.
Степень распространенности опухолевого процесса оценивалась в соответствии с TNM классификацией злокачественных опухолей (TNM Classification of Malignant Tumors, edited by Sobin L.H., 2002) [10]. Среди больных Ι клинической стадии (T1N0M0) соответствовали 35 (62,5 %) наблюдений; ΙΙ стадии (T2N0M0) -10 (17,9 %) наблюдений; ΙΙΙ стадии (T1N1M0, T2N1M0, T3N0M0, T3N1M0) - 9 (16,1 %) и ΙV стадии (T4N0M0, T4N1M0, TлюбаяN2M1, TлюбаяNлюбаяM1) – 2 (3,5 %). Степень злокачественности опухолевых клеток оценивали по Fuhrman S.A. и соавт. [3]. Степени анаплазии G1 соответствовали 16 опухолей (28,6 %), степени анаплазии G2 – 20 (35,7 %) опухолей, степени анаплазии G3 - 14 (25 %) и степени анаплазии G4 – 6(10,7 %).
Карцином с регионарными и отдаленными метастазами было 8 (14,3 %), локализованных опухолей было – 48 (85,7 %).
Средний размер опухолевого узла составил - 6,8±0,3 см.
Контролем служила ткань почек, забранная из максимально удаленных от опухоли участков, без выраженных явлений воспаления и склероза.
Материал фиксировали в 10 % раствором нейтрального забуференного формалина в течение 12–24 часов. Гистологические препараты окрашивали гематоксилином и эозином и на кислые мукополисахариды коллоидным железом по Гале. ТАМ выявляли иммуногистохимическим методом с помощью моноклональных мышиных антител CD68 (клон PG-M1, DAKO) по рекомендованному производителем протоколу. Высчитывали среднее количество ТАМ в 3 полях зрения при увеличении микроскопа х 400.
Сведения о выживаемости больных получали по данным регистра злокачественных заболеваний и амбулаторных карт (за 2010–2016 гг.).
Статистическую обработку материала проводили при помощи статистического пакета Statistica 6.0. При нормальном распределении данных при проверке статистических гипотез применяли методы параметрической статистики (t-test Стьюдента), а если полученные данные не соответствовали критериям нормального распределения (критерий Шапиро – Уилка W = 0,89, p <0,01), то применяли тест Колмогорова – Смирнова или U-тест Манна – Уитни. Данные считали достоверными при р < 0,05. Построение кривых выживаемости проводили по методу Kaplan-Meier, достоверность различий показателей выживаемости оценивали с помощью log-rank теста.
Результаты исследования и их обсуждение
Результаты проведенного исследования показали, что в неизмененной ткани почки макрофаги имели круглую, овальную или отросчатую форму и располагались в интерстициальной ткани, возле сосудов, между канальцами и в почечных клубочках. В среднем число макрофагов в интерстициальной ткани почки составило 1,6±0,3 в 3 полях зрения при увеличении микроскопа х 400. В клубочках макрофаги имели отросчатую или вытянутую форму. В среднем содержание макрофагов в клубочках составило 5,3±1,2.
Среди всех больных ПКР вне зависимости от пола, возраста, гистологического типа и других клинико-морфологических прогностических показателей разброс средних значений плотности распределения ТАМ колебался от 1 до 137. Среднее значение плотности распределения ТАМ при ПКР составило 14,8±1,2.
Сопоставление среднего числа ТАМ в строме опухоли c прогностически важными клинико-анатомическими факторами ПКР позволило выявить некоторые корреляционные взаимосвязи. Плотность распределения ТАМ была взаимосвязана: c клинической стадией заболевания (r = 0,28; p = 0,04), c размером опухолевого узла (r = 0,29; p = 0,03), c наличием регионарных и дистантных метастазов (r = 0,46; p = 0,0001), со степенью анаплазии опухоли по Fuhrman (r = 0,58; p = 0,0001) и с послеоперационной выживаемостью больных (r = - 0,31; p = 0,02). Не было обнаружено взаимосвязей с полом (r = - 0,10; p = 0,45), возрастом (r = - 0,15; r = 0,27) больных и гистологическим вариантом опухоли (r = - 0,02; p = 0,87) (табл. 1).
Таблица 1
Корреляционные взаимосвязи плотности распределения ТАМ с клинико-морфологическими параметрами ПКР
|
Клинико-морфологическийпараметр |
Коэффициент корреляции (r) |
Достоверность (р) |
|
Клиническая стадия |
0,28 |
0,04 |
|
Размер опухолевого узла |
0,29 |
0,03 |
|
Наличие регионарных и дистантных метастазов |
0,46 |
0,0001 |
|
Степень анаплазии опухоли по Fuhrman |
0,58 |
0,0001 |
|
Послеоперационная выживаемостьбольных |
- 0,31 |
0,02 |
|
Пол пациентов |
- 0,10 |
- |
|
Возраст пациентов |
- 0,15 |
- |
|
Гистологический вариант опухоли |
- 0,02 |
- |
Среднее значение ТАМ в опухолях у мужчин составило 15,9±1,3, у женщин –13,5±2,1(p = 0,3).
В зависимости от возраста пациентов средние показатели числа ТАМ составили: у больных в возрасте от 30 до 39 лет – 8,3±1,45; от 40 до 49 лет – 15,5±2,5; от 50 до 59 лет – 16,4±2,7; от 60 до 69 лет –16,0±1,65и от 70 до 79 лет – 4,7±0,4. Таким образом, самые высокие показатели ТАМ в строме опухоли наблюдали в возрастной группе больных от 50 до 59 лет, а самые низкие в группе от 70 до 79 лет.
При анализе содержания ТАМ в зависимости от клинической стадии заболевания по TNM получены следующие результаты: у пациентов с I стадией среднее число ТАМ составило 12,3±1,6; при II стадии число ТАМ возрастало до 14,1±1,9 (p = 0,3); при III стадии количество ТАМ увеличивалось до 23,4±3,2(p = 0,002) и в IV стадии оно равнялось 21,5± 2,7(p = 0,18). Таким образом, при III и IV клинических стадиях отмечали увеличение ТАМ по сравнению с I и ІІ стадиями.
В зависимости от гистологического варианта ПКР наибольшее количество ТАМ было обнаружено в веретеноклеточной карциноме (45,8±18,7), а наименьшее значение имел хромофобный рак – 9,2±2,1. Промежуточное положение занимали светлоклеточный (14,6±1,2) и папиллярный (13,0±1,6) раки. Таким образом, наибольшее число ТАМ выявляли в веретеноклеточном варианте рака, а наименьшее в хромофобном.
При сопоставлении степени ядерной атипии по Fuhrmanс числом ТАМ были получены следующие результаты: при GI число ТАМ составило7,8±0,7, при GII-7,7±0,9(р = 0,9), при GIII оно возрастало до 26,2±3,2(p = 0,0000001) и при GIV равнялось -26,9±3,7 (p = 0,9). Таким образом, обнаружена тенденция к возрастанию числа ТАМ при увеличении степени анаплазии клеток опухоли.
При размере опухолевого узла < 7,0 см число ТАМ в опухоли равнялось 12,5±1,5, а при размере ≥ 7,0 см оно достоверно увеличивалось до 19,1±1,9(p = 0,01).
В локализованных опухолях содержание ТАМ составило 11,6±0,9, а при возникновении метастазов оно достоверно возрастало до 31,4±4,8 (p = 0,0000001) (табл. 2) (рис.1; а,б).
Таблица 2
Содержание ТАМ в опухоли в зависимости от клинико-морфологических параметров ПКР
|
Клинико-морфологический параметр |
Количество ТАМ |
Достоверность (р) |
|
Пол: мужчины женщины |
15,9±1,3 13,5±2,1 |
- |
|
Возраст: 30 – 39 лет 40 – 49 лет 50 – 59 лет 60 – 69 лет 70 – 79 лет |
8,3±1,45 15,5±2,5 16,4±2,7 16,0±1,65 4,7±0,41 |
p = 0,005 - - - |
|
Стадия TNM: І стадия ІІ стадия ІІІ стадия ІV стадия |
12,3±1,61 14,1±1,9 23,4±3,2 21,5± 2,7 |
- p = 0,002 - |
|
Гистологический вариант опухоли: хромофобный папиллярный светлоклеточный веретеноклеточный |
9,2±2,11 13,0±1,6 14,6±1,2 45,8±18,7 |
- - P = 0,000005 |
|
Градация по Fuhrman: GІ GІІ GІІІ GІV |
7,8±0,7 7,7±0,9 26,2±3,2 26,9±3,7 |
- - p = 0,0000001 |
|
Размер опухолевого узла: < 7,0 см ≥ 7,0 см |
12,5±1,5 19,1±1,9 |
p = 0,01 |
|
Метастазы: отсутствуют имеются |
11,6±0,9 31,4±4,8 |
p = 0,0000001 |
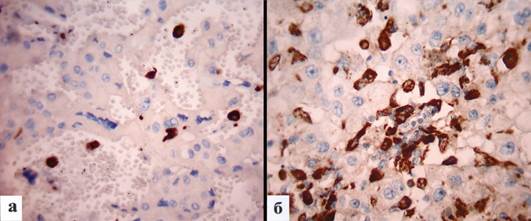
Рис. 1. Содержание ТАМ в строме опухоли в зависимости от наличия метастазов: a – локализованная опухоль; б – метастатическая опухоль. Иммуногистохимическое окрашивание на CD68, увеличение х 400
Для оценки отдаленных результатов 5-летней послеоперационной выживаемости больных в зависимости от среднего числа ТАМ в опухоли, новообразования нами были разделены на 2 группы. 1-ю группу составили карциномы с малым числом ТАМ (<13), 2-ю группу составили карциномы c большим числом ТАМ (≥ 13). При анализе по Каплан – Мейеру было обнаружено, что когда число ТАМ в опухоли составляло <13, то кумулятивная доля выживших к 1800 дню составила 0,96 (96 %), а когда количество ТАМ в опухоли составляло ≥ 13, то кумулятивная доля выживших к 1800 дню снижалась до 0,63 (63 %). При сравнении выживаемости групп больных с использованием логарифмического рангового критерия было получено, что различия данных достоверны (log-rankp = 0,001) (рис. 2).
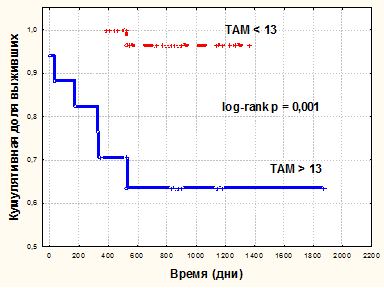
Рис. 2. Кумулятивная пропорция 5-летней выживаемости больных ПКР в зависимости от числа ТАМ в опухоли
Таким образом, результаты проведенного исследования показали, что число ТАМ в опухоли было взаимосвязано с рядом прогностически важных клинико-анатомических факторов ПКР и поэтому данный параметр может быть использован в качестве дополнительного фактора прогноза. Увеличение количества ТАМ в опухоли можно рассматривать как критерий вероятного возникновения метастазов. Выявлена взаимосвязь между числом ТАМ и выживаемостью больных. Высокий уровень содержания ТАМ является неблагоприятным фактором 5-летней послеоперационной выживаемости больных при ПКР.
Библиографическая ссылка
Черданцева Т.М., Бобров И.П., Климачев В.В., Климачев И.В., Казарцев А.В., Попов В.А., Ситникова Ж.И. ПРОГНОСТИЧЕСКОЕ ЗНАЧЕНИЕ ИССЛЕДОВАНИЯ ПЛОТНОСТИ РАСПРЕДЕЛЕНИЯ ТУМОРАССОЦИИРОВАННЫХ МАКРОФАГОВ ПРИ РАКЕ ПОЧКИ // Современные проблемы науки и образования. 2016. № 3. ;URL: https://science-education.ru/ru/article/view?id=24846 (дата обращения: 03.07.2025).



