Введение
Металлические нитриды представляют собой класс материалов с комплексом полезных магнитных, электрических, оптических, химических и механических свойств. Известно [3, 4], что молибденсодержащие нитриды проявляют каталитическую активность в различных химических процессах. Интерес к нитриду молибдена γ-Mo2N возрос с появлением возможности синтеза нитрида с высокой удельной поверхностью. Так, в работе [5] был получен нитрид молибдена с удельной поверхностью более 200 м2/г с использованием процесса термопрограммируемого аммонолиза. Такой материал показывает высокую каталитическую активность в процессе синтеза аммиака. Дальнейшим шагом исследований стало применение метода термопрограммируемого аммонолиза для получения биметаллических нитридов, каталитическая активность которых возросла по сравнению с нитридом молибдена [2]. Также было показано, что такие нитриды проявляют активность по отношению к другим реакциям гидрирования [1, 6]. Несмотря на перспективность использования, процессы формирования биметаллического нитрида изучены недостаточно полно, а в литературе по этому вопросу имеются противоречивые данные. Известно несколько методов получения фазы Ni2Mo3N. Самым распространённым методом является аммонолиз оксидных прекурсоров, приготовленных путём выпаривания совместного раствора никель- и молибденсодержащих солей. Он состоит из 3х стадий и требует высокого расхода аммиака. Ещё один способ получения биметаллических нитридов заключается в разложении гексаметилентетраминовых комплексов соответствующих металлов в инертной атмосфере. Недостатком такого метода является использование более высоких температур, что негативно отражается на свойствах продукта. Наименее изученным методом является обработка прекурсора, полученного выпариванием металлсодержащих солей, в токе водорода. Этот метод учитывает недостатки других методов и является, на наш взгляд, самым перспективным на данный момент.
Однако в связи с наличием в литературе противоречивых данных по вопросу процессов формирования нитрида, целесообразно провести исследование влияния соотношения исходных компонентов на особенности фазообразования в системе Ni-Mo-N.
Экспериментальная часть
В данной работе было получено 3 образца, отличающихся соотношением Ni:Mo в растворах исходных солей. В качестве солей использовались нитрат никеля 6-водный (Ni(NO3)2∙6H2O, ГОСТ 4055-78) и аммоний молибденовокислый 4-водный ((NH4)6Mo7O24∙4H2O, ГОСТ 3765-78). Образцы получали восстановлением прекурсоров в токе водорода, которые, в свою очередь, были получены выпариванием совместных растворов исходных солей. Температуры восстановления выбирались по данным термогравиметрического анализа в токе водорода. После восстановления образцы пассивировались в атмосфере технического азота.
Термогравиметрический анализ проводили для прекурсора в токе водорода, а также для восстановленного порошка до и после исследования каталитической активности в атмосфере воздуха на приборе SDT Q600 (TA Instruments, США). Измерение удельной поверхности проводили на установке Nova 1200 (Quantachromeinstruments, США) методом низкотемпературной адсорбции азота. Анализ результатов проводили по методу БЭТ. Рентгенографический анализ образцов проводили на дифрактометре Difray-402 (ЗАО «Научные приборы», Россия) в интервале углов 2θ от 25 до 120° с использованием излучения Cr (λ = 2,2909 Å). В качестве детектора использовался изогнутый координатно-чувствительный детектор, регистрирующий спектр одновременно в интервале углов 2θ 58°. Время экспозиции составляло 10 с.
Нитрид состава Ni2Mo3N был исследован в качестве катализатора в реакции метанирования диоксида углерода по реакции:
![]()
Для перевода катализатора в активное состояние проводили процедуру восстановления оксида NixMoyOz на поверхности, образующегося в результате пассивации образца. Температуру восстановления выбирали исходя из данных термогравиметрического анализа запассивированного образца в токе водорода. Навеску образца массой 0,5 г загружали в проточный реактор и нагревали до температуры 350 °С в токе водорода. После активирования образца газ переключали на смесь 20 % CO2/H2 со скоростью потока 20 мл/мин. Реакцию проводили при температуре 350 °С и атмосферном давлении в течение 480 минут. Газовую смесь на анализ отбирали на выходе после реактора и анализировали на ИК-Фурье спектрометре Nicolet 380 (ThermoElectron, США) каждые 120 минут. Для построения базовой линии отбирали газовую пробу до реактора с катализатором. Съёмку вели в режиме «на просвет». Конечный спектр получали вычитанием спектра базовой линии из спектра пробы.
Обсуждение результатов
Результаты рентгенофазового анализа образцов приведены на рисунке 1. Из приведённых данных видно, что пики с максимальной интенсивностью различных никель-молибденовых фаз перекрываются, однако наличие дополнительных пиков на малых и больших углах дифракции доказывает наличие биметаллического нитрида в образцах.
Анализ фазового состава восстановленных образцов показал (см. таблицу 1), что, несмотря на сложность системы, получающейся после выпаривания совместного раствора солей, достаточно контроля над стехиометрическим соотношением активных компонентов для получения однофазового образца биметаллического нитрида. Также видно влияние образования чистых металлов и интерметаллидов на уменьшение удельной поверхности порошка, что, вероятно, связано с процессами спекания, сопровождающими процессы фазообразования побочных продуктов.
Таблица 1. Фазовый состав и удельная поверхность восстановленных образцов.
|
Расчётное мольное соотношение Ni:Mo |
Фазовый состав, вес. % |
Удельная поверхность, м2/г |
|
1:9 |
69 % Mo; 31 % Ni2Mo3N |
4 |
|
2:3 |
100 % Ni2Mo3N |
30 |
|
1:1 |
6 % NiMo; 54 % Ni4Mo; 40 % Ni2Mo3N |
11 |
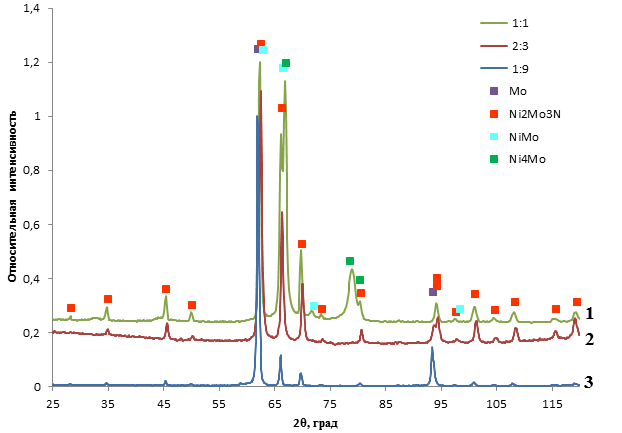
Рисунок 1. Результаты рентгенофазового анализа образцов, полученных из прекурсоров различного состава (кривая 1 – Ni:Mo = 1:1; кривая 2 –Ni:Mo = 2:3; кривая 3 – Ni:Mo = 1:9)
Результаты каталитических испытаний показаны на рисунке 2. Ключевым продуктом реакции метанирования диоксида углерода является СН4, наличие которого на всех представленных спектрах определяется при значении волнового числа 2960 см–1(пик с максимальной интенсивностью). Из рисунка 2 видно, что с увеличением времени обработки катализатора Ni2Mo3N в потоке реакционной среды в продуктах реакции содержание метана увеличивается. Происходит уменьшение количества диоксида углерода в пробе по сравнению со спектром базовой линии, о чем можно судить по интенсивности характерных линий на волновых числах порядка 2400-2300 см-1. Одновременная убыль ИК-спектра СО2 и увеличения ИК-спектра СН4 свидетельствуют о прямом превращении СО2 в целевой продукт реакции.
На спектре пробы, взятой после 360 минут от начала реакции, определяются характерные линии угарного газа (CO), что является достаточно веским подтверждением его присутствия в продуктах реакции. Обратная реакция паровой конверсии СО может способствовать увеличению концентрации СО.
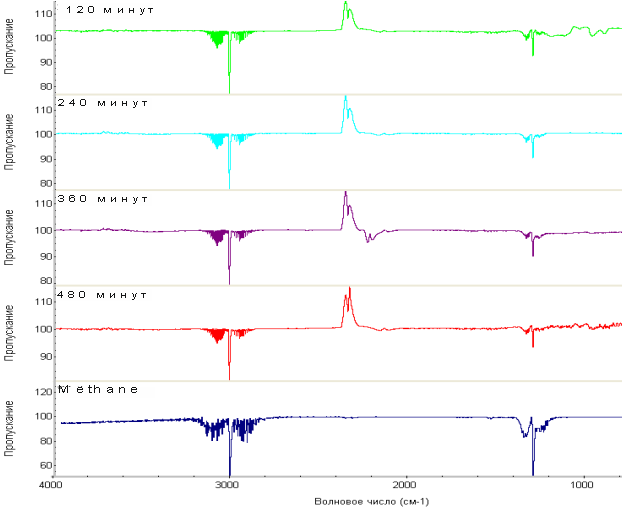
Рисунок 2. ИК-спектры газовой смеси, образующейся в процессе реакции метанирования СО2 на катализаторе Ni2Mo3N, при различных временах проведения процесса. Нижний график – спектр чистого метана
Заключение
Таким образом, для получения однофазового образца биметаллического нитрида достаточно контролировать соотношение металлических компонентов в составе растворов исходных солей. Получаемый нитрид обладает наибольшей удельной поверхностью. Также была показана возможность его использования в качестве катализатора метанирования.
Работа выполнена при поддержке ФЦП «Исследования и разработки по приоритетным направлениям развития научно-технологического комплекса России на 2007–2013 годы», ГК № 14.518.11.7031.
Рецензенты:
Ховайло В. В., д.ф.-м.н., профессор, кафедра функциональных наносистем и высокотемпературных материалов Национального исследовательского технологического университета «МИСиС», г. Москва.
Серов Г. В., д.т.н., профессор, кафедра функциональных наносистем и высокотемпературных материалов Национального исследовательского технологического университета «МИСиС», г. Москва.
Библиографическая ссылка
Лейбо Д.В., Чупрунов К.О., Кузнецов Д.В., Лёвина В.В. ИССЛЕДОВАНИЕ ОСОБЕННОСТЕЙ ФАЗООБРАЗОВАНИЯ И КАТАЛИТИЧЕСКИХ СВОЙСТВ БИМЕТАЛЛИЧЕСКОГО НИТРИДА NI2MO3N // Современные проблемы науки и образования. 2013. № 4. ;URL: https://science-education.ru/ru/article/view?id=9981 (дата обращения: 14.02.2026).



