Характерной особенностью бактерий вида Bordetella bronchiseptica (B.bronchiseptica) является фенотипическая гетерогенность колоний. Типы колоний отличаются строением и вирулентностью. Различают вирулентную (I), авирулентную (II) и промежуточную (III) фазы. Переход бактерий из одной фазы в другую происходит не только при выращивании на питательных средах, но и в живом организме в результате спонтанных мутаций [2; 5].
B.W. Lacey в своих исследованиях получил результаты, при которых колоний микроорганизма, находящихся в вирулентной фазе I, было больше при культивировании на средах Борде-Жангу и кровяном агаре, чем на простых агаровых средах [4]. Автором были сделаны выводы, что на тип фазы вирулентности, при искусственном культивировании, существенное влияние оказывает состав питательной среды. Различия в пределах II и III фаз были связаны с определенными капсульными или наружными мембранными антигенами. Характерной особенностью III фазы стало присутствие флагеллярного антигена [2; 3; 5].
Целью нашей работы явилось исследование фенотипических особенностей лабораторных и полевых штаммов B. bronchiseptica.
Материалы и методы исследований. Научные исследования проводились при финансовой поддержке государства в лице Минобрнауки России в рамках реализации ФЦП «Научные и научно-педагогические кадры инновационной России» на 2009–2013 годы (соглашение № 8267 от 10.08.2012). Исследования выполнялись в лаборатории кафедры МВЭиВСЭ ФГБОУ ВПО «Ульяновская ГСХА им. П.А. Столыпина». В работе использовались 5 референс-штаммов бактерий вида B. bronchiseptica. Учитывали специфические особенности роста бордетелл на 18-ти плотных агаровых средах. Работу проводили согласно общепринятым в микробиологии методам, используя для этого соответствующие среды и реактивы [1].
Для приготовления разработанной нами селективно-диагностической среды BBR-57 УГСХА необходимы следующие компоненты: пептон ферментативный в количестве 20,0 г/дм3; метионин - 0,3 г/дм3; цистеин - 0,3 г/дм3; никотиновая кислота - 0,1 г/дм3; цефазолина натриевая соль - 0,004 г/дм3; хлорид бария - 0,4 г/дм3; глюкоза – 0,7 г/дм3; лактоза - 0,7 г/дм3; сахароза - 0,7 г/дм3; мальтоза - 0,7 г/дм3; маннит - 0,7 г/дм3; бромтимоловый синий - 0,2 г/дм3. В дистиллированную воду добавляют все компоненты по предложенной прописи, кроме цефазолина. Компоненты растворяют и нагревают на водяной бане до кипения. Доводят рН среды 0,1 N раствором NaOH до 7,2+0,2. Среду автоклавируют при t 110-112 ºС 15 минут. Повторно измеряют рН среды и разливают по чашкам Петри.
Результаты и их обсуждение. Анализ результатов культивирования штаммов B. bronchiseptica на жидких и плотных питательных средах показал, что бордетеллы являются аэробами с оптимальной температурой культивирования 35-37 °С, при рН от 4 до 7,5.
В мясо-пептонном бульоне через 48 ч инкубации референс-штаммы бордетелл вызывали равномерное помутнение с последующим образованием осадка и пристеночного кольца.
При культивировании на плотных агаровых средах установили, что референс-штаммы B. bronchiseptica хорошо растут как на простых средах (мясо-пептонный агар), так и на обогащенных витаминами, ферментами, микроэлементами и другими питательными веществами (триптиказно-соевый, Bacto PPLO агар). Бордетеллы также показали хороший рост на селективных средах, не предназначенных для их культивирования и содержащих ингибиторы роста и другие агрессивные вещества. Был отмечен обильный рост на дифтерийной среде, среде для коринобактерий – Пизу, на менингококкагаре, на среде для иерсиний и псевдотуберкулеза, на среде для идентификации энтеробактерий - ацетатном агаре, среде Эндо. На мясо-пептонном агаре с 0,03% цетримидом и стафилококкагаре рост всех исследуемых референс-штаммов отсутствовал через 24, 48, 72 ч (таблица 1).
Таблица 1 - Оценка культивирования референс-штаммов B. bronchiseptica на агаровых средах
|
№ |
Агаровая среда |
pH среды |
Размер колоний в зависимости от срока инкубации, мм |
Реакция среды |
||
|
24 ч |
48 ч |
72 ч |
||||
|
1. |
Агар Симмонса |
7,0 ±0,2 |
0,9+0,7 |
1,3+0,4 |
2,4+0,4 |
с зеленого на синий |
|
2. |
Ацетатный агар |
6,6±0,2 |
1,5+0,5 |
2,0+0,7 |
3,5+0,5 |
с оливково-зеленого на васильковый |
|
3. |
Bacto PPLO агар |
7,0±0,1 |
1,8+0,3 |
2,5+0,5 |
4,0+0,5 |
отсутствует |
|
4. |
ББР-57 УГСХА |
7,2±0,2 |
1,5+0,5 |
2,5+0,5 |
3,5+0,5 |
с зеленого на бирюзовый |
|
5. |
Бордетелагар |
7,2±0,2 |
1,0+0,4 |
1,4+0,7 |
1,9+0,2 |
отсутствует |
|
6. |
ГРМ – агар |
7,3±0,2 |
- |
1,2±0,4 |
4,0±1,0 |
отсутствует |
|
7. |
Дифтерийная среда |
7,2±0,1 |
1,3+0,5 |
3,0+0,5 |
4,5+0,5 |
отсутствует |
|
8. |
Кровяной агар 10% |
7,2±0,1 |
- |
2,5+0,5 |
3,5+0,5 |
слабый β-гемолиз через 48 ч |
|
9. |
Казеиново-угольный агар |
7,2±0,1 |
- |
2,0+0,5 |
4,5+0,5 |
отсутствует |
|
10. |
Менингококкагар |
7,0±0,2 |
2,0+0,6 |
3,0+0,3 |
5,6+0,4 |
отсутствует |
|
11. |
Мясо-пептонный агар |
7,2±0,2 |
1,3+0,7 |
2,5±1,2 |
5,6±7,7 |
отсутствует |
|
12. |
МПА с цетримидом |
7,2 ±0,2 |
- |
- |
- |
отсутствует |
|
13. |
Среда Пизу |
7,7±0,2 |
1,7+0,3 |
2,3+0,7 |
2,5+0,8 |
среда вокруг колоний коричневая |
|
14. |
Среда Сабуро |
5,7±0,2 |
0,8+0,8 |
1,2+0,5 |
2,0+0,2 |
отсутствует |
|
15. |
Среда для иерсиний и псевдотуберкулеза |
7,7±0,2 |
1,2+0,4 |
2,0+0,7 |
2,8+0,5 |
с зеленого на синий, при открывании – запах аммиака |
|
16. |
Стафилококк агар |
7,0±0,4 |
- |
- |
- |
отсутствует |
|
17. |
Триптиказо-соевый агар |
7,2±0,1 |
1,3+0,7 |
2,3+0,4 |
3,1+0,7 |
отсутствует |
|
18. |
Среда Эндо |
7,4±0,2 |
1,3+0,7 |
2,0+0,5 |
3,5+0,5 |
отсутствует |
Появление первых колоний на агаровых средах регистрировали в основном в первые сутки выращивания через 16-24 ч. На чашках Петри образовывались мелкие росинчатые жемчужные полупрозрачные колонии, не превышающие в диаметре 2 мм. При более длительном культивировании колонии значительно увеличивались в размере.
Мы также наблюдали наличие реакции на некоторых селективных средах. На ацетатном агаре - изменение цвета среды в зоне роста колоний с оливково-зеленого на васильковый, что свидетельствовало о способности штаммов B.bronchiseptica утилизировать ацетат натрия. На питательной среде Пизу в зоне роста бактерий выделялся коричневый пигмент, показывающий наличие фермента цистиназы. Среда для иерсиний и псевдотуберкулеза при культивировании на ней бордетелл изменила цвет с зеленого на синий. При открытии чашки ощущался запах аммиака, свидетельствующий о наличии фермента уреазы. На среде Симмонса также отмечали цветовую реакцию. На разработанной нами среде BBR-57 УГСХА бордетеллы образовывали синего цвета колонии, среда изменяла цвет с зеленого на бирюзовый. При более длительном культивировании верхушка колоний приобретала темно-синюю окраску.
При культивировании на плотных средах in vitro мы регистрировали фенотипическую гетерогенность колоний. Бордетеллы в I вирулентной фазе образовывали мелкие, росинчатые, выпуклые, круглые, с ровным краем, полупрозрачные колонии с блестящей поверхностью, с четкой зоной гемолиза на средах с добавлением крови. Цвет колоний был различным в зависимости от среды выращивания. На простых средах наблюдали жемчужные, грязно-белые или сероватые колонии. Колонии были влажной консистенции, легко снимались с поверхности среды.
Бордетеллы в авирулентной III фазе образовывали большие, с ровными и шероховатыми краями, преимущественно плоские с приподнятым центром, матовой поверхностью колонии с отсутствующей зоной гемолиза. Цвет колоний на простых питательных средах был белый жемчужный или серый с голубоватым оттенком. Консистенция колоний была маслянистая, они легко снимались с поверхности среды.
Также наблюдали промежуточные варианты (фаза II): с ровными и шероховатыми краями, выпуклые и плоские, блестящие и матовые, белые и серые колонии. Типы колоний соответствовали разным фазам инфекционного цикла микроорганизма.
Морфологические признаки вирулентных референс-штаммов на различных агаровых средах представлены в таблице 2.
Таблица 2 – Морфологическая характеристика колоний вирулентных референс-штаммов B. bronchiseptica
|
№ |
Питательная среда |
Форма |
Величина |
Профиль |
Цвет |
Блеск |
Край |
Консистенция |
Прозрачность |
|
1. |
Агар Симмонса |
круглая |
мелкие |
выпуклые |
ржавые или белые |
есть |
ровный |
мягкая, маслянистая |
непрозрачные |
|
2. |
Ацетатный агар |
округлая |
росинчатые |
выпуклые |
белые |
есть |
ровный |
маслянистая |
полупрозрачные |
|
3. |
Bacto PPLO агар |
круглая |
мелкие |
слегка конические |
серовато-белые |
есть |
ровный |
мягкая |
полупрозрачные |
|
4. |
BBR-57 УГСХА |
круглая |
мелкие |
слегка конические |
бирюзовые |
есть |
ровный |
вязкая |
непрозрачные |
|
5. |
Бордетелагар |
округлая |
росинчатые |
куполообразные |
серо-белые |
есть |
ровный |
маслянистая |
полупрозрачные |
|
6. |
ГРМ – агар |
круглая |
мелкие |
слабо выпуклые |
серовато-белые |
есть |
ровный |
влажная |
непрозрачные |
|
7. |
Дифтерийная среда |
круглая |
мелкие |
слегка конические |
серовато-белые |
есть |
ровный |
маслянистая |
полупрозрачные |
|
8. |
Кровяной агар 10% |
круглая |
росинчатые |
слегка конические |
белые |
есть |
ровный |
маслянистая |
непрозрачные |
|
9. |
Казеиново-угольный агар |
круглая |
росинчатые |
куполообразные |
серо-белые |
есть |
ровный |
маслянистая |
полупрозрачные |
|
10. |
Менингококкагар |
круглая |
мелкие |
выпуклые |
грязно-белые |
есть |
ровный |
мягкая |
полупрозрачные |
|
11. |
Мясо-пептонный агар |
круглая |
мелкие |
слабо выпуклые |
серовато-белые |
есть |
ровный |
маслянистая |
непрозрачные |
|
12. |
Среда Пизу |
круглая |
росинчатые |
слегка выпуклые |
с темным центром |
есть |
ровный |
мягкая |
полупрозрачные |
|
13. |
Среда Сабуро |
округлая |
росинчатые |
выпуклые |
грязно-белые |
есть |
ровный |
маслянистая |
полупрозрачные |
|
14. |
Среда для иерсиний и псевдотуберкулеза |
круглая |
мелкие |
слегка выпуклые |
беловатые |
есть |
ровный |
мягкая |
непрозрачные |
|
15. |
Триптиказо-соевый агар |
округлая |
росинчатые |
слегка конические |
серовато-белые |
есть |
ровный |
мягкая |
полупрозрачные |
|
16. |
Эндо |
круглая |
росинчатые |
слегка конические |
грязно-белые |
есть |
ровный |
мягкая |
непрозрачные |
При длительном культивировании, многократных пассажах наблюдали формирование колоний разных морфологических типов и больших размеров (рис. 1-2).
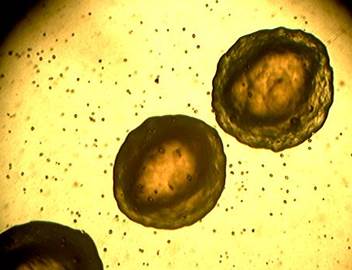
Рис. 1. Типичного размера колонии референс-штамма 22-067 B. bronchiseptica на основе кровяного агара через 72 ч (х4)
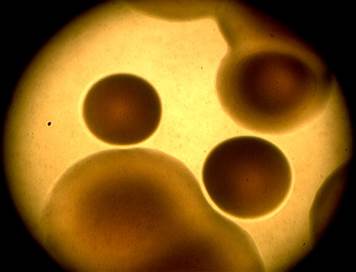
Рис. 2. Колонии референс-штамма B. bronchiseptica 22-067 на менингококкагаре через 72 ч (×4)
При длительном культивировании наблюдали переход бордетелл в слабовирулентную фазу II и авирулентную фазу III и значительное увеличение размера колоний (рис. 3, 4).
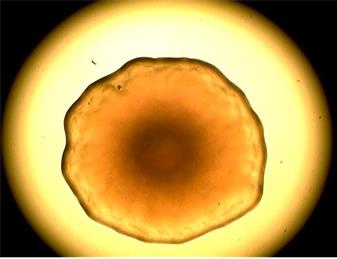
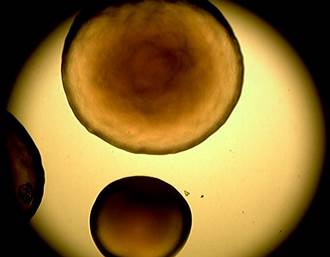
Рис. 3, 4. Крупные колонии референс-штамма B. bronchiseptica 22-067 на основе кровяного агара через 72 ч (×4)
При культивировании референс-штаммов B. bronchiseptica на 10%-ном кровяном агаре при температуре 37 °С в течение 48 ч наблюдали зону β-гемолиза. Данный агар можно использовать для культивирования бордетелл в вирулентной фазе I. При снижении температуры культивирования до 25 °С регистрировали мутационный переход из вирулентной в авирулентную фазу.
Выводы. Результаты проведенных исследований показали, что фенотипические особенности штаммов B. bronchiseptica эффективно изучать при выращивании их на плотных агаровых средах. Бордетеллы не требовательны к условиям роста, хорошо культивируются на обычных агаровых средах (МПА), обильнее - на средах, обогащенных питательными веществами, витаминами, ферментами и микроэлементами (КУА, бордетелагар), также растут на селективных средах, содержащих ингибиторы роста и другие агрессивные вещества (среда Пизу, менингококкагар и др.).
Биологической особенностью штаммов B. bronchiseptica является их фенотипическая вариабельность, обусловленная течением инфекционного цикла. При культивировании вирулентных штаммов бордетелл на плотных средах образуются мелкие, росинчатые, выпуклые, круглые, с ровным краем, полупрозрачные колонии с блестящей поверхностью, с четкой зоной гемолиза. Бордетеллы в авирулентной фазе формируют большие, с ровными и шероховатыми краями, преимущественно плоские с приподнятым центром, матовой поверхностью колонии с отсутствующей зоной гемолиза. Имеются промежуточные варианты. Переход из вирулентной в авирулентную фазу происходит при длительном культивировании, многократных пассажах, снижении температуры выращивания до 25 °С.
Рецензенты:
Васильев Дмитрий Аркадьевич, доктор биологических наук, профессор, директор ООО «Научно-исследовательский инновационный центр микробиологии и биотехнологии», Ульяновская область, Чердаклинский р-н, пос. Октябрьский.
Золотухин Сергей Николаевич, доктор биологических наук, профессор кафедры микробиологии, вирусологии, эпизоотологии и ВСЭ ФГБОУ ВПО «Ульяновская государственная сельскохозяйственная академия имени П.А. Столыпина», г. Ульяновск.
Библиографическая ссылка
Васильева Ю.Б. ОСОБЕННОСТИ БИОЛОГИИ БАКТЕРИЙ ВИДА BORDETELLA BRONCHISEPTICA // Современные проблемы науки и образования. 2013. № 4. ;URL: https://science-education.ru/ru/article/view?id=9927 (дата обращения: 16.01.2026).



