1. Введение
Регенеративная медицина нуждается в создании и использовании новых классов биорезорбируемых материалов с высокими механическими характеристиками, обладающих биологической активностью и способствующих восстановлению костных дефектов с последующим полным рассасыванием на нетоксичные компоненты.
Множество как зарубежных, так и отечественных разработок, посвященных созданию биорезорбируемых материалов с высокими механическими свойствами, используют в качестве полимерной основы полилактид (ПЛК), полигликолид и полигидроксиалканоаты (ПГА), обладающие биоразрушаемостью и биосовместимостью. Самым распространённым из семейства ПГА является полигидроксибутират (ПГБ) [1]. ПГБ используется для инженерии костной ткани, так как способствует благоприятной адаптации костной ткани без признаков нежелательного хронического воспалительного ответа после имплантации [4]. Для увеличения остеоинтегративных свойств в качестве биоактивной керамики чаще всего используется дисперсный гидроксиапатит (ГАП).
Особый интерес представляет введение в имплантат наносеребра. Наночастицы серебра имеют антибактериальные свойства. Их способность высвобождать ионы серебра в контролируемом количестве приводит к мощной антибактериальной активности в отношении большого числа бактерий [9]. Низкие концентрации наночастиц серебра способны индуцировать поверхностные морфологические изменения в полимерной матрице и влиять на смачиваемость поверхности нанокомпозита и шероховатость. Все эти аспекты могут повлиять на процесс бактериальной адгезии на поверхности нанокомпозитов.
2. Материалы и методика эксперимента
В качестве материала для биорезорбируемой матрицы использовали порошок полимера гидроксимасляной кислоты (полидроксибутират, ПГБ) торговой марки «БИОПЛАСТОТАН» производства ООО «БИОПЛАСТ» (г. Красноярск). В качестве биоактивного наполнителя использовали дисперсный порошок гидроксиапатита (ГАП) производства ЗАО «НПП ПОЛИСТОМ» плотностью 3,25 г/см3. В качестве антимикробного агента использовали коллоидный раствор серебра с размером частиц 10-15 нм.
Смеси порошков ПГБ и ГАП подвергали механическому смешению на ножевой мельнице IKA A11 со скоростью 25000 об/мин в течение 5 минут. Степень наполнения составила 20% масс., что соответствует оптимальному составу по сочетанию механических и регенеративных свойств [6].
Термопрессование механической смеси и получение изделий из порошковых композитов проводили с помощью гидравлического пресса MEGA KSC-10A с нагревом в течение 40 мин до 175 ºС, выдержкой при этой температуре в течение 10 мин и последующим горячим прессованием и охлаждением под давлением. Порошковый композит помещали уже в нагретую пресс-форму. Давление при прессовании выбиралось исходя из анализа пористости и структуры материала изделия. Так как для свободного проникновения клеток ткани в материал имплантата требуется размер пор от 50 до 500 мкм, то было выбрано давление 0,5 МПа для получения пористых изделий.
Антимикробный агент, коллоидное серебро, с концентрацией 17 мг/л вводили методом пропитки с последующими выпариванием воды. Время пропитки составило 3 ч.
Исследование формы и размеров частиц порошков и пористости компактированных образцов проводили на сканирующем электронном микроскопе Hitachi TM-1000 (Япония) с ускоряющим напряжением 5–20 кВ. Расчет объемной пористости образцов осуществлялся с использованием следующего соотношения:
П = (1 - Мпор/Мспл) × 100%, (1)
где Мпор – измеренная масса пористого образца, а Мспл – расчетная масса сплошного непористого образца того же объема.
Для определения плотности готовили серию образцов с размером 10×10×1 мм. Плотность ПГБ составляла 1,25 г/см3, а ГАП – 3,25 г/см3. Размеры образцов определялись микрометром, а масса на аналитических весах AND GR-202 (точность 0.1 мг/ 42 г, 0.01 мг).
Как известно, ПГБ склонен деградировать в среде живого организма и разлагаться на низкомолекулярные соединения [5]. Это ведет к количественному и качественному изменению химических связей, а, следовательно, и всей структуры материала имплантата.
Исследования компактированных образцов пористых изделий на основе полимерных композитов ПГБ+20%ГАП после имплантации лабораторным мышам методом ИК-спектроскопии проводили с помощью ИК-Фурье спектрометра Nicolet 380 (спектральный диапазон 4000-450 см-1, разрешение 0,9 см-1, точность по волновому числу 0,01 см-1). Для проведения качественного анализа использовался метод нарушенного полного внутреннего отражения (НПВО) [2]. В частности, исследованы структурные изменения со стороны имплантированного материала как результата прямой реактивности тканей макроорганизма на имплантированный материал, что, как известно, может обусловить его деструкцию. Проводилась ортотопическая трансплантация образцов линейным лабораторным мышам Balb/c (n=15) (масса тела 20 ± 2 г) в РОНЦ им. Н.Н. Блохина. Образцы имплантатов представляли собой пластинки из композиционных материалов ПГБ+20%ГАП, размером 4×4 мм, изготовленные методом термического прессования и последующей низкоскоростной резки.
Образцы изымались из организма мышей через 30 суток. После изъятия из организмов мышей образцы были промыты 2 раза дистиллированной водой и очищены от тканей организма. Сравнение ИК-спектров проводилось с ИК-спектром контрольного материала изделия, не подвергнутого имплантации в живой организм.
3. Результаты и их обсуждение
Как видно из рисунка 1а, исходный порошок ПГБ представляет собой крупные чешуйки и полые трубки длиной до 500 мкм и диаметром до 50 мкм. Смешивание ПГБ и ГАП в мельнице приводит к равномерному распределению керамических частиц по поверхности полимерных частиц, при этом сохраняется дисперсность ПГБ, но наблюдаются незначительные агрегаты частиц ГАП, как это видно на микрофотографии рис. 1б. Размер таких агрегатов не превышает 2 мкм.
Установлено, что использованные в настоящей работе режимы перемешивания и последующего термического прессования обеспечивают получение экспериментальных образцов с достаточно хорошей однородностью распределения наполнителя по матрице. Процесс перемешивания происходит в процессе механического воздействия, при этом наблюдается сравнительно неплохая адгезия частиц наполнителя к матрице за счет формирования сетки твердого наполнителя на поверхности полимерной частицы.
а) б)
б) 
Рисунок 1 – Исходный ПГБ порошок при увеличении ×180 (а), механическая смесь ПГБ + 20% ГАП при увеличении ×4000 (б)
Как показывают микрофотографии, приведенные на рис. 2, разработанный метод термического прессования позволяет получать пористые объемные образцы с широким распределением размера пор от 10 до 500 мкм. Как это хорошо видно на рис. 2а, поры являются открытыми и сопряжены между собой сетью каналов и полостей. Все это позволяет клеткам формирующейся ткани зацепляться за поверхность имплантата, выполненного из такого материала, и свободно проникать внутрь через поры и прорастать через пустоты.
Пропитка компактированного пористого ПГБ/ГАП коллоидным раствором серебра не приводит к изменению макроструктуры композита, как это видно на рис. 2б. Наносеребро после высушивания равномерно распределяется по поверхности образца и по стенкам открытых пор без значительного изменения дисперсности. Это позволяет наносеребру без помех осуществлять роль антимикробного агента.
Средняя объемная пористость образцов составила 53%. Наличие высокой пористости подтверждается также результатами электронной микроскопии. На микрофотографиях композита ПГБ/ГАП, представленных на рис. 2 а, б, видны открытые поры с размером до 500 мкм с распределенным по их поверхности биоактивным наполнителем. Такая пористость и структура композита позволяет поддерживать образование костной ткани в объеме полимерного матрикса и способствует прикреплению клеток и их миграции, что обеспечивает распространение жизненно важных питательных веществ в клетки.
а)  б)
б)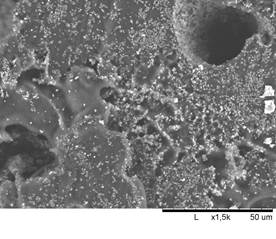
Рисунок 2 – Структура пористого образца ПГБ при увеличении ×150 (а); структура пористого композита ПГБ + 20%ГАП + Ag (17 мг/л) (б)
Было проведено сравнение внешнего вида образцов изделий из пористого композита ПГБ+20%ГАП, полученных методом механического смешения с последующим термопрессованием, вид которых представлен на рис. 3а, с образцами после имплантации мышам на 30 дней (рис. 3б).
а)  б)
б) 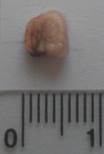
Рисунок 3 – Образцы изделий из пористого композита ПГБ+20%ГАП до имплантации (а) и после имплантации в организм лабораторных мышей на 30 суток (б)
Образцы после имплантации изменили цвет. Пожелтение связано с деградацией полимерной матрицы. Изменились также и геометрические размеры. Это связано не только с рассасыванием ПГБ матрицы, но с тем, что расходуется биоактивный наполнитель – ГАП.
Скорость биодеструкции в значительной степени зависит от «доступности» агрессивных сред к лабильным химическим связям в макромолекуле, что, в первую очередь, зависит от гидрофильности поверхности материалов, их надмолекулярной организации и макроструктуры, а также от природы реагента. В связи с наличием развитой пористой структуры (объемное содержание пор >30%, размер пор от 50 до 500 мкм) имплантаты ПГБ/ГАП имеют большую удельную поверхность, что упрощает доступ среды организма, ферментов к поверхности материала. За счет наноразмеров частицы ГАП также имеют избыточную поверхностную энергию и могут в большей степени проявлять биологическую активность.
На ИК-спектре композита ПГБ+20%ГАП (рис. 4) до имплантации присутствуют основные линии, соответствующие ПГБ и ГАП [10]. Основные колебания группы PO43- соответствуют линиям 1092 см-1, 1031 см-1, 961 см-1 и отвечают симметричным, асимметричным и валентным колебаниям P-O [7]. Полосы 1277, 1230 и 1180 см-1 отнесены к валентным колебаниям C-О-C эфирных групп [8]. Изменений в положения пиков карбонильных и эфирных связей не найдено.
На ИК-спектре изделия из композиционного материала ПГБ+20%ГАП после имплантации в организм лабораторным мышам наблюдается количественное изменение химических связей, что отражается в относительном изменении длины линий. Сильно увеличивается высота пика 1720 см-1, характеризующая колебания эфирных групп. Появляются новые полосы 722 см-1, 2975 см-1, соответствующие образованию кетонов и эфиров масляной кислоты. Линии в области 1540 см-1 соответствуют кетонам, но возможно также присутствие карбонапатитов [3].
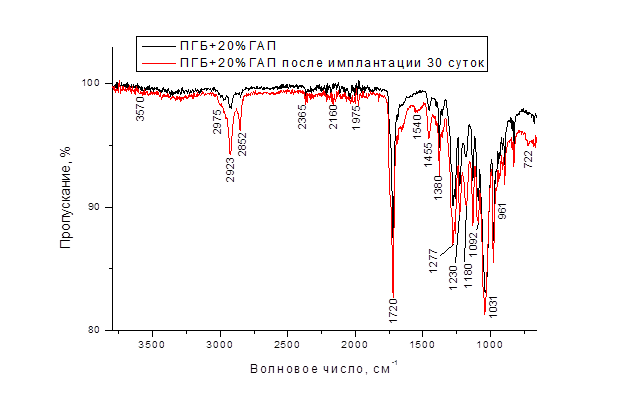
Рисунок 4 – ИК-Фурье спектр изделия из композиционного материала ПГБ+20%ГАП до (черный) и после (красный) имплантации в организм лабораторным мышам
4. Заключение
Исследования показали, что смешивание ПГБ и ГАП в ножевой мельнице приводит к равномерному распределению наполнителя, при этом сохраняется дисперсность ПГБ; разработанный метод термического прессования позволяет получать пористые объемные образцы с высокой объемной долей пор, более 30%, широким распределением размера пор от 10 до 500 мкм с распределенным по стенкам и поверхности биоактивным наполнителем. При этом поры являются открытыми и сопряжены между собой сетью каналов и полостей. Показано, что пропитка компактированного пористого ПГБ/ГАП коллоидным раствором серебра приводит к равномерному распределению по поверхности образца и по стенкам открытых пор без значительного изменения дисперсности.
После имплантации в организм мышам на 30 суток наблюдается изменение структуры ПГБ матрицы, связанное с биодеструкцией.
Работа выполнена в рамках федеральной целевой программы «Исследования и разработки по приоритетным направлениям развития научно-технологического комплекса России на 2007-2013 годы», Государственный контракт от 07 марта 2013 г. № 14.512.11.0009.
Рецензенты:
Астахов М.В., д.х.н, профессор, заведующий кафедрой физической химии НИТУ «МИСиС», г. Москва.
Калошкин С.Д., д.ф-м.н, профессор, директор Института новых материалов и нанотехнологий НИТУ «МИСиС», г. Москва.
Библиографическая ссылка
Сенатов Ф.С., Чердынцев В.В., Сенатова С.И. СТРУКТУРА ПОРИСТЫХ КОМПОЗИЦИОННЫХ МАТЕРИАЛОВ НА ОСНОВЕ ПОЛИГИДРОКСИБУТИРАТА ДЛЯ ТКАНЕВОЙ ИНЖЕНЕРИИ // Современные проблемы науки и образования. 2013. № 4. ;URL: https://science-education.ru/ru/article/view?id=9883 (дата обращения: 03.02.2026).



