Соединения, соответствующие формуле [Ме2+1-х М3е+х(ОН)2][(Аn-1)x/n× mH2O] с ромбоэдрической ячейкой, называются слоистыми двойными гидроксидами гидроталькитного ряда. При получении слоистых двойных гидроксидов гидроксидные слои могут чередоваться двумя разными способами, образуя структуру с двумя политипами с ромбоэдрической (симметрия 3R) и гексагональной элементарной ячейкой (симметрия 2H). Многие из слоистых двойных гидроксидов кристаллизуются в структуре с ромбоэдрической ячейкой, которая называется гидроталькит - природный минерал состава Mg6Al2(OH)16[CO3 ×4H2O] (соединение, относящееся к группе с симметрией R3m). В представленной работе исследован структурный тип гидроксоалюмината магния. Показано, что образуются структуры с формулой Mg6 Al2 (OH)18 ·4,5 H2O. Параметры гексагональной кристаллической решетки (пкр) целевой фазы: а= 3,056(3) Å, с=23,53 (4) Å. Такие значения соответствуют величине параметра для структуры мейкснеритаMg6Al2 (OH)18 ∙4H2O (пкр этой фазы по JPDS 35-965: а= 3,054 Å, с=23,40 Å). Данные соединения кристаллографически описываются в ромбоэдрической системе с пространственной группой R-3m. Следовательно, предложенное количественное соотношение металлов Mg2+ и Al3+в исходной суспензии, время и температура синтеза являются оптимальными для получения гидроксоалюмината магния.
Введение. Слоистые двойные гидроксиды (СДГ) - это соединения, отвечающие составу и структуре: [Ме2+1-х Ме3+х(ОН)2][(Аn-1)x/n× mH2O]. Строение слоистых двойных гидроксидов - комплекс из положительно заряженных гидроксидных слоев (Ме2+1-х Ме3+х(ОН)2)x+ и анионов, находящихся между слоями. Помимо Аn-в межслоевом пространстве могут присутствовать подвижные молекулы воды. Гидроксидные слои (Ме2+1-х Ме3+х(ОН)2)x+ представляют собой плоскую систему из катионов Ме2+ и Ме3+, октаэдрически координированных гидроксогруппами [1,2,5]. Их структура аналогична структуре брукита Mg(OH)2 [2]. Слои несут избыточный положительный заряд, пропорциональный количеству в них катиона Ме3+. Слоистые двойные гидроксиды устойчивы за счет притяжения между (Ме2+1-х Ме3+х(ОН)2)x+и анионами между слоями, которые несут отрицательный заряд. Гидроксидные слои могут чередоваться двумя разными способами, образуя структуру с двумя политипами с ромбоэдрической (симметрия 3R) и гексагональной элементарной ячейкой (симметрия 2H) [1,2,3]. Многие из слоистых двойных гидроксидов кристаллизуются в структуре с ромбоэдрической ячейкой, которая называется гидроталькит - природный минерал Mg6Al2(OH)16[CO3 ×4H2O] (соединение, относящееся к группе с симметрией R3m) [3,5]. Такие соединения, соответствующие формуле [Ме2+1-х М3е+х(ОН)2][(Аn-1)x/n× mH2O] с ромбоэдрической ячейкой, называются слоистыми двойными гидроксидами гидроталькитного ряда. В лабораторных условиях возможно получить образцы со строением x = 0.05÷0.4 и m = 0÷2 [1,2,3,5].
Параметры элементарной ячейки в СДГ со структурой гидроталькита могут значительно варьироваться. Изменение параметра а, зависящее от количественного соотношения металлов Mе2+ и Ме3+и величины ионных радиусов, происходит в интервале от 2,8 до 4,1 Å [5]. Значение параметра с определяется в основном размером аниона Аn-. Необходимо отметить, что расположение анионов в межслоевом пространстве может быть различным. В зависимости от условий синтеза и состава СДГ всегда образуется только один структурный тип [6]. Анионные комплексы в основном располагаются между слоями так, чтобы свести его размер к минимуму [7]. Обычно величина параметра с и размер аниона определяют реализуемый тип структуры в том или ином случае.
Степень кристалличности свежеосажденных двойных гидроксидов повышают термостатированием при t ºC = 60-90 ºС в течение 10-250 часов. Данные параметры зависят от природы и состава СДГ. Например, магний-алюминиевые двойные гидроксиды (размеры кристаллов >50 мкм) образуются после 10 часов выдержки при t ºC = 70 ºC. Образование же литий-алюминиевых двойных гидроксидов требует выдержки при 90 ºС в течение 150 часов. Конечным этапом получения образцов является промывание образцов водой до полного отсутствия катионов и анионов в маточном растворе с последующим высушиванием [2,3].
В данной работе синтезирован СДГ и определен структурный тип гидроксида в зависимости от выбранных оптимизированных условий синтеза: различное соотношение концентраций исходных растворов, время синтеза - 2 часа и температура 100 ºС.
Целью работы явилось исследование полученного структурного типа гидроксоалюмината магния (ГАМ) формулыMg6Al2(OH)18∙4,5H2O.
Материалы и методы
Синтез ГАМ происходил в соответствии со следующими уравнениями реакции:
2Al+2NaOH + 6H2O→2Na[Al(OH)4] + 3H2↑ (1)
6MgCl2 + 2Na[Al(OH)4]+10NaOH + 4,5H2O→Mg6Al2(OH)18∙4,5H2O +12NaCl(2)
При получении каждого образца изменялось соотношение концентраций алюмината натрия и хлорида магния за счет изменения концентрации раствора - осадителя (раствора хлорида магния), таблица 1.
Таблица 1. Нумерация образцов ГАМ в зависимости от соотношения растворов в исходной суспензии
|
Номера образцов ГАМ |
Концентрации алюминатного раствора и хлорида магния соответственно |
Соотношение концентраций алюминатного раствора и хлорида магния |
Общий объем суспензий реагентов, мл |
|
Mg6 Al2 (OH)18 (1) |
0,01 М - 0,01 М |
1:1 |
685,14 |
|
Mg6 Al2 (OH)18 (2) |
0,01 М - 0,0078 М |
1:0,78 |
799,33 |
|
Mg6 Al2 (OH)18 (3) |
0,01 М - 0,0067 М |
1:0,67 |
913,52 |
|
Mg6 Al2 (OH)18 (4) |
0,01 М - 0,0059 М |
1:0,59 |
1027,71 |
|
Mg6 Al2 (OH)18 (5) |
0,01 М - 0,0052 М |
1:0,52 |
1141,90 |
К полученному по уравнению (1) раствору алюмината натрия медленно приливали раствор хлорида магния заданной концентрации. Смесь термостатировали при 100 ºС в течение 2 часов, перемешивая магнитной мешалкой на протяжении всего времени синтеза и поддерживали значение рН = 9±0,1. Получившиеся в процессе реакции (2) белые взвеси фильтровали с помощью вакуумного насоса. Далее осадки заливали дистиллированной водой, нагревали до 100 ºС, постоянно перемешивая магнитной мешалкой. Далее суспензии снова фильтровали, и так повторяли 5 раз. После окончания промывания сушили осадки при 110 ºС в сушильном шкафу до постоянной массы. Состав получившихся осадков изучали с помощью рентгенофазового анализа (РФА) на рентгеновском дифрактометре ДРОН-3М с использованием немонохроматизированного медного Кα излучения (Ni фильтр). Образцы для рентгенографирования готовили в стандартных кварцевых кюветах, к образцу (1) был подмешан порошок алмаза в качестве внутреннего стандарта. Качественный фазовый анализ проводили с использованием базы дифракционных данных JCPDS [4,8].
Результаты исследования и их обсуждение
Исходя из данных, полученных методом РФА, видно, что все полученные образцы имеют набор рефлексов, соответствующий СДГ. Данные параметров гексагональной кристаллической решетки (пкр) целевой фазы Mg6 Al2 (OH)18 ·4,5 H2 O равны: а= 3,056(3) Å, с=23,53 (4) Å. такие значения параметра с соответствуют величине параметра для структуры мейкснеритаMg6Al2 (OH)18 ∙4H2O (пкр этой фазы по JCPDS 35-965:а= 3,054 Å, с=23,40 Å).
а) 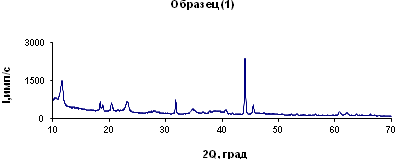
б) 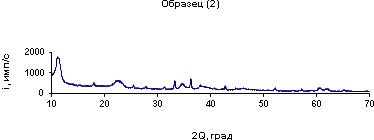
в) 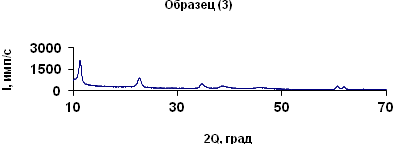
г) 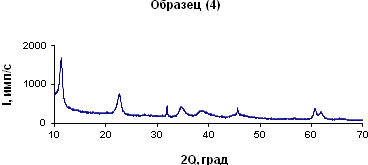
д) 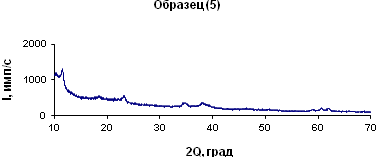
Рисунок 2. Данные РФ: а)Mg6Al2 (OH)18 (1); б)Mg6Al2 (OH)18 (2); в)Mg6Al2 (OH)18 (3); г)Mg6Al2 (OH)18 (4); д)Mg6Al2 (OH)18 (5)
Судя по данным, имеющимся в химической и минералогической литературе, а также базам данных рентгеновской дифракции (JCPDS), окончательно химическая формула минерала мейкснерита к настоящему времени не установлена. Ее представляют как Mg6Al2(OH)18·4H2O(I) или Mg6Al2(OH)18·4,5H2O(II), а также Mg4Al2(OH)14·3H2O(III), либо даже рядом других формул. В частности, соединения I-III кристаллографически описываются в ромбоэдрической системе с пространственной группой R-3m и весьма близкими параметрами кристаллической решетки, а=3,038-3,054 и с=22,62-23,40 Å. Достоверно кристаллическая структура этих фаз, насколько нам известно, не определена. По-видимому, они представляют серию фаз, имеющих близкое кристаллическое строение. По наиболее частому определению мейкснерит относят к гидроксильному слоистому двойному гидроксиду, не содержащему карбонат-иона.
Заключение
Данные РФА показали, что в результате предложенного синтеза во всех пяти вариантах образуются структуры с формулой Mg6Al2(OH)18·4,5H2O. Параметры гексагональной кристаллической решетки (пкр) целевой фазы: а= 3,056(3) Å, с=23,53 (4) Å. Такие значения параметра с соответствуют величине параметра для структуры мейкснерита Mg6Al2 (OH)18 ∙4H2O (пкр этой фазы по JPDS 35-965: а= 3,054 Å, с=23,40 Å). Данные соединения кристаллографически описываются в ромбоэдрической системе с пространственной группой R-3m. Следовательно, предложенное количественное соотношение металлов Mg2+ и Al3+в исходной суспензии, время и температура синтеза являются оптимальными для получения гидроксоалюмината магния.
Рецензенты:
Давыдова О. А., д-р хим. наук, профессор кафедры химии ФГБОУ ВПО «Ульяновский государственный технический университет», г. Ульяновск.
Климов Е. С., д-р хим. наук, профессор, заведующий кафедрой химии ФГБОУ ВПО «Ульяновский государственный технический университет», г. Ульяновск.
Библиографическая ссылка
Миронычева Т.С., Михеева Л.А., Иванова Л.А., Терехина Н.В., Бочкова В.Е. ИЗУЧЕНИЕ ЗАКОНОМЕРНОСТЕЙ СИНТЕЗА ГИДРОКСОАЛЮМИНАТА МАГНИЯ // Современные проблемы науки и образования. 2013. № 4. ;URL: https://science-education.ru/ru/article/view?id=9881 (дата обращения: 14.02.2026).



