Введение
В настоящее время ни у кого не вызывает сомнений многофакторность природы воспалительных заболеваний пародонта (ВЗП), однако ведущая роль по-прежнему отводится патогенному воздействию супра- и субгингивальной пародонтальной микрофлоры [3]. Часто наблюдаемая на практике низкая эффективность применяемой этиотропной терапии ВЗП связана, как полагают, с высокой скоростью адаптации микрофлоры полости рта к используемым антибактериальным препаратам. Очевидно, что решением данной проблемы может быть использование препаратов, обладающих не только антибактериальной активностью, но и иммунокоррегирующими свойствами, позволяющими активизировать местный иммунитет и за счет этого повысить устойчивость тканей пародонта к действию агрессивной микрофлоры.
В последние годы в стоматологическую практику все чаще внедряются различные композиции, включающие в свой состав соли аскорбиновой кислоты и хитозана - аскорбаты хитозана - в различных концентрациях [1; 3; 10]. Хитозан (2-амино-2-дезокси-β-D-глюкан, ХТЗ) – это полимер, получаемый из компонента экзоскелета членистоногих хитина путем частичного или полного деацетилирования. Этот полисахарид обладает выраженным иммунотропным действием, а также антибактериальной, антиоксидантной, детоксикационной и ранозаживляющей способностью [2; 11]. Однако на данный момент крайне мало известно о механизме модуляции иммунного ответа этими биологически активными веществами.
Одним из объективных критериев контроля эффективности проводимого лечения может служить мониторинг колебаний уровня про- и противовоспалительных цитокинов. Как известно, ИЛ-1 β и ФНО-α являются цитокинами первой линии реагирования и в ответ на агрессию пародонтопатогенных микробов способны инициировать высвобождение медиаторов острой воспалительной реакции, в том числе хемокина ИЛ-8. Высокая концентрация ИЛ-8 в очаге воспаления способствует прилипанию нейтрофилов к эндотелиальным клеткам и субэндотелиальным матричным белкам, благодаря чему обеспечивается диапедез этих лейкоцитов сквозь эндотелий посткапиллярных венул и их миграция к месту проникновения патогенов [8].
У больных ВЗП наблюдается повышенная плотность нейтрофильных гранулоцитов в зоне поражения, однако их функциональная активность относительно невысока. Для полноценной активации зрелых нейтрофилов требуются высокие концентрации ИЛ-1β, являющегося их праймирующим фактором. Способность нейтрофилов отвечать только на высокие концентрации ИЛ-1β обусловлена низкой экспрессией на их поверхности функционально активных рецепторов к ИЛ-1β I типа (IL-1RI), связывание с которыми вызывает быстрое включение MKK3/p38 MAPK каскада, высвобождение супероксидного аниона и экспрессию поверхностных молекул CD11b/CD18 и CD15 [9]. Однако избыточное количество провоспалительных цитокинов ФНО-α и ИЛ-1β в тканях пародонта вызывает гиперактивацию остеокластов, что в свою очередь приводит к дегенеративно-деструктивным поражениям кости альвеолярного отростка [5].
Существует ряд естественных механизмов контроля воспалительной реакции и предотвращения повреждения тканей, вызванного избыточным высвобождением цитотоксичных продуктов в результате массовой дегрануляции фагоцитов. В частности, активированные нейтрофилы под действием провоспалительных стимулов начинают продуцировать цитокин ИЛ-1ра – специфичный антагонист интерлейкина 1β, способный связывать его рецепторы и тем самым полностью предотвращать стимулирующее и праймирующее действие ИЛ-1β на нейтрофилы [6].
Цель исследования: изучить механизмы воздействия гелеобразного препарата 8%-ного аскорбата ХТЗ на состояние местного иммунитета при воспалении пародонта.
Материал и методы
В качестве объекта исследования была использована десневая жидкость 20 здоровых доноров-добровольцев, жидкость десневых карманов, полученная от 20 пациентов с хроническим катаральным гингивитом, и жидкость пародонтальных карманов 50 пациентов с хроническим генерализованным пародонтитом легкой и средней степени (по 25 человек, соответственно). Клиническое состояние тканей пародонта оценивали с помощью индексов: гигиенического (ГИ), пародонтального (ПИ), папиллярно-маргинально-альвеолярного (РМА), кровоточивости десневого края (I. Muhlemann, 1971). Состояние костной ткани межзубных перегородок оценивали по данным внутриротовой рентгенографии. Всем пациентам проводили традиционную комплексную терапию с ежедневными аппликациями противовоспалительного препарата 8%-ного аскорбата хитозана на область сосочков и краевой десны с захватом 1-2 см слизистой оболочки альвеолярного отростка у больных с гингивитом и, дополнительно, инстилляции в пародонтальные карманы у больных пародонтитом. Продолжительность ежедневных обработок составляла 15 минут в течение 8 дней. Контроль за динамикой изменения концентрации цитокинов (ИЛ-1β, ИЛ-8, ФНО-α и ИЛ-1ра) в жидкости карманов (ЖК) осуществляли методом твердофазного иммуноферментного анализа с помощью реагентов производства ЗАО «Вектор-Бест» (Новосибирск, Россия). Результаты учитывали на анализаторе StatFax 4200 («Awareness Technology», США). Статистическую обработку данных проводили с использованием программного пакета Statistica v.6.0.
Результаты и обсуждение
Оценка состояния местного иммунитета у пациентов с воспалительными заболеваниями пародонта после проведенного лечения позволила выявить ряд закономерностей. Прежде всего следует отметить, что до начала и в первые дни лечения средние концентрации провоспалительных цитокинов ФНО-α, ИЛ-1β и ИЛ-8 в ЖК пациентов с воспалением пародонта статистически достоверно превышали норму (табл. 1). Однако к моменту клинического выздоровления уровни этих цитокинов в ЖК изменялись разнонаправленно. В частности, значения концентраций ФНО-α у всех групп больных оказались существенно ниже уровня контрольной группы (р<0,05). Средние концентрации ИЛ-1β во всех трех группах также достоверно снизились, тем не менее, они оставались выше по сравнению с таковыми в группе контроля. Концентрация ИЛ-8 в ЖК пациентов с хроническим гингивитом после проведенной терапии снизилась в 0,9 раз (р<0,05), в ЖК пациентов с ХГП легкой степени возросла в 1,2 раза (р<0,05) и практически не изменилась в группе пациентов с ХГП средней степени (р>0,05). При этом отсутствовало статистически достоверное различие между установившимися после лечения значениями концентраций ИЛ-8, а их уровень в 1,8-2 раза превышал норму (р<0,05). Важно отметить, что повышенная концентрация хемокина ИЛ-8 в ЖК пациентов всех трех групп сохранялась в процессе лечения на фоне чрезвычайно низкого уровня ФНО-α и высоких значений ИЛ-1β. Этот факт свидетельствует в пользу того, что мы наблюдали вторую (позднюю) фазу инициации продукции ИЛ-8 в ответ на стимуляцию нейтрофилов высокими концентрациями не ФНО-α, а ИЛ-1β.
Концентрации противовоспалительного цитокина ИЛ-1ра в ЖК пациентов всех групп до начала лечения были в 1,3-2 раза ниже нормы (р<0,05), в то время как по окончании курса лечения они возросли до нормальных значений (р>0,05) (табл. 1).
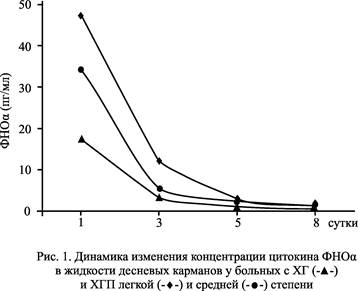
Изучение динамики колебания концентрации цитокина ФНО-α в ЖК выявило ее корреляцию с изменениями состояния тканей пародонта у больных в ходе проводимого лечения. Так, из рисунка 1 видно, что в первые сутки лечения концентрация ФНО-α у пациентов с ХГ и ХГП в 2-5 раз превышала норму (р<0,05). Индексные показатели состояния пародонта соответствовали разгару клинических проявлений воспалительных процессов в тканях (табл. 2). Однако уже на третьи сутки лечения уровень этого цитокина в ЖК больных всех трех групп снизился практически до нормальных значений (р>0,05). Этот процесс сопровождался прекращением болевых ощущений и кровоточивости десен на 1-3-и сутки лечения и исчезновением отека и гиперемии тканей на 3-5-е сутки, что подтверждалось положительной динамикой индексных показателей. Из данных таблицы 2 видно, что у больных ХГ после курса лечения с использованием 8%-ного аскорбата ХТЗ индекс РМА снизился в 24,5 раза: с 29,40±3,50 до 1,20±0,05 (р<0,05); у больных ХПГ легкой степени – в 17 раз: 38,30±4,90 до 2,25±0,03 (р<0,05); у пациентов с ХПГ средней степени - в 14,7 раза: с 49,70±5,42 до 3,37±0,64 (р<0,05). Эффект противовоспалительного воздействия составил 95,9, 94,1 и 89,1% соответственно.
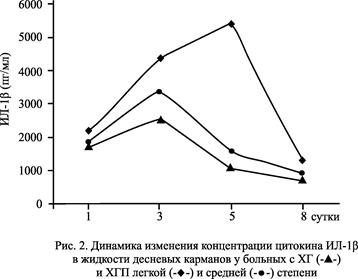
Также было установлено, что на фоне проведения традиционной терапии в сочетании с аппликациями препарата 8%-ного аскорбата хитозана у больных ХГП средней степени в 1-5-е сутки отмечался значительный рост уровня ИЛ-1β (в 2,5 раза), а на 8-10-е сутки наступал глубокий спад примерно в 4 раза относительно максимального значения (рис. 2). Аналогичная динамика наблюдалась и у больных ХГ и ХГП легкой степени с единственной разницей, что всплеск уровня ИЛ-1β в начале лечения был несколько слабее, а падение средних значений концентраций этого цитокина происходило в среднем на 2-3 суток раньше.
Как известно, ИЛ-1β в высоких концентрациях является праймирующим фактором для нейтрофилов и повышает их жизнеспособность, замедляя апоптоз, а ФНО-α в низкой концентрации также задерживает апоптоз нейтрофилов, а в высокой, наоборот, активирует его [10]. Таким образом, наблюдаемые нами на рисунках 1 и 2 изменения уровней цитокинов ФНО-α и ИЛ-1β в ЖК в процессе лечения, по всей видимости, являются отражением процессов массового рекрутирования, праймирования и продления срока жизни нейтрофилов, осуществляющих основную защиту от пиогенных бактерий и способных существовать в анаэробных условиях пародонтального кармана [7].
|
Таблица 1 Содержание цитокинов в ЖК у больных с воспалением тканей пародонта до и после лечения с использованием гелеподобной формы аскорбата ХТЗ (M±m) |
|||||||
|
Цитокин |
ХГП |
ХГ |
Норма (n=20) |
||||
|
легкой степени |
средней степени |
||||||
|
до лечения |
после лечения |
до лечения |
после лечения |
до лечения |
после лечения |
||
|
ФНО-α (пг/мл) |
34,42±1,56* |
1,75±0,04*,** |
47,40±1,73* |
1,61±0,09*,** |
17,60±1,91 |
0,60±0,04*,** |
9,74±0,14 |
|
ИЛ-1β (пг/мл) |
1830,7±250,81* |
1273,5±174,73*,** |
2421,7±295,18* |
1197,3±99,91*,** |
1715,4±281,34* |
711,5±81,89** |
706,8±64,91 |
|
ИЛ-8 (нг/мл) |
15,44±1,39* |
18,04±0,77*,** |
21,19±0,35* |
20,73±0,34* |
19,67±0,42* |
17,70±0,65*,** |
9,67±0,53 |
|
ИЛ-1ра (нг/мл) |
74,25±4,84* |
107,04±5,30 |
61,75 ± 6,40* |
105,41±6,62** |
44,58±6,75* |
95,61±10,86** |
95,31±6,68 |
|
Примечание: (*) – обозначены статистически значимые различия по сравнению с нормой (p<0,05); (**) – по сравнению с данными до лечения (p<0,05).
|
|||||||
|
Таблица 2 Индексная оценка состояния пародонта у пациентов, леченных традиционным способом в сочетании с аппликациями препарата 8%-ного аскорбата хитозана в динамике лечения (М±m) |
||||||||
|
Группа |
Показатель |
|||||||
|
РМА (%) |
I. Muhlemann (у.е.) |
|||||||
|
до лечения |
3-и сут. |
5-е сут. |
8-е сут. |
до лечения |
3-и сут. |
5-е сут. |
8-е сут. |
|
|
ХГПл (n=25) |
38,30±4,90 |
21,30±3,00* |
2,75±0,09* |
1,25±0,03* |
2,10±0,30 |
0,60±0,09* |
0,50±0,07* |
0,40±0,07* |
|
ХГПс (n=25) |
49,70±5,42 |
26,70±2,02* |
4,50±0,15* |
3,37±0,64* |
2,40±0,70 |
0,80±0,10 |
0,60±0,06* |
0,40±0,06* |
|
ХГ (n=20) |
29,40±3,50 |
8,40±1,50* |
1,30±0,07* |
1,20±0,05* |
1,90±0,30 |
0,50±0,06* |
0,30±0,05* |
0,20±0,05* |
|
Примечание: (*) - обозначены статистически значимые различия по сравнению с соответствующим показателем до лечения (p<0,05). |
||||||||
Рецензенты:
Скуридин П.И., д.м.н., главный врач ГАУЗ ПО «Городская стоматологическая поликлиника», г. Пенза.
Еремина Н.В., д.м.н., зав. кафедрой стоматологии общей практики и стоматологии терапевтической ГБОУ ДПО «Пензенский институт усовершенствования врачей» Минздрава России, г. Пенза.
Библиографическая ссылка
Иванов П.В., Зудина И.В., Булкина Н.В., Ведяева А.П., Иванова Е.В. ПРОТИВОВОСПАЛИТЕЛЬНЫЙ ЭФФЕКТ АСКОРБАТА ХИТОЗАНА В КОМПЛЕКСНОЙ ТЕРАПИИ ЗАБОЛЕВАНИЙ ПАРОДОНТА. // Современные проблемы науки и образования. 2013. № 4. ;URL: https://science-education.ru/ru/article/view?id=9517 (дата обращения: 14.02.2026).



