Введение
Используемые в настоящее время методы диагностики инфекционных заболеваний направлены в основном на определение возбудителя заболевания и его антигенов либо на выявление иммунного ответа инфицированного организма на антигены возбудителя. К последнему типу относятся методы серодиагностики – определения специфических антител в крови. Несмотря на то, что современные аналитические методы обеспечивают крайне низкий предел обнаружения, в ряде случаев серодиагностический подход оказывается предпочтительным. Гуморальный иммунный ответ всегда сопровождается значительным повышением концентрации специфических антител в крови, делая сыворотку крови универсальным материалом для диагностики разнообразных инфекционных заболеваний [1].
Серодиагностический подход наиболее оправдан при первичных обследованиях, а поскольку для массового скрининга решающее значение имеет скорость получения результата, представляется перспективным сочетание серодиагностики с таким простым и экспрессным методом, как иммунохроматографический анализ (ИХА). Результат ИХА может быть получен за 10–15 мин непосредственно на месте отбора пробы, без дополнительного оборудования и привлечения высококвалифицированного персонала.
Существенным ограничением для применения иммунохроматографии в серодиагностике является необходимость без разделения реагентов выявлять специфические антитела на фоне многократного избытка неспецифических антител. В настоящей работе на примере тест-системы для определения специфических антител против липополисахарида (ЛПС) Brucella abortus рассматривается подход, позволяющий обойти данное ограничение.
Материалы и методы
1. Реагенты. В работе использовались кроличьи (RABIss) антитела против иммуноглобулинов крупного рогатого скота производства ООО «Имтек» (Россия), твин-20, азид натрия – «Sigma» (США), золотохлористоводородная кислота – «Fluka» (Германия), бычий сывороточный альбумин (БСА) – «MP Biomedicals» (США). Для изготовления иммунохроматографических тест-систем использовали набор mdi Easypack («Advanced Microdevices», Индия). Панель сывороток коров и липополисахарид Brucella abortus были предоставлены Национальным центром биотехнологии Республики Казахстан (Астана, Казахстан). Наличие или отсутствие противобруцеллезных антител в сыворотках было подтверждено методом иммуноферментного анализа. ЛПС получен методом водно-фенольной экстракции [7].
Все соли были аналитической или химической чистоты. Воду для приготовления растворов очищали на установке MilliQ («Millipore», США).
2. Иммуноферментная детекция специфических антител к ЛПС Br. abortus в сыворотках крупного рогатого скота. Сорбцию препарата ЛПС в лунках 96-луночного микропланшета «Greiner» (Германия) осуществляли в течение ночи при 4 °С из 100 мкл раствора с концентрацией 1 мкг/мл в 50 мМ карбонатном буфере, рН 9,6. Микропланшет четырехкратно отмывали 50 мМ К-фосфатным буфером, рН 7,4, с 0,1 М NaCl и 0,05 % Тритона Х-100 (PBST), после чего в лунки вносили по 100 мкл сывороток, разбавленных PBST от 1:100 до 1:100,000 с шагом 2, и инкубировали 1 час при 37 °С. Затем микропланшет повторно отмывали, добавляли по 100 мкл раствора в PBST моноклональных антител против IgG крупного рогатого скота, меченных пероксидазой хрена (160 нг/мл), и инкубировали 1 час при 37 °С. После отмывки микропланшета (трижды PBST и один раз – дистиллированной водой) определяли пероксидазную активность связавшейся с носителем ферментной метки. Для этого в лунки микропланшета вносили по 100 мкл субстратного раствора АБТС (0,4 мг/мл) в 50 мМ Na-ацетатном буфере, рН 4,5, с 0,01% Н2О2, инкубировали 15 мин при комнатной температуре и измеряли оптическую плотность при 405 нм (ОП405).
3. Получение коллоидного золота [6]. К 97,5 мл воды добавляли 1,0 мл 1 %-ного раствора золотохлористоводородной кислоты. Смесь доводили до кипения и при перемешивании добавляли 1,5 мл 1 %-ного раствора цитрата натрия. Кипятили 30 мин, затем охлаждали до комнатной температуры.
4. Нанесение реагентов на иммунохроматографические мембраны. Конъюгат коллоидного золота с ЛПС наносили на стекловолоконную мембрану в разведении, соответствующем ОП520=2,0, в объеме 11 мкл на 1 см полосы с помощью диспенсера IsoFlow фирмы «Imagene Technology» (США).
Для формирования аналитической зоны использовали препарат ЛПС Br. abortus. На 1 см полосы наносили 2 мкл препарата (1,0 мг/мл в дистиллированной воде).
5. Изготовление иммунохроматографических тест-систем [4, 5]. Полученные подложки и рабочие мембраны сушили на воздухе при 20–22 °C не менее 20 ч. Собирали мультимембранный композит, из которого получали полоски шириной 3,5 мм, используя автоматический гильотинный нарезчик Index Cutter-1 (“A-Point Technologies”, США). Тест-полоски помещали в пластиковые кассеты и герметично упаковывали в пакеты из ламинированной алюминиевой фольги с силикагелем в качестве осушителя с помощью запаивателя с миниконвейером FR-900 (“Wenzhou dingli packing machinery”, Китай).
Результаты и обсуждение
Традиционная схема иммунохроматографического анализа, применяемая для серодиагностики, предполагает взаимодействие всех антител, содержащихся в пробе, с конъюгатом коллоидного золота и реагента для связывания антител (обычно в качестве такового реагента используют антивидовые антитела, белок А Staphylococcus aureus или белок G Streptococcus spp.). После связывания части иммуноглобулинов в пробе конъюгат диффундирует по тест-полоске, и в аналитической зоне небольшая часть связанных иммуноглобулинов, специфичных к патогену, взаимодействует с иммобилизованным в аналитической зоне антигеном. Таким образом, сигнал ИХА (степень связывания окрашенной метки в аналитической зоне) в этом случае зависит не только от концентрации специфических антител, но и от общего содержания иммуноглобулинов в пробе, что не является диагностически значимым параметром и негативно сказывается на достоверности диагностики. Этот принцип лежит в основе разработанных на сегодняшний день ИХА тестов для серодиагностики бруцеллеза [2, 3].
В настоящей работе использован альтернативный подход, основанный на применении поливалентности антител. В данном формате ИХА коллоидное золото конъюгируется с тем же антигеном, который иммобилизован в аналитической зоне. Специфические антитела взаимодействуют разными валентностями с молекулами антигена, иммобилизованными на разных поверхностях: коллоидного золота и рабочей мембраны. В таком случае во взаимодействии принимают участие только специфические антитела.
В качестве антигена был использован ЛПС Br. abortus. Для определения предела обнаружения иммунохроматографических тестов использовали моноклональные антитела против ЛПС Brucella abortus. Чувствительность тестов составила 5 мкг/мл антител – как в буферном растворе, так и в сыворотке крупного рогатого скота, несмотря на то, что сыворотка содержит более 5 мг/мл общих иммуноглобулинов (рис. 1). Таким образом, предложенная тест-система позволяет выявлять менее 0,1 % специфических антител в пробе.
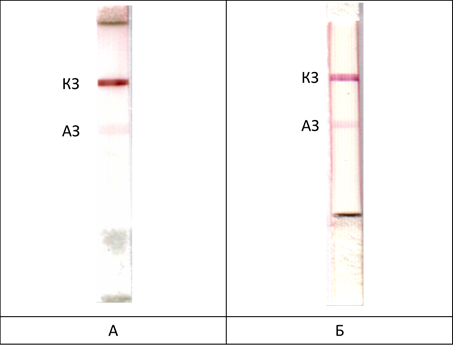
Рис. 1. Иммунохроматографическое выявление специфических антител (5 мкг/мл): А – в фосфатном буфере (pH 7,4); Б – в сыворотке крови крупного рогатого скота. АЗ – аналитическая зона, КЗ – контрольная зона
Разработанный тест был испытан на выборке из 39 коров, больных бруцеллезом. Данные иммунохроматографического тестирования сравнивали с данными иммуноферментного анализа (ИФА). В качестве унифицированной характеристики количества специфических антител в сыворотке использовали величину ее разведения, которая на асимптотической кривой титрования в ИФА соответствует оптической плотности 0,7. Полученные результаты приведены в табл. 1. Как видим, данные, полученные двумя методами, хорошо согласуются друг с другом.
Таблица 1. Результаты тестирования сывороток коров методами ИФА и ИХА
|
№ |
ИФА, разведение |
ИХА |
|
Положительные сыворотки |
||
|
1 |
1750 |
+ |
|
2 |
30000 |
+++ |
|
3 |
2150 |
+ |
|
4 |
3250 |
+ |
|
5 |
2900 |
+ |
|
6 |
4750 |
+ |
|
7 |
1900 |
+ |
|
8 |
25000 |
+++ |
|
9 |
4700 |
+ |
|
10 |
7000 |
++ |
|
11 |
12000 |
++ |
|
12 |
6000 |
+ |
|
13 |
1000 |
+ |
|
14 |
1250 |
+ |
|
15 |
2000 |
+ |
|
16 |
30000 |
+++ |
|
17 |
2600 |
+ |
|
18 |
30000 |
+++ |
|
19 |
10500 |
++ |
|
20 |
3750 |
+ |
|
21 |
7250 |
+ |
|
22 |
35000 |
+++ |
|
23 |
19000 |
++ |
|
24 |
1750 |
+ |
|
25 |
6250 |
+ |
|
26 |
2600 |
+ |
|
27 |
4600 |
+ |
|
Отрицательные сыворотки |
||
|
28 |
750 |
- |
|
29 |
750 |
- |
|
30 |
300 |
- |
|
31 |
750 |
- |
|
32 |
0 |
- |
|
33 |
250 |
- |
|
34 |
750 |
- |
|
35 |
300 |
- |
|
36 |
600 |
- |
|
37 |
400 |
- |
|
38 |
250 |
- |
|
39 |
250 |
- |
Выводы
В результате проведенных исследований разработана иммунохроматографическая тест-система для серодиагностики бруцеллеза крупного рогатого скота с нетрадиционным форматом анализа, который можно рассматривать как эффективную альтернативу применяемым на сегодняшний день подходам. Детекция комплексов (иммобилизованный на мембране антиген) – антитело – (конъюгированный с коллоидным золотом антиген) исключает негативное влияние неспецифических иммуноглобулинов в сыворотке и тем самым повышает достоверность серодиагностики.
Работа проводилась при финансовой поддержке Министерства образования и науки Российской Федерации (Федеральная целевая программа «Исследования и разработки по приоритетным направлениям развития научно-технологического комплекса России на 2007–2013 годы», государственный контракт от 12 марта 2012 г. № 11.519.11.2046).
Рецензенты:
Капрельянц Арсений Сумбатович, д-р биол. наук, профессор, заведующий лабораторией Института биохимии им. А. Н. Баха РАН, г. Москва.
Топунов Алексей Федорович, д-р биол. наук, профессор, заведующий лабораторией Института биохимии им. А. Н. Баха РАН, профессор Московского государственного университета пищевых производств, г. Москва.
Библиографическая ссылка
Сотников Д.В. ИММУНОХРОМАТОГРАФИЧЕСКАЯ СЕРОДИАГНОСТИКА БРУЦЕЛЛЕЗА КРУПНОГО РОГАТОГО СКОТА С ИСПОЛЬЗОВАНИЕМ КОНЪЮГАТА КОЛЛОИДНОГО ЗОЛОТА С ЛИПОПОЛИСАХАРИДОМ BRUCELLA ABORTUS // Современные проблемы науки и образования. 2013. № 3. ;URL: https://science-education.ru/ru/article/view?id=9464 (дата обращения: 08.01.2026).



