Введение
Коллоидное золото (КЗ) используется в качестве маркера в иммунохимии более 40 лет [3]. Несмотря на это, вопрос об оптимальном составе используемых конъюгатов КЗ с биомолекулами остаётся открытым. Многие авторы предлагают определять оптимальный состав конъюгатов на основании данных об их флоккуляции в растворах с высокой ионной силой [5]. Считается, что лучше всего использовать конъюгаты с содержанием белка, на 10–20 % превышающим минимальную концентрацию, достаточную для предотвращения агглютинации частиц КЗ в растворах, содержащих 1 %-ный хлорид натрия [6]. Предполагается, что при такой концентрации на поверхности частицы формируется стабилизирующий монослой белка, а использование более высоких концентраций нецелесообразно. Однако нет данных, подтверждающих то, что стабилизация КЗ в растворах с высокой ионной силой означает невозможность дальнейшей сорбции белковых молекул.
Поэтому нами были сопоставлены конъюгаты разного состава между КЗ и белками, наиболее часто используемыми в иммуноанализе: иммуноглобулином класса G (IgG), стафилококковым белком А и стрептококковым белком G. Зависимости сигнала в иммунохроматографическом анализе (ИХА) – окрашивания мембраны вследствие связывания маркера – от содержания белка были сравнены с флоккуляционными зависимостями конъюгатов. Исследование было проведено на примере тест-систем для определения антибиотика хлорамфеникола (с использованием конъюгата коллоидного золота с IgG против хлорамфеникола) и антител против липополисахарида Brucella abortus (с использованием конъюгата коллоидного золота с белком А или белком G).
Цель исследования
Сравнение эффективности в иммунохроматографическом анализе конъюгатов разного состава между коллоидным золотом и белками; сопоставление оптимальных нагрузок иммобилизуемого на коллоидной частице белка, получаемых при тестировании в иммунохроматографии и на основании флоккуляционной кривой.
Материалы и методы исследования
Реагенты и материалы. В работе были использованы моноклональные антитела против хлорамфеникола (ХАФ), клон CapE4 (МАт Е4), предоставленные П. Г. Свешниковым (Всероссийский научный центр молекулярной диагностики и лечения, Москва, Россия). Также использовали хлорамфеникол, хлорамфениколсукцинат натрия (ХАФ-Су), бычий сывороточный альбумин (БСА), цитрат натрия, азид натрия, трис, глицерин и твин-20 фирмы Sigma (St. Louis, США), соевый ингибитор трипсина (СИТ), 1-циклогексил-3-(2-морфолино-этил)карбодиимид п-толуолсульфонат (CCMS), N-гидроксисукцинимид (NHS), N,N-диметилфорамид (ДМФА) фирмы MP Biomedicals (Santa Ana, США), золотохлористоводородную кислоту фирмы Fluka (Buchs, Швейцария), антитела козы против иммуноглобулинов мыши (GAMI) фирмы Arista Biologicals (Allentown, США). Рекомбинантные белки А и G производства фирмы Имтек (Москва, Россия). Липополисахарид (ЛПС) Brucella abortus, полученный методом водно-фенольной экстракции [8], был предоставлен Национальным центром биотехнологии Республики Казахстан (Астана, Казахстан). Все вспомогательные реагенты (соли, кислоты, щелочи, органические растворители) были аналитической или химической чистоты. Растворы для получения коллоидного золота и его конъюгатов готовили на воде, деионизованной с помощью установки Milli-Q (Millipore, Bedford, MA, США, 18.2 MΩ·cм при 25 °С).
Для изготовления иммунохроматографических тест-систем использовали набор mdi Easypack фирмы Advanced Microdevices (Ambala Cantt, Индия).
Получение КЗ цитратным методом [4]. К 97.5 мл деионизованной воды добавляли 1.0 мл 1 %-ного раствора золотохлористоводородной кислоты, доводили до кипения и при перемешивании добавляли 1.5 мл 1 %-ного раствора цитрата натрия. Смесь кипятили 25 мин, затем охлаждали и хранили при 4–6 °С.
Просвечивающая электронная микроскопия. Препараты КЗ наносили на сеточки (300 меш., фирма Pelco International, США), покрытые пленкой-подложкой из поливинилформаля, растворенного в хлороформе. Снимки получали на электронном микроскопе CX-100 фирмы Jeol (Япония) при ускоряющем напряжении 80 кВ и увеличении 3.300.000. Фотографии в цифровой форме анализировали в программе Image Tool.
Синтез конъюгата хлорамфеникола с соевым ингибитором трипсина (ХАФ–СИТ). Для получения конъюгата ХАФ–СИТ гаптен ХАФ-Су ковалентно сшивали с СИТ методом активированных эфиров [5] с модификациями [2]. Для приготовления активированного эфира ХАФ-Су 8.5 мг (75 мкм) NHS, 32 мг (75 мкм) CCMS и 22 мг (50 мкм) ХАФ-Су последовательно растворяли в 1 мл ДМФА и инкубировали в течение ночи при комнатной температуре. СИТ (10 мг) растворяли в 1.0 мл 50 мМ натрий-карбонатного буфера, pH 9.6, с добавленным ДМФА (5 %, об./об.). Белковый раствор инкубировали при 4 °С в течение 1 ч. Затем раствор активированного эфира ХАФ-Су добавляли по каплям при перемешивании к раствору СИТ до достижения мольного соотношения гаптен: белок, равного 15:1. Суспензию перемешивали еще 2 часа при комнатной температуре и инкубировали при 4 °С в течение 20–22 ч. Полученный конъюгат ХАФ–СИТ диализовали против 50 мМ фосфатного буфера, рН 7.4, содержащего 100 мМ хлорида натрия (ФБС), при 4 °C в течение 3-х суток с 5-кратной сменой буфера.
Определение концентраций белков, оптимальной для иммобилизации на коллоидном золоте [5]. Коллоидное золото (1.0 мл, ОП520=1.0) добавляли к водным растворам белка (МАт Е4, белок A или белок G) (0.1 мл) в концентрациях от 1 до 10 мкг/мл. Реакционную смесь перемешивали и инкубировали при комнатной температуре 10 мин. Затем в каждую пробу добавляли по 0.1 мл 10 %-ного раствора хлорида натрия, перемешивали и через 10 мин измеряли ОП580.
Иммобилизация белков на коллоидное золото. Перед конъюгацией с КЗ белки (МАт Е4, белок A, белок G) диализовали против 1000-кратного избытка 10 мM карбонатного буфера, pH 9.0, в течение 2 ч при 4 °C. Раствор 0.1 M карбоната калия добавляли к коллоидному золоту (ОП520=1.0) до достижения pH 9.0 и вносили в раствор белки выбранной концентрации. Смесь инкубировали 30 мин при комнатной температуре и перемешивании, после чего вносили БСА до конечной концентрации 0.25 %. Частицы КЗ с иммобилизованным белком отделяли от непровзаимодействовавшего белка центрифугированием при 8000 g в течение 30 мин. После удаления супернатанта осадок ресуспендировали в 10 мМ трис-буфере, рН 9.0, содержащем 0.25 % БСА и 0.05 % твин-20.
Изготовление иммунохроматографических тестов. Мембраны с нанесенными реагентами и мультимембранные композиты изготавливали по методике, описанной в работе [2]. Конъюгаты КЗ с белками наносили на стекловолоконную мембрану с использованием диспенсера IsoFlow фирмы Imagene Technology (Hanover, США). Конъюгаты КЗ с белком А и белком G наносили в разведении, соответствующем ОП520=10.0 (11 мкл на 1 см ширины стекловолоконной мембраны), конъюгат КЗ с антителами МАт Е4 – в разведении, соответствующем ОП520=6.0 (16 мкл на 1 см ширины стекловолоконной мембраны). В тест-системе определения антител против ЛПС B. abortus для формирования аналитической зоны использовали раствор ЛПС (1.0 мг/мл в дистиллированной воде). В тест-системе определения хлорамфеникола для формирования аналитической зоны использовали раствор конъюгата ХАФ–СИТ (0.25 мг/мл в ФБС, содержащем 10 % глицерина), контрольной зоны – раствор антител GAMI (0.25 мг/мл в ФБС, содержащем 10 % глицерина). Все растворы наносили по 2.0 мкл на 1 см ширины рабочей мембраны. Полученные стекловолоконные и рабочие мембраны сушили на воздухе при 20–22 °C в течение не менее чем 20 ч.
ИХА и регистрация его результатов. Анализ проводили при комнатной температуре. Вскрывали пакет, извлекали тест-полоску и в вертикальном положении ее нижний конец погружали на 1 мин в аликвоту пробы (50 мкл), после чего помещали тест-полоску на горизонтальную поверхность. Через 10 мин после начала анализа контролировали результат, получая цифровое изображение тест-полоски на сканере CanoScan LiDE 90 pro (Canon) и рассчитывая интегральную интенсивность окрашивания аналитической и контрольной зон с использованием программного обеспечения TotalLab (Nonlinear Dynamics, Великобритания), как описано в работе [1].
Результаты исследования и их обсуждение
Коллоидное золото синтезировали по методу Френса [4]. Анализ полученных препаратов с помощью электронной микроскопии продемонстрировал высокую гомогенность размеров частиц и близость их формы к сферической: длина большей оси составила 37±8 нм, меньшей оси – 30±5 nm. Таким образом, средний диаметр полученных частиц – около 34 нм.
Адсорбцию белков на КЗ контролировали, измеряя ОП при 580 нм после добавления к полученным конъюгатам хлорида натрия [5]. Зависимости ОП580 от концентраций иммобилизуемых белков, представленные на рис. 1, соответствуют известным представлениям об адсорбции белков на КЗ: ОП580 сначала увеличивается, доходит до максимума, а затем уменьшается, выходя на плато [7].
а) б)
б)
в) 
Рис. 1. Флоккуляционные зависимости адсорбции на КЗ белка A (а), белка G (б) и МАт E4 (в). По оси абсцисс – концентрации белков при конъюгировании, по оси ординат – ОП580 препаратов, полученных после адсорбции белков и добавления хлорида натрия
Для проверки связывающей способности конъюгатов КЗ с белком А и белком G проводили иммунохроматографическое определение антител против ЛПС B. abortus. В качестве пробы при этом использовалась положительная стандартная коровья сыворотка – национальный стандарт, содержащий 1000 МЕ антител против ЛПС B. abortus. Конъюгат КЗ с IgG тестировали в системе иммунохроматографического определения хлорамфеникола. Полученные зависимости интенсивности окраски аналитической зоны от концентрации белка, использованной при конъюгировании, представлены на рис. 2.
а) б)
б)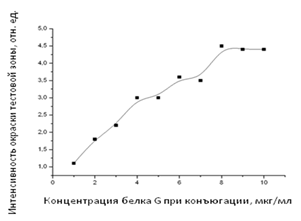
в)
Рис. 2. Зависимости интенсивности окраски аналитической зоны (по оси ординат) от концентрации белка, использованной при конъюгировании (по оси абсцисс), для систем иммунохроматографического определения: (а) антител против ЛПС B. abortus с использованием конъюгата КЗ – белок А; (б) антител против ЛПС B. abortus с использованием конъюгата КЗ – белок G; (в) хлорамфеникола с использованием конъюгата КЗ – IgG
Сравнение флоккуляционных зависимостей с данными иммунохроматографии позволяет заключить, что связывающая способность конъюгата КЗ с белком не определяется однозначно стабилизацией поверхности КЗ адсорбированными молекулами. Наиболее выражено отличие для белка G: точка выхода на плато флоккуляционной зависимости соответствует концентрации белка, равной 4 мкг/мл, тогда как максимальные значения интенсивности сигнала в иммунохроматографии достигаются при концентрациях, начиная с 8 мкг/мл. Таким образом, аффинность конъюгата увеличивается при концентрациях, которые значительно превышают порог, определяемый стабилизацией частиц КЗ. Существуют два возможных объяснения данного феномена. Во-первых, стабилизация КЗ по отношению к действию высокой ионной силы может достигаться до заполнения монослоя. Во-вторых, рост реакционной способности конъюгатов может быть связан с изменением расположения на поверхности частицы молекул белков несферической формы. В соответствии с данными [9], при низких концентрациях белки располагаются на поверхности так, чтобы закрыть максимальную площадь, а при увеличении концентрации меняют ориентацию таким образом, чтобы на поверхности поместилось наибольшее количество молекул белка. Этот механизм находится в соответствии с результатами экспериментов для белка G, представленными на рис. 1, б и 2, б.
Выводы
Оптимальный состав конъюгата коллоидного золота с белком, обладающего максимальной аффинностью взаимодействия в иммуноаналитических системах, является характеристикой, зависящей от индивидуальных особенностей используемого белкового препарата. Этот параметр не может быть определен на основании данных о флоккуляции конъюгатов с разной нагрузкой в растворах с высокой ионной силой.
Работа проводилась при финансовой поддержке Министерства образования и науки Российской Федерации (Федеральная целевая программа «Исследования и разработки по приоритетным направлениям развития научно-технологического комплекса России на 2007–2013 годы», государственный контракт от 12 марта 2012 г. № 11.519.11.2046).
Рецензенты:Ерёмин Сергей Александрович, доктор химических наук, профессор, заведующий лабораторией иммунохимических методов анализа кафедры химической энзимологии Химического факультета Московского государственного университета им. М. В. Ломоносова, г. Москва.
Ярополов Александр Иванович, доктор химических наук, профессор, заведующий лабораторией химической энзимологии Института биохимии им. А. Н. Баха РАН, г. Москва.
Библиографическая ссылка
Бызова Н.А., Сотников Д.В. ВЛИЯНИЕ СОСТАВА КОНЪЮГАТОВ КОЛЛОИДНОГО ЗОЛОТА С БЕЛКАМИ НА ЭФФЕКТИВНОСТЬ ИХ ИСПОЛЬЗОВАНИЯ В ИММУНОХРОМАТОГРАФИЧЕСКОМ АНАЛИЗЕ // Современные проблемы науки и образования. 2013. № 3. ;URL: https://science-education.ru/ru/article/view?id=9407 (дата обращения: 12.03.2026).



