Введение
Тиреотоксикоз и гипотиреоз – клинические синдромы, характеризующиеся соответственно стойким избытком и дефицитом тиреоидных гормонов в организме.
Основные физиологические эффекты тиреоидных гормонов достаточно четко верифицированы и обусловлены не только их прямым влиянием на экспрессию генов, контролирующих синтез структурных и функциональных белков в клетках различных систем организма, но и опосредованным механизмом – через взаимодействие с катехоламинами [18,20]. Основные проявления тиреоидных гормонов включают: 1) обеспечение нормальных процессов роста, развития и дифференцировки тканей и органов; 2) повышение эффективности митохондрий и сократимости миокарда; 3) активацию симпатических эффектов; 4) повышение возбудимости центральной нервной системы и активацию психических процессов; 5) увеличение почечного кровотока, клубочковой фильтрации и диуреза; 6) участие в повышении теплообразования и температуры тела; 7) поддержание нормальной половой и репродуктивной функции [18]. Несомненно, изменение тиреоидного статуса оказывает непосредственное влияние на функционирование практически всех систем организма, а, следовательно, могут быть задействованы механизмы неспецифической адаптации. В исследованиях ряда авторов и ранее проведенных нами исследований выявлено, что разнонормальный уровень тиреотропного гормона влияет на адаптационные возможности организма и его элементный статус [2,3,4,5], а экспериментальные тиреотоксикоз и гипотиреоз приводят к развитию стресса в организме лабораторных животных [8,9,10,11,12,13].
Особенности элементного статуса организма и его влияние на тиреоидный статус изучались с середины прошлого века. Показано влияние Cu, Fe, Mg, Mn, P, Zn, Cd, Co, Mo и их корреляционных связей на функцию щитовидной железы (ЩЖ) [17]. Значительно меньше данных по выявлению обратной зависимости влияния тиреоидного статуса на минеральный обмен. Поэтому целью нашего исследования было изучение особенностей элементного статуса лабораторных крыс в условиях экспериментального тиреотоксикоза и гипотиреоза.
Материал и методы
Объектом исследования были лабораторные крысы – самцы линии «Вистар» (n=45), с массой тела от 100 до 250 грамм. Все животные содержались в стандартных условиях вивария Института Биоэлементологии ОГУ, на полноценном сбалансированном комбинированном рационе в соответствии с рекомендациями Института питания РАМН, в помещении с температурой + 20 + 24º С.
Лабораторные животные были ранжированы на три группы в зависимости от функции щитовидной железы. У животных I опытной группы (n=15) моделировалось состояние экспериментального тиреотоксикоза путем внутрибрюшинного введения L-тироксина из расчета 200 мкг на килограмм массы тела ежедневно на протяжении 10–35 дней [19]. У животных II опытной группы (n=15) моделировалось состояние экспериментального гипотиреоза путем внутрибрюшинного введения мерказолила из расчета 1 мг на 100 г массы тела, ежедневно в течение 15 дней [6]. Третья группа (n=15) являлась контрольной и не подвергалась воздействиям.
Манифестный тиреотоксикоз и гипотиреоз подтверждались путем 3-х кратного исследования уровней ТТГ, свободного Т4 сыворотки крови с использованием коммерческих наборов фирмы «Амеркарт» (Великобритания), методом усиленной люминесцентной системы «AMERLITE». Для проведения общего анализа крови использовался анализатор гематологический MEDONIC CA-620 А/О Юнимед Москва 2002 г. MEDONIC CA-620.
Для изучения элементного статуса организма в качестве биосубстратов использовали образцы тела лабораторных крыс. Определение элементного состава биосубстратов проводилось методами атомно-эмиссионной и масс-спектрометрии с индуктивно связанной аргоновой плазмой (ИСП-МС и ИСП-АЭС) на приборах Optima 200DV и ELAN 9000 (Perkin Elmer, США) в Центре Биотической Медицины (г. Москва) по методике, утвержденной МЗ РФ [7].
Статистическая обработка полученного материала проводилась с применением общепринятых методик при помощи приложения «Excel» из программного пакета «Office XP» и «Statistica 6.0», включая определение средней арифметической величины (М), стандартной ошибки средней (m), оценку достоверности различий по Манну – Уитни.
Результаты и обсуждение
При изучении уровня функционирования ЩЖ было выявлено, что в I опытной группе на всем протяжении эксперимента сохранялся стабильный уровень тиреотропного гормона – 0,09 мкМЕ/л, что свидетельствовало о манифестном тиреотоксикозе. Уровень свободного Т4 находился в пределах от 33,5 до 38,9 пмоль/л. Помимо этого критериями развития состояния повышенного тиреоидного статуса служили изменения массы тела и ректальной температуры. К окончанию эксперимента ректальная температура животных I опытной группы составила в среднем 40,0 ± 0,04°С, превысив аналогичный показатель контрольной группы на 1,6± 0,05°С (р<0,05); масса тела уменьшилась на 21,2 ± 2,06 гр., что составило 9 % от исходной средней массы тела опытных крыс (р<0,05). Наряду с отмеченным, у животных I опытной группы наблюдалась повышенная возбудимость, взъерошенность шерсти, гипотрофия мышц тазового пояса и выраженный экзофтальм.
Вторая опытная группа отличалась наличием характерных симптомов гипотиреоза – малая подвижность, сонливость, отсутствие аппетита, выпадение шерсти с боковых поверхностей туловища. На фоне введения мерказолила через 14 дней у крыс при стандартном рационе отмечалось увеличение общей массы тела на 12 % (р<0,05); у интактных крыс контрольной группы за этот же срок прибавка веса составила 5 % (р<0,05). Уровень тиреотропного гормона в этой группе имел наибольшие значения (0,14мкМЕ/л), а свободного Т4 – наименьшие (4,9 пмоль/л). В контрольной группе уровень гормонов соответствовал физиологической норме (ТТГ = 0,12мкМЕ/л; Т4 = 11,2 пмоль/л).
На рисунке 1 представлены относительные значения содержания макроэлементов в теле лабораторных крыс.
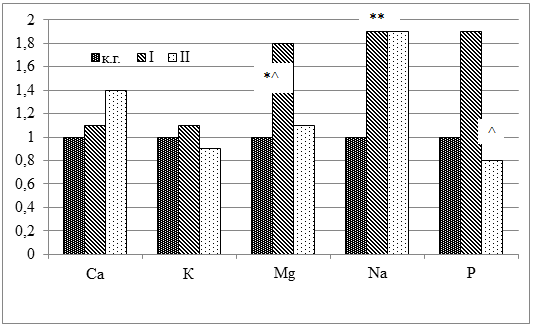
Рисунок 1. Относительные значения содержания макроэлементов в теле лабораторных крыс
Примечание: * – достоверные различия (р<0,05) с контрольной группой; ^ – достоверные различия (р<0,05) между опытными группами.
При сравнении содержания макроэлементов в теле лабораторных животных выявлено, что наибольшее влияние изменение тиреоидного статуса оказало на содержание Na, уровень которого был выше практически в 2 раза как при тиреотоксикозе (р<0,05), так и при гипотиреозе. В опытных группах наблюдалось также некоторое увеличение содержания в теле Mg, но достоверная разница как с контрольной, так и со II группами получена только в группе с экспериментальным тиреотоксикозом. Динамика содержания Р оказалась диаметрально противоположной: в I группе в 1,9 раза больше, а во II группе в 1,3 раза меньше, по сравнению с контрольной группой.
При сравнении накопления эссенциальных элементов в теле экспериментальных животных выявлено, что различный тиреоидный статус влияет на пул эссенциальных микроэлементов (рис. 2).
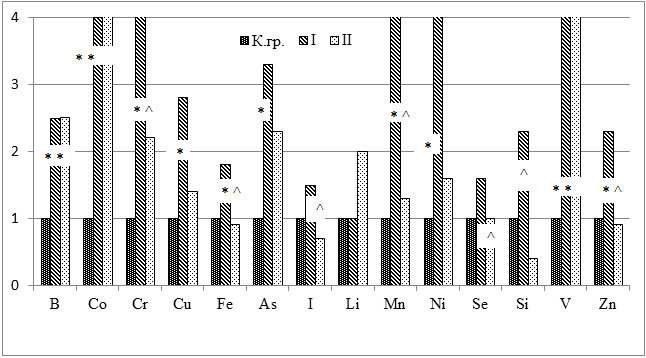
Рисунок 2. Относительные значения содержания эссенциальных и условно эссенциальных элементов в теле лабораторных крыс
Примечание: * – достоверные различия (р<0,05) с контрольной группой; ^ – достоверные различия (р<0,05) между опытными группами.
В опытных группах наблюдалось увеличение содержания Co, Cr, Сu, Fe, As, Mn, Ni, Zn, Li, В и V по сравнению с контрольной группой. Состояние тиреотоксикоза сопровождалось достоверным увеличением содержания В (в 2,5 раза), Со (в 4 раза), Cr (в 4 раза), Сu (в 2,8 раза), Fe (в 2 раза), As (в 3,3 раза), V (в 20 раз), Zn (в 2,3 раза), Mn (в 5,7 раза), Ni (в 7,6 раза) и тенденцией к увеличению содержания I, Se и Si.
Гипотиреоз приводил к достоверному увеличению содержания В (в 2,5 раза), Со (в 9 раз) и V (в 10 раз); тенденции к увеличению содержания Cr, Cu, As, Li, Mn и Ni и снижению содержания Fe, I, Si и Zn по сравнению с контрольной группой. Сравнение опытных групп выявило, что при тиреотоксикозе достоверно выше содержание Cr, Fe, I, Mn, Se, Si, и Zn.
У крыс обеих опытных групп обнаружен более высокий уровень содержания Al (р<0,05) и Pb ( рис. 3).
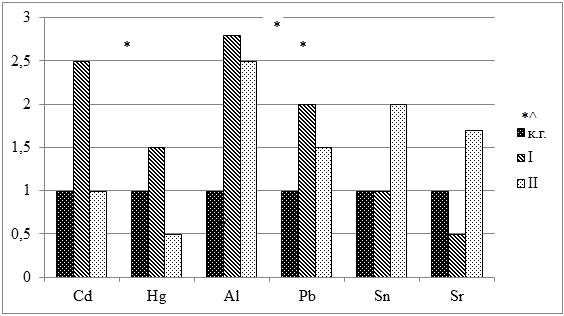
Рисунок 3. Относительные значения содержания токсичных элементов в теле лабораторных крыс
Примечание: * – достоверные различия (р<0,05) с контрольной группой; ^ – достоверные различия (р<0,05) между опытными группами.
При тиреотоксикозе наблюдалось достоверно более высокое содержание Сd по сравнению с контрольной группой. Гипотиреоз сопровождался достоверным повышением уровня Sr, снижением Hg и тенденцией к повышенному содержанию Sn в теле лабораторных животных. Между опытными группами достоверная разница наблюдалась только по накоплению Hg и Sr.
Полученные данные показывают зависимость пула большинства эссенциальных микроэлементов от функции ЩЖ. Таким образом, существует не только зависимость функции ЩЖ от дефицита или избытка I, Se, Zn, Cu, Fe, Co, Cr, но и сама ЩЖ влияет на пул этих элементов. Кроме этого выявлено, что функция ЩЖ влияет на уровень условно эссенциальных элементов: В, As, Ni и Si. Данные о возможной роли V достаточно скудны, однако, отмечено, что при дефиците V в рационе у крыс наблюдалось уменьшение размеров ЩЖ [26]. Данных о взаимосвязи В и ЩЖ в литературе нет, однако известно, что В участвует в регуляции действия паратгормона и таким образом косвенно влияет на метаболизм Са, Mg и кальцитриола [23]. Данных о влиянии Si и As на функцию ЩЖ в доступной нам литературе не обнаружено. В то же время известно о некоторых антагонистических отношениях As и Se в организме [27]. Физиологическая роль Ni до сих пор не вполне ясна, однако, выявлено накопление Ni в тканях и сыворотке крови при онкологических заболеваниях [24].
Таким образом, экспериментальное изменение тиреоидного статуса (тиреотоксикоз и гипотиреоз) привело к изменению элементного состава тела лабораторных животных.
Состояние экспериментального тиреотоксикоза сопровождалось увеличением накопления практически всех изученных химических элементов. Наибольшие достоверные изменения касались содержания Co, Cr, Cu, V, B, Fe, As, Mn, Ni V, Zn, Mg, Na, Cd и Al. В то же время экспериментальный тиреотоксикоз практически не повлиял на содержание в теле животных Ca и K. Моделирование экспериментального гипотиреоза в меньшей степени повлияло на элементный статус, для животных этой группы было характерно достоверно более высокое содержание B, Co, V, Al и Sr по сравнению с контролем.
Интересен факт практически стабильного, с небольшой тенденцией к увеличению при гипертиреозе и снижению при гипотиреозе содержания в теле лабораторных животных I и Se, элементов непосредственно связанных с функционированием ЩЖ. Возможно, изменения содержания этих элементов все-таки наблюдались, но на уровне перераспределения в организме, что невозможно оценить при исследовании средней пробы по телу. Синхронность динамики содержания этих элементов подчеркивает их плотную метаболическую взаимосвязь [14,15,16,21,22,25]. Аналогичная динамика (увеличение при гипертиреозе и снижение при гипотиреозе) была характерна и для других элементов – P, Fe, Zn. Вероятно, это объясняется взаимосвязью этих элементов с тиреоидным статусом, так как цинк является компонентом ядерного рецептора трийодтиронина Т3, а железо участвует в преобразовании L–фенилаланина в L–тирозин [22,28].
Уровень Cr увеличился в обеих опытных группах, однако, степень изменения содержания этого элемента была достоверно больше при гипертиреозе, что подтверждает данные о связи между активностью ЩЖ и содержанием Cr в отдельных биосубстратах [25]. Содержание Cu в теле опытных групп также было выше в опытных группах, но достоверная разница с контролем выявлена только при гипертиреозе. Рядом авторов отмечено повышение концентрации этого микроэлемента в крови при гипертиреозе и ее снижение при гипофункции ЩЖ [1].
Полученные данные наглядно демонстрируют влияние тиреоидного статуса на минеральный обмен с превалирующим действием экспериментального тиреотоксикоза на содержание эссенциальных и условно эссенциальных микроэлементов в организме лабораторных животных. При этом наряду с «ожидаемыми» изменениями выявлен целый ряд элементов, уровень которых не ассоциировался ранее с тиреоидным статусом.
Работа выполнена при поддержке Минобрнауки РФ в рамках реализации Федеральной целевой программы «Научные и научно-педагогические кадры инновационной России» на 2009–2013 годы (согл. № 14.1337.21.0122 от 23.07.2012).
Рецензенты:
Мирошников Сергей Александрович, доктор биологических наук, профессор, исполнительный директор института биоэлементологии ГОУ ВПО ОГУ, г. Оренбург.
Дерябин Дмитрий Геннадьевич, доктор медицинских наук, профессор, заведующий кафедрой микробиологии ГОУ ВПО ОГУ, г. Оренбург.
Библиографическая ссылка
Мирошников С.В., Нотова С.В., Тимашева А.Б., Кван О.В., Мирошников С.В., Тимашева А.Б. ВЛИЯНИЕ ЭКСПЕРИМЕНТАЛЬНОГО ТИРЕОТОКСИКОЗА И ГИПОТИРЕОЗА НА ЭЛЕМЕНТНЫЙ СТАТУС ЛАБОРАТОРНЫХ ЖИВОТНЫХ // Современные проблемы науки и образования. 2013. № 3. ;URL: https://science-education.ru/ru/article/view?id=9336 (дата обращения: 22.02.2026).



