Введение
Злоупотребление алкоголем относят к числу основных этиологических факторов хронических заболеваний печени. Алкоголь оказывает отрицательное действие на все органы, однако печень наиболее подвержена его влиянию, поскольку именно в ней в основном происходит окисление этанола. Патогенез алкогольного поражения печени включает множественные механизмы: прямое токсическое действие алкоголя и его метаболитов, цитокин-индуцированное повреждение печеночной ткани, обусловленное активацией клеток Купфера кишечными эндотоксинами, аутоиммунное повреждение вследствие формирования неоантигенов, включающих продукты метаболизма этанола, и развивающиеся при злоупотреблении алкоголем изменения питания. Основное значение в патогенезе алкогольных поражений печени имеет ацетальдегид, который образуется при участии ферментных систем: АДГ, микросомальной этанол-окисляющей системы (МЭОС) и пероксисомальной каталазы. Он вступает в химическую связь с белками, нарушая их функции, образуя новые молекулы с антигенными свойствами, способствуя тем самым иммуноопосредованному поражению печени [1].
Отклонения биохимического гомеостаза у больных синдромом зависимости от алкоголя (СЗА) на высоте острого алкогольного психоза (ОАП) характеризуются повышением активности ферментов сыворотки крови [6]. Поступление алкоголя в организм приводит к нарушениям многих видов обмена веществ. Метаболизм этанола способствует сдвигу окислительно-восстановительных процессов в клетках в сторону восстановительных реакций, что ведет к усилению перекисного окисления липидов (ПОЛ), подавлению синтеза белка [10]. Патофизиологические перестройки в период отмены этанола у лиц с СЗА – алкогольного абстинентного синдрома и ОАП – являются схожими с таковыми при развитии острой фазы воспаления других заболеваний. У лиц, злоупотребляющих спиртными напитками, выявлено значимое увеличение уровня интерлейкина-6, инициирующего синтез С-реактивного белка (СРБ), запускающего, в свою очередь, воспалительную реакцию в организме, маркерами которой являются белки острой фазы (БОФ) – СРБ, гаптоглобин [9]. Ацетальдегид вызывает некротически-воспалительные изменения, стимулируя синтез цитокинов, провоспалительных. Именно каскад цитокиновых реакций запускает синтез острофазовых белков в организме [5].
Электрофорез фракций белка в динамике купирования ОАП выявил повышение α-1-, α-2-глобулинов, что может свидетельствовать о наличии воспалительных явлений в организме больных. Фракция α-глобулинов образована гликопротеинами (гаптоглобином, церулоплазмином, α-1-антитрипсином, орозомукоидом и др.), уровень которых повышается при острых воспалительных, некробиотических, аллергических и стрессовых состояниях. В силу этого α-глобулины относят к белкам («реактантам») острой фазы. СРБ секретируется гепатоцитами и является одним из белков, ассоциированных с плазмолеммой этих клеток. Установлено, что детерминанты СРБ всегда обнаруживаются на клетках печени, но их число чрезвычайно возрастает при воспалении. По-видимому, основное значение СРБ заключается в распознавании потенциально токсических веществ, образующихся при распаде собственных клеток организма, связывании их и затем детоксикации и удалении из крови. СРБ, присоединённый к мембранам микроорганизмов и поврежденным клеткам, активирует каскад комплемента по классическому пути [2].
Выраженное снижение белково-синтетической функции печени у наркологических больных может быть также обусловлено следующими обстоятельствами: нарушением ферментных систем печени при ее поражении алкоголем, что приводит к подавлению синтеза альбуминов; уменьшением поступления аминокислот с пищей, что часто имеет место у больных, страдающих СЗА, снижением всасывательной функции кишечника, что наблюдается в условиях дисбиоза [4].
Несмотря на большое количество работ, посвященных проблеме нарушений обменных процессов у больных СЗА, вопросы воспалительных изменений в белковом спектре сыворотки крови в динамике ОАП освещены в литературе недостаточно, что и определило актуальность данного исследования.
Целью исследования явилось установление особенностей нарушений белкового обмена и значимости БОФ воспаления в патогенезе ОАП.
Объекты и методы исследования. Обследовано 74 человека мужского пола, средний возраст 42,3±1,1 года. Обследованные разделены на 2 группы: больные с СЗА в состоянии ОАП, здоровые лица (контрольная группа). Все больные (46 чел.) – жители г. Архангельска и Архангельской области. Сроки пребывания в наркологическом стационаре составляли в среднем 9-10 дней. Обследование осуществлялось в 1-е сут. госпитализации – на высоте ОАП и на 6-7-е сут. – ко времени завершения проведения курса интенсивной терапии.
Контрольную группу составили 28 практически здоровых мужчин аналогичных возрастных категорий – жителей Архангельска, у которых анамнестически и клинически были исключены СЗА и употребление спиртных напитков в течение последних 2 недель, а также заболевания желудочно-кишечного тракта в стадии обострения и черепно-мозговые травмы в анамнезе. Обследование контрольной группы осуществлялось однократно.
Ферментативную активность аспартатаминотрансферазы (АСТ), аланинаминотрансферазы (АЛТ), гаммаглутамилтрансферазы (ГГТ), щелочной фосфатазы (ЩФ), определяли кинетическим методом по рекомендации IFCC на анализаторе «Cobas Mira–S» реактивами фирмы «Cormey» (Польша).
Содержание общего белка, альбуминов, СРБ, фракций комплемента С3 и С4 в сыворотке крови определяли стандартными методами на анализаторе «Cobas Mira-S» (Австрия) наборами фирмы «Cormay» (Польша); белковых фракций (альбумина, α-1-, α-2, β-, γ-глобулинов) – наборами фирмы «Cormay Gel» (Польша) и на денситометре «Beckman» (США).
Статистическую обработку полученных результатов, оценку распределения показателей, определение границ нормального распределения проводили с помощью компьютерного пакета прикладных программ SPSS 13.0. Критический уровень значимости (p) при проверке статистических гипотез принимался за 0,05.
Оценка соотношений генеральных дисперсий в большинстве сравниваемых выборок показала их неравенство. Также в большинстве выборок выявлено неправильное распределение. В связи с этим использованы непараметрические методы. Для проверки статистической гипотезы разности средних значений между независимыми выборками (контроль – больные) использован критерий Манна-Уитни, а между зависимыми (больные в динамике лечения) – критерий Уилкоксона.
Результаты и их обсуждение
На высоте ОАП у больных с СЗА более низкий средний уровень общего белка в сыворотке крови на 15,7% (p=0,008) и альбуминов на 21,4% (p<0,001) по сравнению с контрольной группой. Полученные нами данные о значимых нарушениях белкового обмена у наркологических больных на высоте ОАП согласуются с имеющимися сведениями о прямом угнетающем действии ацетальдегида на процессы белкового синтеза. Также известно, что этанол посредством закисления среды снижает синтез альбуминов [3]. У наркологических больных часто имеет место уменьшение поступления аминокислот с пищей и снижение всасывательной функции кишечника в условиях дисбиоза.
Имеются указания на то, что при СЗА интенсифицируется протеолиз и утилизация белков для нужд глюконеогенеза. Такое нарушение белкового обмена может компенсаторно стимулировать формирование глюкозоаланинового шунта с повышением АЛТ и интенсификацию транспорта аминокислот, в частности ГГТ [8].
На протяжении всего периода наблюдения у больных СЗА в состоянии ОАП средние значения активности АСТ, АЛТ и ГГТ значительно превышали таковые у здоровых лиц (табл. 1).
Таблица 1.
Активность ферментов сыворотки крови у больных в состоянии острого алкогольного психоза (М± SD)
|
Показатели |
Контрольная группа, n=28 |
Больные в состоянии ОАП, n=46 |
|
|
1-е сутки |
6-7-е сутки |
||
|
АСТ (ед/л) |
29,15±2,17 |
90,92±7,12*** |
76,35±5,06*** |
|
АЛТ(ед/л) |
22,96±2,11 |
44,78±4,37** |
51,26±5,25** |
|
ГГТ (ед/л) |
51,88±6,24 |
147,97±13,11*** |
146,89±18,60*** |
Примечание: * обозначены достоверно значимые различия по сравнению с контрольной группой; при *- р< 0,05, ** - р< 0,01, *** -р< 0,001.
Активность АСТ была максимальной на первые сутки и выше, чем в контрольной группе в 3 раза (p<0,001). Уровень активности АЛТ также был выше в 2 раза (p < 0,01) в 1-е сут. по сравнению со здоровыми лицами. По данным В.А. Ткачука (2004) [7], в крови активность АСТ может доминировать за счет высокой активности не цитоплазматического, а митохондриального изофермента АСТ, т.к. алкоголь способствует нарушению функций митохондриального аппарата, а нарушения целостности плазматических мембран в гепатоцитах не происходит. Токсическое влияние оказывают метаболиты алкоголя, в частности ацетальдегид, образующийся непосредственно в митохондриях.
Наиболее значимое по сравнению со здоровыми лицами наблюдалось повышение активности ГГТ - в 3 раза (p < 0,001). Установлено, что ГГТ является маркером токсического поражения печени, поскольку алкоголь является прямым индуктором синтеза ГГТ в эпителии желчных капилляров, в последующем происходит транслокация фермента через мембрану гепатоцитов. Повышение активности ГГТ – результат необходимости обеспечения в организме условий «нормального» протекания обменных процессов при алкоголизме, т.к. этот фермент играет роль в метаболизме глутатиона и цистеина и поддержании их уровня в тканях.
После проведения лечения на 6-7-е сут. имело место снижение активности АСТ на 18,9% по сравнению с 1-ми сут., но показатели оставались выше контроля на 61,6% (p<0,01), при этом отмечались максимальные значения АЛТ, также превышавшие данные параметры в контрольной группе в 2,2 раза (p<0,01).
На фоне низкого содержания общего белка и альбуминов удельное содержание фракции глобулинов находилось в пределах нормы на протяжении всего периода наблюдения, превышая, однако, показатели контрольной группы и имея индивидуальную динамику изменений (табл. 2).
Таблица 2.
Глобулиновые фракции в сыворотке крови у больных в динамике купирования ОАП (M±SD)
|
Показатели |
Контрольная группа, n=26 |
Больные в состоянии ОАП, n=48 |
|
|
1-е сутки |
6-7-е сутки |
||
|
α-1-глобулин, % |
2,7±0,17 |
4,8±0,19*** |
4,4±0,16*** |
|
α-2-глобулин, % |
5,7±0,22 |
8,9±0,26*** |
10,1±0,37*** |
|
β-глобулин, % |
11,6±0,29 |
10,5±0,24** |
11,1±0,28 |
|
γ-глобулин, % |
13,1±0,65 |
14,0±0,54 |
14,2±0,57 |
Примечание: * обозначены достоверно значимые различия по сравнению с контрольной группой; при *- р< 0,05, ** - р< 0,01, *** -р< 0,001.
Уровень α-1-глобулинов при ОАП превышал значение контрольной группы в 1-е сут. наблюдения на 77,7% (p<0,01), α-2-глобулинов - на 56,1% (p<0,01). Уровень β-глобулинов был ниже значения контрольной группы в момент госпитализации на 10,4% (p<0,01), γ-глобулинов – выше на 6,8%.
В динамике лечения наблюдалось незначительное снижение содержания общего белка, но повышение содержания альбуминов на 9,1% по сравнению с 1-ми сут., которое было ниже, чем у здоровых лиц, на 16,5% (p<0,001). При этом были зафиксированы максимальные значения α-2-, β- и γ-глобулинов. Наиболее значимым, по сравнению с 1-ми сут., было повышение α-2- глобулинов (p<0,001).
В связи с тем, что α-1- и α-2-глобулины относятся к БОФ, их прирост и повышенное содержание могут свидетельствовать о наличии острых воспалительных явлений в организме больных с СЗА в состоянии ОАП. Для уточнения указанной ситуации были исследованы другие белки, относящиеся к группе острофазовых. – фракции комплемента С3 и С4 (рис. 1).
Результаты исследования показали, что в динамике ОАП имело место значительное увеличение С3 и С4. Концентрация фракций комплемента С3 и С4 неуклонно нарастала в процессе наблюдения за больными с ОАП, однако лимит физиологической нормы не был превышен ни в одном случае.
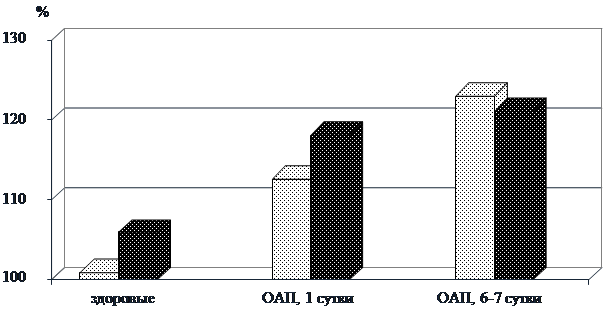
Рис. 1. Изменения содержания фракций комплемента С3, С4 сыворотки крови в динамике острого алкогольного психоза.
![]()
![]() Примечания: – С3, – С4.
Примечания: – С3, – С4.
Известно, что СРБ располагается в зоне α-2-глобулинов и является компонентом неспецифического иммунного ответа. По-видимому, основное значение СРБ заключается в распознавании потенциально токсических веществ, образующихся при распаде собственных клеток организма, связывании их и затем детоксикации и удалении из крови. СРБ, присоединённый к мембранам микроорганизмов и поврежденным клеткам, активирует каскад комплемента по классическому пути. Высокие показатели α-1 и α-2-глобулинов обусловлены как повышением СРБ, так и рядом других острофазовых белков, которые отражают метаболические сдвиги в организме во время купирования ОАП [2; 3].
Содержание СРБ на момент поступления пациентов в клинику превышало значение контрольной группы в 8,7 раза, p < 0,001 (рис. 2).
В динамике лечения содержание СРБ снизилось в 4 раза (p<0,001) по сравнению с 1-ми сут., но оставалось выше контроля (p<0,05).
Следовательно, нормализации показателей острофазовых белков не происходило к 6-7-м сут. исследования, что может свидетельствовать о значительных перестройках метаболизма у больных СЗА при ОАП. Вероятно, длительное употребление алкоголя приводит к повышенной продукции цитокинов (интерлейкина-1, интерлейкина-6, фактора некроза опухолей-α), что и вызывает реакцию, подобную воспалительной.
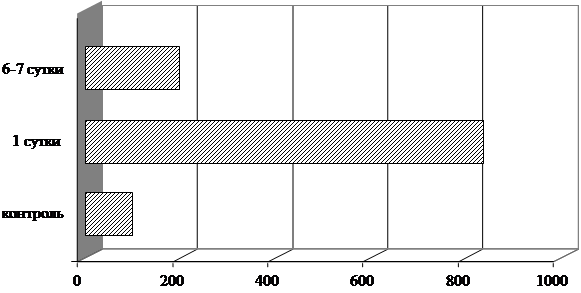
Рис. 2. Изменение содержания СРБ сыворотки крови в динамике острого алкогольного психоза (% от контроля)
Из изложенного следует, что к моменту развития ОАП в организме накоплен высокий воспалительный потенциал, который проявляется изменениями процессов белкового синтеза с гиперпродукцией БОФ. Воздействие алкоголя, как патогенного фактора, изначально трансформирует биохимические обменные процессы в организме больного, последующее прекращение его поступления является запуском механизма развития патологической стрессовой реакции.
В динамике наблюдения за состоянием больных с ОАП происходят компенсационные биохимические изменения, направленные на нивелирование воспалительных реакций и восстановление гомеостатического равновесия; нормализуется процентное соотношение белковых фракций и снижается концентрация БОФ.
Заключение. Таким образом, патофизиологические изменения белкового состава сыворотки крови у больных с синдромом зависимости от алкоголя характеризуются значительными перестройками белково-синтетической функции печени; тип протеинограммы демонстрирует воспалительный характер метаболических перестроек. Совокупность представленных данных позволяет обозначить синдром острого воспаления алкогольобусловленных постинтоксикационных состояний, что важно для полноценного понимания патогенеза синдрома отмены этанола и более эффективного оказания лечебно-диагностической помощи наркологическим больным.
Рецензенты:
Корчин Владимир Иванович, д.м.н., профессор, зав. кафедрой нормальной и патологической физиологии ГБОУ ВПО «Ханты–Мансийская государственная академия», ХМАО-Югра, г.Ханты-Мансийск.
Маркин Андрей Александрович, д.м.н., профессор, заместитель начальника кафедры психиатрии ФГКВОУ ВПО «Военно-медицинская академия им. С.М. Кирова» Минобороны РФ, г. Санкт-Петербург.
Библиографическая ссылка
Соловьева Н.В., Шидакова Н.А., Соловьев А.Г. ИЗМЕНЕНИЯ БЕЛКОВОГО СОСТАВА СЫВОРОТКИ КРОВИ У БОЛЬНЫХ С ОСТРЫМ АЛКОГОЛЬНЫМ ПСИХОЗОМ // Современные проблемы науки и образования. 2013. № 3. ;URL: https://science-education.ru/ru/article/view?id=9253 (дата обращения: 22.02.2026).



