С 2004 по 2009 г. отмечено увеличение абсолютного числа вновь выявленных больных как мужского (8,1%), так и женского (13,1%) пола. В России в 2009 г. выявлено 14 723 больных раком поджелудочной железы. Доля рака поджелудочной железы в структуре заболеваемости злокачественными новообразованиями органов пищеварения в России составила 11,4%, что соответствует 4-му ранговому месту после рака желудка, ободочной и прямой кишки [2].
Основным методом лечения РПЖ является хирургический. Однако, несмотря на совершенствование техники операции и интенсивной терапии, результаты лечения рака поджелудочной железы остаются неудовлетворительными. Продолжительность жизни пациентов после перенесенного радикального вмешательства не превышает 12–18 месяцев, а пятилетняя выживаемость среди всех диагностированных случаев рака поджелудочной железы не превышает 1% [4; 5].
Значение лучевой терапии, химиотерапии и химиолучевой терапии в лечении рака поджелудочной железы продолжает исследоваться, хотя их использование в виде адъювантной терапии остается спорным [6]. Попытки адъювантного лечения с помощью химиотерапии без сопутствующего облучения ложа удаленной опухоли не дают хороших результатов. Так, крупное американское рандомизированное исследование сообщает об отсутствии значимых различий выживаемости больных основной и контрольной группы. Сходные данные получены и в японских работах [1].
Основная часть опубликованных исследований 2-й фазы и ретроспективных анализов, посвященных предоперационной химиорадиотерапии данного заболевания, демонстрируют улучшение выживаемости [3], что и определило цель нашего исследования.
Цель исследования: улучшить результаты лечения больных раком поджелудочной железы.
Материалы и методы. Клинический материал касается 40 больных раком головки поджелудочной железы. В основную группу вошли 20 пациентов, которым была выполнена панкреатодуоденальная резекция с предоперационной химиолучевой терапией по разработанной нами методике. В контрольную группу вошло 20 больных раком поджелудочной железы, которым выполнена только аналогичная стандартная панкреатодуоденальная резекция. Средний возраст пациентов в основной группе составил 61,3±0,5; в контрольной - 59,8±0,6 года. Мужчин среди пациентов было 11 человек в основной группе и 8 в контроле, а женщин 9 в основной группе и 12 в контрольной.
Послеоперационное патоморфологическое исследование препаратов диагностировало протоковую аденокарциному различной степени дифференцировки. В основной группе высокодифференцированная опухоль имела место у 6/4 человек (30/20%) соответственно, умеренно дифференцированная – у 7/10 (35/50%), низкодифференцированная – у 5/4 (25/20%), нейроэндокринный рак –у 2/2(10/10%).
По стадиям заболевания, согласно седьмому изданию классификации TNM, пациенты основной группы распределились следующим образом: II стадия заболевания рT3NoMo наблюдалась у 7 пациентов (45%), III стадия у 11 больных (55%), из них рT2N1Mo встретилась у 8 человек (40%), а рT3N1Mo у 3 человек (15%). В контрольной II стадия заболевания рT3NoMo наблюдалась у 7 пациентов (35%), III стадия у 13 больных (60%): рT2N1Mo - 9 человек (45%), рT3N1Mo – 4 человека (20%). Различий между группами не было.
Методика. Больным основной группы до операции была выполнена катетеризация пупочной вены под местной анестезией с последующим проведением курса дистанционной гамма-терапии на аппарате «РОКУС-М» в статическом режиме укрупненными фракциями РОД= 3Гр на опухоль поджелудочной железы и зоны регионарного метастазирования. Терапия проводилась ежедневно по 5 фракций в неделю, СОД =40 Гр. На фоне лучевой терапии 1 раз в неделю пациентам вводили в катетер пупочной вены цисплатин в дозе 30 мг/м2 (суммарно 98±12 мг за курс). Кроме того, через установленный регионарный доступ 2 раза в неделю вводили 500 мг 5-фторурацила, всего 4 введения, суммарно 2000 мг. Оперативное пособие в объеме панкреатодуоденальной резекции производилось через 48-72 часа с момента последнего облучения.
Больным контрольной группы проводилась стандартная панкреатодуоденальная резекция с последующей неоадъювантной полихимиотерапией.
Для оценки эффективности проведенной терапии нами было выполнено исследование послеоперационных биоптатов опухоли на проточном цитометре BDFACSCantoII всем больным контрольной и основной группы и стандартное морфологическое исследование удаленных препаратов с целью выявления патоморфоза опухолевой ткани.
Результаты и их обсуждение. Прежде всего, следует отметить, что технических особенностей в проведении оперативного вмешательства у больных основной группы не было. Время операции составило 493±25 минуты в основной и 480±32 минуты в контрольной группе.
При морфологическом исследовании удаленных препаратов у больных основной группы опухоль была представлена трубчатыми структурами, состоящими из полиморфных клеток с гиперхромными ядрами, расположенными в один или два ряда, с наличием митотических фигур. В просветах желез было различное количество белкового секрета. Встречались участки опухоли, представленные мелкими сдавленными железами, с признаками апоптоза ядер. Опухолевые железы прорастали нервные стволики, сдавливали их, в них наблюдались дистрофические и атрофические изменения.
Со стороны стромы опухоли обращало внимание развитие плотной соединительной ткани, с большим содержанием плотных коллагеновых волокон, нередко с миксоматозом (рис. 1).
В отдельных участках стромы опухоли было видно наличие воспалительных клеточных инфильтратов, представленных лимфоцитами, гистиоцитами, что указывало на наличие хронического воспаления. Встречались очаги некроза как клеток опухоли, так и стромы, с окружающей слабовыраженной лейкоцитарной клеточной инфильтрацией.
Вокруг опухоли имелись признаки очагового хронического панкреатита, фиброз стромы, атрофические изменения островков Лангерганса, что мы расценивали как фоновые предопухолевые изменения ткани поджелудочной железы.
У больных контрольной группы ткань опухоли была представлена атипичными протоками, состоящими из крупных ветвящихся структур, выстилка которых содержала 2-4 ряда гиперхромных клеток. Раковый эпителий протоков желез содержал крупные ядра с мелкими многочисленными ядрышками, небольшой ободок светлой цитоплазмы. Содержание секрета в просветах отдельных протоков желез было небольшим, в большинстве случаев секрет отсутствовал. Атипичные протоковые структуры располагались по большей части ткани поджелудочной железы, с распространением как в экзокринный, так и в эндокринный отделы железы. Признаков некроза, апоптоза ядер, самих клеток в клетках опухоли не было обнаружено.
При изучении кинетики клеточного цикла диплоидных опухолей было установлено, что основная масса клеток опухоли поджелудочной железы в исследуемых группах находилась в G0/1-фазе клеточного цикла. При этом отмечено снижение доли клеток в фазе G0/1 от основной группы к контрольной. Так, в основной группе доля клеток в G0/1-фазе была несколько выше в сравнении с контрольной группой и составила 93,5±3,4%, тогда как в контрольной группе доля клеток в G0/1-фазе составила 90,9±3,1%. Полученные данные представлены в табл. 1.
Важным показателем, характеризующим биологическое поведение опухоли, является скорость пролиферации клеток. Этим признаком является количество клеток в S-фазе. В нашем исследовании минимальная скорость пролиферации диплоидных опухолей отмечалась в основной группе после проведения предоперационного химиолучевого лечения. Так, доля клеток в фазе синтеза в основной группе была в 1,4 раза меньше, чем в контрольной группе, и составила 6,6±0,4%, тогда как в контрольной группе этот показатель был равен 9,1±0,4%. Разница показателей достоверна по отношению к контрольной группе (p≤0,05).
Пролиферативная активность является ведущим фактором в механизме злокачественной трансформации клеток и в биологическом поведении уже возникшей опухоли. При сравнении пролиферативной активности опухолей, оцениваемой по индексу пролиферации (ИП) – сумме клеток, находящихся в синтетической, постсинтетической фазах цикла и в митозе, т.е. S+G2+M, оказалось, что диплоидные опухоли основной группы обладают меньшей пролиферативной активностью по сравнению с опухолями контрольной группы. Учитывая, что в нашем исследовании среди диплоидных опухолей доля клеток в фазе G2+M и в основной, и в контрольной группах была минимально одинаковой и составила 0,1±0,01%, индекс пролиферации определялся только долей клеток в фазе-S. Как мы отметили выше, в основной группе после проведения предоперационной химиолучевой терапии их доля была достоверно ниже, чем в контрольной группе, где такое лечение не проводилось.
Оценка выживаемости проводилась нами по методу Каплана-Майера. На рисунке 2 представлена выживаемость в основной и контрольной группах (рис. 2).
Из представленных данных видно, что основное различие между группами по выживаемости начинало формироваться с 400 дня (13,3 мес.) наблюдения и продолжалось до 600 дня (20 мес.).
Медиана выживаемости в основной группе составила 19,5 месяца, а в основной группе 14 месяцев.
Выводы: таким образом, можно сказать, что разработанная нами методика воздействует на первичную опухоль поджелудочной железы, снижает скорость пролиферации опухолевых клеток, увеличивает продолжительность жизни пациентов.
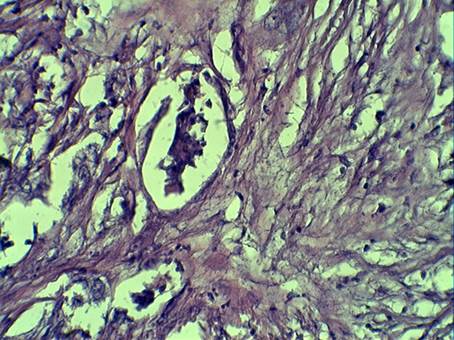
Рисунок 1. Апоптоз и десквамация клеток опухоли с фиброзом стромы.
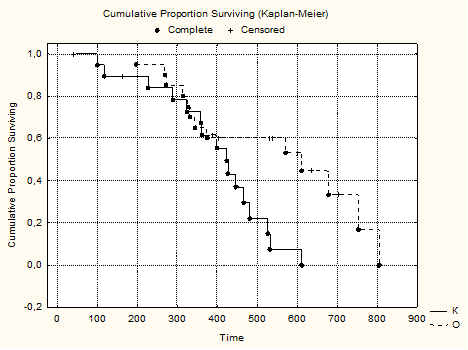
Рис. 2. Выживаемость больных по Каплану-Мейеру (CumulativeProportionSurviving) в основной (О) и контрольной (К) группах. Complete – летальный исход, Censored – цензурированный случай. SurvivalTime – время жизни (в днях). SurvivalFunction – функция выживания.
Таблица 1.
Распределение клеток по фазам клеточного цикла диплоидных опухолей поджелудочной железы в исследуемых группах (%)
|
Группы исследования |
G0/G1-фаза клеточного цикла |
G2+M-фаза клеточного цикла |
S-фаза клеточного цикла |
|
Основная группа |
93,5±3,4
|
0,1±0,01 |
6,6±0,4* |
|
Контрольная группа |
90,9±3,1 |
0,1±0,01 |
9,1±0,4 |
Примечания: * - достоверно при p≤0,05 по сравнению с контрольной группой.
Рецензенты:
Николаева Надежда Владимировна, д.м.н., ассистент кафедры онкологии Ростовского государственного медицинского университета, врач отделения гематологии ФГБУ «Ростовский научно-исследовательский онкологический институт» Минздравсоцразвития России, г. Ростов-на-Дону.
Каймакчи Олег Юрьевич, д.м.н., ассистент кафедры онкологии Ростовского государственного медицинского университета, г. Ростов-на-Дону.
Библиографическая ссылка
Касаткин В.Ф., Кит О.И., Максимов А.Ю., Джабаров Ф.Р., Горностаев А.С. НАШ ОПЫТ НЕОАДЪЮВАНТНОЙ ХИМИОЛУЧЕВОЙ ТЕРАПИИ РАКА ПОДЖЕЛУДОЧНОЙ ЖЕЛЕЗЫ // Современные проблемы науки и образования. 2013. № 3. ;URL: https://science-education.ru/ru/article/view?id=9209 (дата обращения: 14.02.2026).



