Введение
Газофазный способ получения нитрида алюминия с использованием в качестве исходных материалов металлического алюминия, трифторида алюминия и азота прошел опытно-промышленную проверку [2], но до сих пор ещё остаются вопросы, ответы на которые требуют дальнейших теоретических и экспериментальных уточнений, а именно:
· Определение реакций, по которым осуществляется процесс получения нитрида алюминия;
· Роль функциональных и конструкционных материалов в получении нитрида алюминия с нужными физическими характеристиками.
Настоящая работа посвящена термодинамическому анализу реакций, которые возможны в процессе получения нитрида алюминия газофазным способом, рассматривая эту процедуру как метод, который позволяет оценить наиболее вероятные химические превращения, что способствует выяснению механизма процесса.
2. Методы и материалы
Опытно-промышленное получение нитрида алюминия газофазным способом проводится при температурах выше 1000 °С и общем давлении газа в реакционной зоне близкой к атмосферному. Для термодинамического обоснования и анализа процесса была использована программа «HSC Chemistry 7». Программа позволяет учитывать фазообразование предельно большого количества твёрдых, жидких и газообразных фаз в результате термических превращений, выбранной фазовой смеси с учётом термодинамической вероятности процессов плавления, испарения образования нитридных, фторидных, оксидных, металлических продуктов всеми компонентами смеси.
Многими авторами показано – [1], [6], [9], что в диапазоне температур 1000 – 1500 °С взаимодействие идёт по реакции
AlF3(g) + 2Al(l) = 3AlF(g) (1)
3AlF(g) + N2(g) = 2AlN + AlF3(g) (2)
2Al(l) + N2(g) = 2AlN (3)
2Al(g) + N2(g) = 2AlN (4)
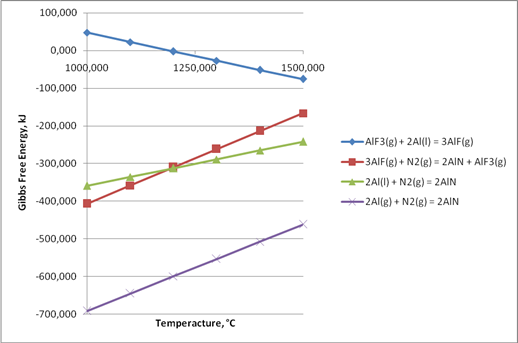
Рис. 1. Изменение энергии Гиббса для реакций 1 – 4
Согласно данным, приведённым в работе [8], давления паров монофторида и трифторида алюминия зависят от температуры, согласно следующим уравнениям:
lgP(AlF3) = 13.729 – 12970/T (5)
lgP(AlF) = 10.952 – 11800/T (6)
где Р – давление в Па
3. Теория и расчеты
Результаты расчёта свободной энергии Гиббса для реакции 1 – 4 приведены на рис.1.
Расчётные данные свидетельствуют о том, что реакция образования монофторида алюминия протекает при более низких температурах, чем экспериментально определено в работах [5].
Прямое азотирование алюминия возможно как в расплавленном, так и в газообразном состояниях. Однако азотированию жидкого алюминия может препятствовать плотная покровная плёнка нитрида алюминия [7]. Для сравнения в таблице 1 приведены молекулярные объёмы алюминия в различных агрегатных состояниях, оксида алюминия и нитрида алюминия, которые свидетельствуют, что мольные объёмы изменяются не более, чем на 15 % и, исходя из общеизвестных правил, подтверждают формирование плотных покровных слоёв продуктов реакции.
Таблица 1. Мольные объёмы некоторых соединений в системе Al – O – N
|
Соединение |
Al(l), 700 °C |
Al2O3(s) |
AlN(s) |
|
Мольный объём, см3/моль |
11,35 |
12,78 |
12,53 |
Условия равновесия прямого азотирования алюминия в газообразном состоянии по реакции (4) определяется двумя параметрами, и величина константы равновесия Kp = PN2·PАl будет зависеть от температуры и общего давления газовой фазы при неизменном составе газовой фазы или температуры и состава газовой фазы при постоянном общем давлении в реакционной зоне.
Для реакции (1):
Кр = Р3(AlF)/P(AlF3) и константа равновесия определяется двумя параметрами: температурой и общим давлением при постоянном составе газовой фазы или температурой и составом газовой фазы при постоянном давлении.
Для реакции (2):
Кр = Р(AlF)/P3(AlF3)·Р(N2) и константа равновесия определяется одновременно тремя параметрами: температурой, общим давлением и составом газовой фазы.
Для реакции (3):
Кр = 1/Р(N2) константа равновесия определяется одним параметром: температурой, давлением или составом газовой фазы.
Для реакции (4):
Условия равновесия описываются уравнением Kp = 1/P(N2)·P2(Al) и зависит от двух параметров.
Анализ уравнения (1-4) показывает, что изменение температуры или состава газовой фазы или общего давления в той или ином сочетании могут стимулировать или наоборот тормозить образование продуктов реакции, т.е. в конечном счёте – влиять на характер процессов при получении AlN по газофазному механизму.
О том, что газофазный процесс получения AlN исследован недостаточно, говорит то, что отсутствуют какие-либо опубликованные сведения о поведении присадок, которые в последующем играют заметную роль, например, в процессе спекания порошкообразного нитрида алюминия с целью получения компактных изделий. Наиболее распространённой присадкой является оксид иттрия, что нашло отражение в ряде работ [9], [10]. Нам показалось целесообразным проанализировать поведение присадки иттрия в процессах газофазного синтеза AlN. Остановимся на нескольких возможных реакциях с участием трифторида иттрия в условиях получения нитрида алюминия газофазным способом, тем более что трифторид иттрия имеет температуру возгонки, сопоставимую с температурой синтеза AlN.
2Al(l) + YF3(g) = YF(g) + AlF(g) (7)
Al(l) + 1,5 YF3(g) = 1,5YF(g) + AlF3(g) (8)
Al(l) + YF3(g) = Y + AlF3(g) (9)
YF3(g) + N2(g) = 2YN + 3F2(g) (10)
YF3(g) + Al2O3 = Y2O3 + 2AlF3(g) (11)
Термодинамический анализ показывает, что из приведённых реакций возможно только взаимодействие (11). Введение трифторида иттрия выводит из реакционной зоны оксида алюминия как нежелательной примеси и одновременно образуется оксид иттрия, который способствует в дальнейшем процессе спекания порошкообразного нитрида алюминия.
При анализе газофазного способа получения AlN не менее важен вопрос о влиянии функциональных и конструкционных материалов реакционной зоны на свойства конечного продукта – нитрида алюминия.
В идеальном случае реакционную зону следует футеровать нитридом алюминия, но это не всегда возможно, особенно в крупномасштабном производстве. Поэтому сегодня самым распространённым материалом, из которого изготавливаются узлы реакционной камеры, является графит. Рассмотрим возможные реакции в исследуемой системе:
4AlF(g) + 3C = Al4C3 + 2F2(g) (12)
4AlF3(g) + 3C = Al4C3 + 6F2(g) (13)
4Al(l) + 3C = Al4C3 (14)
2Al2O3 + 9C = Al4C3 + 6CO(g) (15)
YF3(g) + 2C = YC2 + 1.5F2(g) (16)
Термодинамическая оценка приведённых реакций показывает, что в условиях газофазного синтеза нитрида алюминия следует учитывать реакцию (14) с образованием карбида алюминия, как возможной гетерофазной примеси, существование которой подтверждается диаграммой состояния алюминия – углерод [1].
5. Выводы
1) На основании термодинамического анализа следует отметить, что в условиях газофазного синтеза нитрида алюминия возможно одновременное протекание нескольких процессов, ведущих к образованию AlN;
2) Изменение основных параметров (температуры, давления газовой среды, состава газовой фазы) позволяет влиять на соотношение различных процессов при газофазном синтезе AlN;
3) Трифторид иттрия является возможной добавкой для удаления кислорода, а, следовательно, повышения чистоты нитрида алюминия, получаемого газофазным способом;
4) Появление карбида алюминия, как нежелательной примеси в конечном продукте в условиях газофазного синтеза, происходит за счёт взаимодействия графита с металлическим алюминием.
Исследования проведены при поддержке Фонда Президента РФ Научной школы НШ-5669.20123.
Рецензенты:
Бамбуров Виталий Григорьевич, д-р хим. наук, главный научный сотрудник Института химии твёрдого тела УрО РАН, г. Екатеринбург.
Поляков Евгений Валентинович, д-р хим. наук, заместитель директора, заместитель председателя ученого совета, заведующий лабораторией физико-химических методов анализа Института химии твёрдого тела УрО РАН, г. Екатеринбург.
Библиографическая ссылка
Елагин А.А., Шишкин Р.А., Бекетов А.Р., Баранов М.В. ТЕРМОДИНАМИЧЕСКИЙ АНАЛИЗ РЕАКЦИЙ ПРИ ПОЛУЧЕНИИ НИТРИДА АЛЮМИНИЯ ГАЗОФАЗНЫМ СПОСОБОМ // Современные проблемы науки и образования. 2013. № 2. ;URL: https://science-education.ru/ru/article/view?id=9013 (дата обращения: 07.03.2026).



