Введение
Стандартный положительный электрод (далее – «катод») современного литий-ионного аккумулятора представляет собой пластину, напрессованную на алюминиевую фольгу (токосъёмник), состоящую из активного вещества (кобальтат лития или ортофосфат литий железа), токопроводящей добавки, обеспечивающей электронную проводимость электрода (как правило – сажи) и связующего (Ф2МЕ). Пластина электрода представляет собой пористое тело с пористостью 50–80%. Открытые поры (поры, имеющие выход на наружную, противоположную токосъёму поверхность) в процессе изготовления изделия заполняются жидким электролитом с проводимостью порядка 10-3 – 10-5 См/см, который обеспечивает ту же величину общей проводимости электродной пластины.
При работе электрода (допустим, в ходе заряда аккумулятора) через электрод протекают два потока заряженных частиц. В результате электрохимической реакции окисления активного материала электрода на границах радела фаз «металлический блокирующий электрод – твердый электролит - металлический блокирующий электрод» возникнет объемный заряд, который вносит свой вклад в ошибку разделения ионной и электронной проводимости. Кроме того, на достоверность измерений оказывают влияние частотная зависимость проводимости и время измерения.
Основу механизма функционирования литий-ионного аккумулятора (ЛИА) [1-10] составляет перенос зарядов, ионов и электронов. От эффективности осуществления этого процесса, в частности от скорости движения зарядов, зависят характеристики ЛИА. Поскольку мерой скорости движения зарядов является проводимость, то понимание процессов проводимости в ЛИА является ключевой проблемой явлений, как определяющих работу ЛИА в целом, так и задающих пути совершенствования характеристик ЛИА. Выделяют ионную и электронную проводимость. Совершенствование ёмкости современных ЛИА может быть достигнуто повышением электронной проводимости и диффузионной способности ионов в анодных и катодных материалах. Представленная ниже в таблице 1 полная сводка внутренних сопротивлений ячейки аккумулятора даёт понимание сложности процессов, имеющих место в ЛИА.
Таблица 1 - Внутреннее сопротивление ячейки [9]
|
Тип сопротивления |
Внутреннее сопротивление ячейки (Ri = ионное сопротивление + электронное сопротивление + граничное (межфазное)сопротивление) |
|
Ионное |
• Электродные (катодная и анодная) частицы |
|
• Электролит |
|
|
Электронное |
• Электродные (катодная и анодная) частицы |
|
• Проводящие добавки |
|
|
• Просачивания добавок в электроде |
|
|
• Токоподводы и токосъёмы |
|
|
• Электрические сигналы |
|
|
Граничное (межфазное) |
• Между электролитом и электродами |
|
• Между частицами электрода и проводящей добавкой |
|
|
• Между электродом и токосъёмом |
|
|
• Между проводящей добавкой и токосъёмом |
В настоящей работе мы остановимся на двух компонентах внутреннего сопротивления, а именно на ионной и электронной проводимости. Отметим сразу, что в случае ионного сопротивления подвижность ионов, ионная проводимость и коэффициент диффузии ионов - связанные свойства, в частности два последних процесса связаны уравнением σ = (9qi2ci/kBT)Di, где σ – ионная проводимость, qi - заряд частицы, ci -концентрация частиц в фазе, kB - постоянная Больцмана, T - температура, Di - коэффициент диффузии i-й частицы. Целью исследования является установление характеристик влияния условий синтеза катодных материалов на величины ионной и электронной проводимости, имеющих место в электродах, изготовленных из этих материалов.
Загрязнение окружающей среды и проблемы здоровья человека, вызванные выхлопными газами автомобильных двигателей внутреннего сгорания, побуждают общественные и правительственные организации предпринимать соответствующие действия для появления автомобилей, использующих альтернативные источники энергии. Поэтому стратегически важной целью является создание аккумуляторов, пригодных для использования в качестве источника энергии в гибридных автомобилях и электромобилях [1; 3-8] и в других устройствах.
Материалы и методы их исследования
Для приготовления электродной массы навеску порошка исследуемого материала в 0,3 г смешивали с раствором фторопласта Фп-2МЕ в N-метилпирролидоне, перемешивали стеклянной палочкой и обрабатывали на ультразвуковом диспергаторе (УЗДН-А) в течение 10 мин в режиме «интенсивность излучения» и «синхронизация» до образования однородной пасты. Конечное соотношение компонентов становилось 85/5/10% по массе в пересчёте на сухие компоненты. Полученную пасту наносили на поверхность коллектора тока.
В качестве коллектора тока использовали фольгу из алюминия толщиной 250 мкм и площадью поверхности 2 см2. Заготовки рабочих электродов загружали в холодный сушильный шкаф (марки SPT-200), поднимали температуру до 120 °C и сушили в течение 12 часов. Готовые электроды охлаждали в эксикаторе над слоем P2O5 и помещали на хранение в заранее подготовленный для работы перчаточный бокс с влажностью атмосферы менее 100 ppm (контроль влагомером «Байкал-3»).
Техника измерения ионной и электронной проводимости. Измерения проводили на мосту переменного тока Р577 по 1-3 различным схемам замещения при постоянном и переменном токе. Измеряли значения сопротивления R при постоянном и переменном токе, из которых рассчитывалась удельная проводимость s (См/см).
Электрохимический импеданс. Измерения проводили на мосту переменного тока Р-5021 в комплекте с нуль-индикатором Ф-582 и генератором сигналов ГЗ-36 (или на мосту Р-568 в комплекте с Ф-550 и ГЗ-106). Противоэлектродом служила платина. Импедансные измерения осуществляли в области частот от 2 до 200 кГц, амплитуда переменного напряжения составляла 1-3 мВ.
Результаты исследования и их обсуждение
При пропускании постоянного тока через твердый образец движение носителей происходит одномоментно и при повышении температуры изменяется электронная проводимость (sе). Если, например, носителями зарядов являются катионы, причем инжекция ионов из анода отсутствует, то, очевидно, по мере электролиза их концентрация в прианодной части уменьшается, и здесь возникает объемный заряд. Поле этого заряда противодействует электролизу, так что создается встречное движение ионов. Кроме того, должно наблюдаться встречное движение и за счет диффузии, поскольку при электролизе должен создаваться градиент концентрации катионов. Поэтому при пропускании постоянного тока проводимость уменьшается и остается лишь электронная составляющая.
Воздействие переменного тока стимулирует движение ионов и электронов, поэтому можно измерить сумму ионной и электронной проводимости (si+е). Разность si+е и sе определяет долю ионной проводимости в образце. Таким образом, разделение ионной и электронной составляющих проводимости можно осуществить при измерении сопротивления материалов на постоянном и переменном токе.
Данные экспериментов показывают, что методом электрохимического импеданса получаются более достоверные данные, соизмеримые с литературными данными. На рисунке 1 представлен типичный годограф катодного материала LiCoO2 при 20 °С, расчет из которого дает значения для ионной проводимости sLi+ = 3,04·10-4 см2/с, а для электронной sе- = 3,71·10-5 См/см.
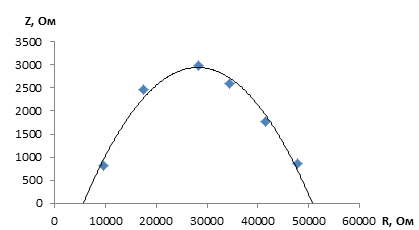
Рисунок 1 – Годограф катодного материала LiCoO2 при 20 °С в интервале частот от 0,06 до 200 кГц (d=100 мкм)
Анализ литературных данных по достоверности результатов измерений проводимостей лучше всего характеризуется следующей цитатой: «Критическая проблема, стоящая перед экспериментами, выполняемыми для того, чтобы сделать коэффициенты диффузии на заказ, состоит в том, что измеряемые величины очень широко зависят от условий эксперимента, измеряющей или моделирующей техники и методики изготовления электрода» [2].
Таблица 2 - Значения проводимости композита LiCoO2:БНКС-28АМН зависимости от способа измерения и расчета (ЭХИ - электрохимический импеданс, КДМ – кондуктометрия)
|
Способ измерения |
Способ расчета |
sе-, См/см |
si, См/см |
Di, см2/с |
D Di по [10] |
|
ЭХИ |
si /(si +sе-) |
7,9·10-3 |
9,5·10-4 |
9,5·10-5 |
10-7 – 10-11 |
|
КДМ |
si=si+е - sе- |
2,9·10-4 |
6,7·10-5 |
6,7·10-6 |
- |
|
КДМ |
si /(si +sе-) |
1,3·10-4 |
3,0·10-7 |
3,0·10-8 |
- |
Таблица 3 - Ранжировка результатов относительно коэффициента диффузии, Di.
|
№ п/п |
Образец (модификация, режим обработки) |
Di ∙10-6, см2/с |
se∙10-7, См/см
|
|
1 |
LiCoxNiyMnzO2 (22-см) |
0.1 |
40 |
|
2 |
LiCoxNiyMnzO2 (15 СМ) |
0.2 |
8,3 |
|
3 |
LiCoxNiyMnzO2 (21-см) |
0.5 |
7,1 |
|
4 |
LiMn2O4 (холостая для FM-15) |
0.5 |
37 |
|
5 |
LiMn2O4 (холостая для FM-12) |
0.5 |
37 |
|
6 |
LiMn2O4, (холостая для FM-13) |
0.6 |
190 |
|
7 |
LiCoxNiyMnzO2 (24-см) |
0.7 |
20 |
|
8 |
LiCoxNiyMnzO2 (23-см) |
0.8 |
90 |
|
9 |
LiCoxNiyMnzO2 (20 СМ) |
1 |
4,5 |
|
10 |
LiMn2O4 и LiFePO4 (FM 6) |
1.7 |
150 |
|
11 |
LiMn2O4 и LiFePO4 (FM 12) |
8 |
660 |
|
12 |
LiFePO4 холостая для FM-13 |
11 |
1700 |
|
13 |
LiMn2O4 и LiFePO4 (FM 16) |
12 |
620 |
|
14 |
LiMn2O4 (FM) |
12 |
1500 |
|
15 |
LiMn2O4 и LiFePO4 (FM 17) |
13 |
700 |
|
16 |
LiMn2O4 и LiFePO4 (FMLiFePO4) |
13 |
1900 |
|
17 |
LiMn2O4 и LiFePO4 (FM 4) |
18 |
2600 |
|
18 |
LiMn2O4 и LiFePO4 (FM 10) |
21 |
1600 |
|
19 |
LiMn2O4 и LiFePO4 (FM 13) |
24 |
3900 |
|
20 |
LiMn2O4 и LiFePO4 (FM 14) |
28 |
2600 |
|
21 |
LiMn2O4 и LiFePO4 (FM 15) |
28 |
2700 |
|
22 |
LiFePO4 (холостая для FM-15) |
32 |
1900 |
|
23 |
LiFePO4 (холостая для FM-14) |
39 |
1600 |
|
24 |
LiFePO4 (холостая для FM-12) |
49 |
4300 |
|
25 |
LiMn2O4 и LiFePO4 (FM 11) |
120 |
1400 |
|
26 |
LiCoO2 |
304 |
371 |
Анализ проведенных нами исследований также показал, что измеряемые и вычисленные значения ионной и электронной проводимости зависят от способа измерения и методики вычисления величин, как это видно из таблицы 2.
Основные измерения были выполнены кондуктометрическим методом. Полученные значения для всех образцов были ранжированы в таблице 3 относительно коэффициента диффузии. Поведение анализа взаимосвязи электронной проводимости и коэффициента диффузии показало, что для всех исследованных образцов данная зависимость носит практически линейный характер с коэффициентом корреляции 0,73.
В отдельных экспериментах была измерена температурная зависимость проводимости. На рисунках 2 и 3 представлены зависимости электронной проводимости от обратной температуры в интервале от 50 до 120 °С и ионной проводимости в интервале от 25 до 120 °С. Расчет энергии активации электронной проводимости для низкой температуры дает величину 2514,1, а для высокой 2265,7 Дж/моль.
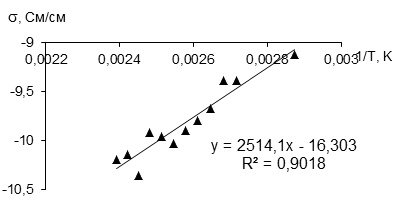
Рисунок 2 - Зависимость электронной проводимости LiFePO4 (хол для FM12, позиция 5 таблицы 3) от обратной температуры в интервале от 50 до 120 °С
Представленные в таблице 2 материалы можно разделить на 2 группы: первая - это двойные оксиды (смесь) LiMn2O4 и LiFePO4 (маркировка FM), а вторая - это тройные оксиды (смесь) LiCoxNiyMnzO2 (маркировка FM). Различие образцов одной маркировки заключается в различных режимах синтеза и условий активации, которые в данной работе не приводятся, так как являются объектом авторского права, и будут опубликованы в следующих работах.
Использование полимерного электролита предоставит возможность создавать очень тонкие элементы с большой рабочей поверхностью электродов в единице объёмов, т.е. позволит увеличить удельные характеристики аккумулятора [2]. Таким образом, при одинаковой удельной плотности, литий-полимерные батареи оптимальной формы могут хранить на 22% больше энергии, чем аналогичные литий-ионные. Это достигается за счет заполнения «мертвых» объемов в углах отсека, которые остались бы неиспользованными в случае применения цилиндрической батареи. Кроме этих очевидных преимуществ, литий-полимерные элементы являются экологически безопасными и более легкими, за счет отсутствия внешнего металлического корпуса.
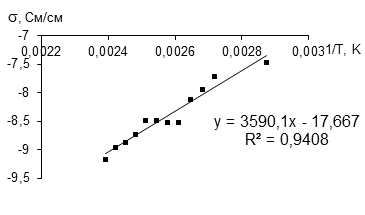
Рисунок 3 - Зависимость ионной проводимости LiFePO4 (хол для FM12, позиция 15 таблицы 3) от обратной температуры в интервале от 50 до 120 °С
В качестве гель-полимерного электролита литий-полимерного аккумулятора нами был выбран бутилнитрильный стирольный каучук (БНКС) марки 28АМН + 1 M LiBF4 ПК.
Применение этого электролита позволяет решить две проблемы: повысить ионную проводимость и избавиться от связующего, так как БНКС, на основе которого изготавливают этот электролит, обладает высокими адгезионными и прочностными характеристиками.
В таблице 4 представлены данные первого цикла гальваностатического (потенциостатического) заряда – разряда в зависимости от соотношения масс электродов. Из данной таблицы видно, что наиболее высокими показателями обладают аккумуляторы при соотношении масс электродов mк/ma от 3 до 3,5, но, так как избыток катода скажется в целом на массогабаритных характеристиках аккумулятора, более подходящим будет соотношение масс электродов 3:1.
Таблица 4 - Электрохимические характеристики ЛИА с гельполимерным электролитом в зависимости от соотношения активных масс электродов, 1 цикл.
|
Соотношение масс mк/ma |
Характеристики ЛИА |
||
|
Q, мАч |
Еср.разр, В |
||
|
заряд |
разряд |
||
|
1,501 |
120,5 |
79,54 |
3,37 |
|
2,031 |
119,94 |
80,91 |
3,41 |
|
2,493 |
126,17 |
98,13 |
3,40 |
|
3,085 |
131,56 |
117,15 |
3,42 |
|
3,503 |
135,14 |
121,78 |
3,45 |
|
4,097 |
129,74 |
119,67 |
3,44 |
Заключение
1. Показано, что транспортные характеристики исследуемых катодных материалов зависят от их состава, свойств, толщины, размера частиц, способа измерения.
2. Изготовлены и испытаны образцы литий-ионного аккумулятора с твердым электролитом. Показано, что они могут многократно циклироваться с емкостью, соизмеримой с жидкими электролитами.
3. Показано, что наиболее высокими удельными электрохимическими характеристиками обладают аккумуляторы с соотношением активных масс электродов mк:ma = 3:1.
4. Электрохимические характеристики электродов зависят от их плотности и толщины.
Работа выполнена в рамках госбюджетной темы № г/р 01201059376 при финансовой поддержке Российского фонда фундаментальных исследований (грант 11-03-12094).
Рецензенты:
Патрушева Т.Н., д.т.н., профессор, профессор кафедры приборостроения и наноэлектроники Сибирского федерального университета, г. Красноярск.
Пантелеев В.И., д.т.н., профессор, зав. кафедрой электротехнических комплексов и систем Политехнического института Сибирского федерального университета, г. Красноярск.
Библиографическая ссылка
Чудинов Е.А., Ткачук С.А., Шишко В.С., Кедринский И.А., Бахвалов В.Г., Кокорин А.Н. КИНЕТИЧЕСКИЕ И ТРАНСПОРТНЫЕ ХАРАКТЕРИСТИКИ ЭЛЕКТРОДОВ И ЭЛЕКТРОЛИТОВ // Современные проблемы науки и образования. 2013. № 3. ;URL: https://science-education.ru/ru/article/view?id=8832 (дата обращения: 22.02.2026).



