Введение
Как известно, азагетероциклы с двумя атомами азота в химическом синтезе представлены в основном производными имидазола. Некоторые из них, т.е. имидазолидин-2,4-дионы или гидантоины известны уже давно, а также широко известны методы их синтеза на основе реакций циклоконденсации 1,2-бифункциональных соединений с мочевинами в присутствии катализаторов [1]. Однако в работах В. А. Козлова и соавт. (с 2006 г.) показано, что α‑кетоглутаровая кислота в мягких условиях и без присутствия катализаторов вступает в реакцию конденсации с мочевиной с образованием гидантоинового производного – 3‑(2,5‑диоксо-2,5-дигидроимидазол-4-ил)-пропионовой (1) кислоты.
Цель исследования
Изучение возможности получения аналогичных производных с помощью других, близких по химическому строению к α-кетоглутаровой кислоте веществ, а также мочевин более сложного строения, и оценить промышленную перспективность синтеза 4(5)-замещенных гидантоиновых производных.
Материал и методы исследования
Способность к реакциям конденсации с карбамидом была выявлена у пировиноградной, мезоксалевой, глиоксиловой кислот и их этиловых эфиров.
Взаимодействие α-оксокислот (1), их эфиров (4) с мочевинами (2) осуществляли при мольном соотношении реагентов 1:1. Данное взаимодействие происходит между приблизительно равными количествами вещества мочевины (тиомочевины, гуанидина) и α-оксокислоты или ее эфира. Мочевины берутся в квалификации «х.ч.» в количестве ≈0,1 моль вещества; α-оксокислоты и их этиловые эфиры также берем в количестве ≈0,1 моль.
В четырехгорлой колбе, снабженной нагревательным элементом, термометром, электромешалкой и портативным pH-метром, в 70 мл дистиллированной воды при t=80-90 °С растворяем взятую навеску мочевины. Затем, из капельной воронки в течение 10 мин при непрерывном перемешивании постепенно добавляем указанное количество α-оксокислоты или ее эфира, растворенное в 10 мл воды.
Добавляем в реакционную смесь карбонат кальция (2 г) и при t=80-90 °С продолжаем перемешивание.
Во время всего процесса через каждые 2–3 мин фиксируем показатель pH и регистрируем момент скачка водородного показателя от области значений pH=1-3 до pH=6-8 (спустя 2,5 ч) и прекращаем процесс. Скачок водородного показателя в случае реакции между этиловыми эфирами α-оксокислот происходит раньше (спустя 1,5–2 ч).
Реакционную смесь доводим до комнатной температуры, помещаем в кристаллизатор, в котором в течение 5 дней образуются желтоватые гигроскопичные игольчатые кристаллы. Продукт подвергаем перекристаллизации, промываем 1 % раствором NaOH и осветляем активированным углем при 40 °С. Полученный после этих степеней очистки продукт реакции подвергаем методам количественного анализа.
Несколько иначе происходит взаимодействие мочевин и α-оксокислот в среде безводного спирта. Для осуществления реакции берем α-оксокислоту в квалификации «х.ч.» в количестве 0,014 моль. Мочевины также берутся в квалификации «х.ч.» и также в количестве 0,014 моль вещества (соблюдается эквимольное соотношение реагентов).
Первоначально добавляем взятую навеску α-кетокислоты в 102 мл абсолютного спирта и перемешиваем при 30-33 °С до ее растворения в четырехгорлой колбе, снабженной термометром и мешалкой. Добавляем навеску карбамида при непрерывном перемешивании. После чего содержимое колбы перемешивается в течение 30 мин также при умеренном нагреве на плитке до 30–33 °С, смесь в колбе-реакторе приобретает желтый цвет. Завершаем перемешивание, реакционную смесь фильтруем на складчатом фильтре. Из фильтрата на перегонной установке с обратным водяным холодильником отгоняем 4/5 объема спирта. После отгона спирта продукт реакции выделяется в виде вязкой тягучей массы бледно желтого цвета. Промываем продукт реакции 1 % раствором гидроксида натрия, сушим при комнатной температуре, взвешиваем и подсчитываем предполагаемый практический выход и подвергаем продукт физико-химическим методам анализа.
Результаты исследования и их обсуждение
В результате проведенных реакций были получены оксо-, тио- и иминопроизводные имидазола (3).
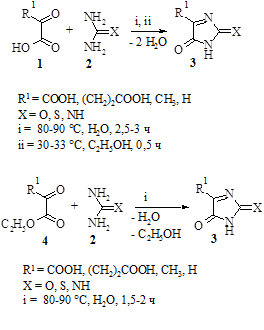
Время протекания реакции взаимодействия этиловых эфиров α-оксокислот и мочевин меньше времени взаимодействия соответствующих α-оксокислот с мочевинами. Это, по- видимому, связано с тем, что отщепление спирта в реакциях конденсации происходит активнее, чем отщепление воды.
Стоит отметить, что практический выход (43–67 %) целевых продуктов реакции 3 снижается за счет протекания побочных реакций образования нециклических продуктов – уреидов α-оксокислот (5) и им подобных соединений.
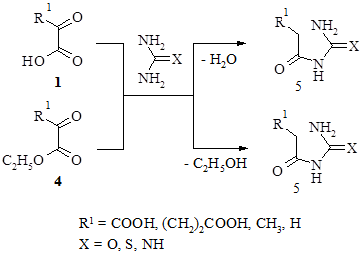
Полученные данные о побочных продуктах дают нам возможность показать гипотетическую схему протекания основных реакций циклоконденсации (гетероциклизации) между α-оксокарбоновыми кислотами (их эфирами) и мочевинами.
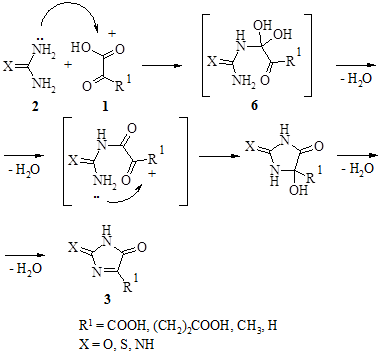
Процесс представляет собой совокупность последовательных, часто обратимых реакций, и в большинстве случаев их последовательность определяется тяжело, что связано с трудностями фиксирования интермедиатов. Предположительно реакции начинаются с образования интермедиатов 6, по строению напоминающих уреидокарбинол, с последующим замыканием имидазольного цикла по оксогруппе α-оксокарбоновых кислот. Продуктами циклоконденсации в этом случае являются производные 3, образующиеся в результате перегруппировки типа пинаколиновой.
Продукты реакции гетероциклизации в случае взаимодействия карбамида с α-оксокарбоновыми кислотами, как выяснилось, обладают хорошими гигроскопическими свойствами и способны к связыванию воды. Показана предположительная схема образования гидратных форм 7 этих производных. Основанием для этого послужили данные об исследовании методами рентгеноструктурного анализа протонированных форм карбамида в кислой среде [5].
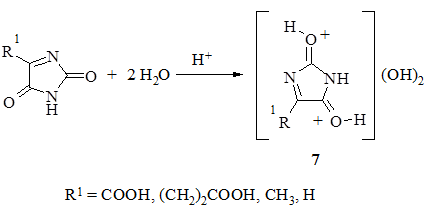
Строение синтезированных соединений было подтверждено данными газовой хроматографии и ЯМР-спектров, а состав – элементным анализом. Спектр ЯМР 1Н зарегистрирован на приборе Bruker DRX-500 с рабочей частотой 500,13 MHz, растворитель DMSO – d6. Внутренний стандарт ГМДС. Также вещества были определены с помощью газового хроматографа GCMS-QP2010S (Shimadzu, Япония) с масс-спектрометром и устройством прямого ввода DI-2010.
Приведем спектры ЯМР 1Н некоторых из полученных соединений, а именно 3-(2,5-диоксо-2,5-дигидро-1H-имидазол-4-ил)-пропановой кислоты (продукт взаимодействия карбамида и α-кетоглутаровой кислоты), который характеризуется наличием двух мультиплетов метиленовых протонов с химическими сдвигами 1,9 м.д. (2JHH(CH2) = 14,85 Гц) и 2,25 м.д. (2JHH(CH2) = 15,00 Гц; 3JHH(CH2-CH2) = 6,9 Гц). Синглеты имидных протонов обнаружены около значения d=8,1 м.д. (см. рис. 1) [3,4]. Также представим спектр ЯМР 1Н 2,5-диоксо-2,5-дигидро-1H-имидазол-4-карбоновой кислоты (продукт взаимодействия карбамида и оксомалоновой кислоты), для которого характерно наличие синглета имидного протона в районе d=10,92 м.д. и еще одного синглета водорода карбоксильной группы, зафиксированного в районе d=7,62 м.д. (см. рис. 2).
В качестве примера была произведена 3D-реконструкция молекул двух из реагировавших веществ (α-кетоглутаровой кислоты и карбамида) для демонстрации их взаимного расположения в начальный момент взаимодействия и образования связей типа «1–2» (см. рис. 3).
Производные имидазола – широко востребованные на сегодняшний день вещества в промышленном синтезе. Но подобные вещества образуются и в живых системах. Предположительный природный источник – парабиохимическая реакция в живых организмах. Например, 3-(2,5-диоксо-2,5-дигидро-1H-имидазол-4-ил)-пропановая кислота (8) образуется из α-кетоглутаровой кислоты и мочевины в результате реакции, сопровождающей цикл Кребса. Биологическая целесообразность ее существования в живых объектах может быть объяснена необходимостью связывания мочевины для снижения ингибирующего эффекта её высоких концентраций на клеточные ферменты [2,3,6].
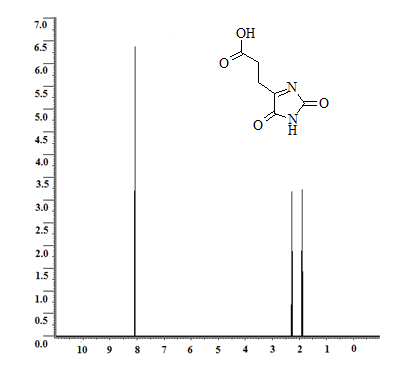
Рис. 1. ЯМР 1Н-спектр 3-(2,5-диоксо-2,5-дигидро-1H-имидазол-4-ил)-пропановой кислоты
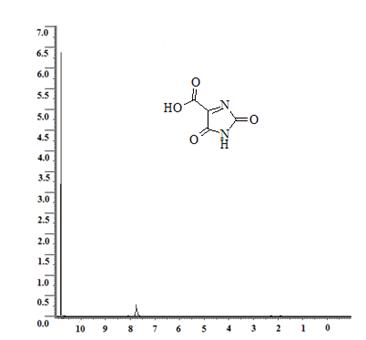
Рис. 2. ЯМР 1Н-спектр 2,5-диоксо-2,5-дигидро-1H-имидазол-4-карбоновой кислоты
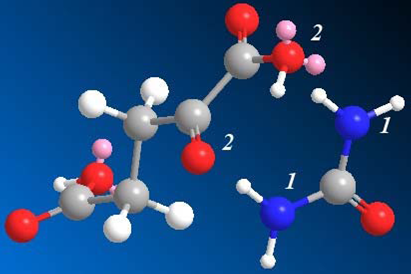
Рис. 3. 3D-реконструкция молекул карбамида и α-кетоглутаровой кислоты
Практическая значимость получения подобных оксо-, тио- и иминопроизводных имидазола in vitro состоит в том, что такие вещества, в большинстве своем, – основа для уникальных медицинских препаратов и диагностикумов.
Гидантоиновые и гликольуриловые производные являются важными продуктами и полупродуктами в фармацевтической промышленности, косметологии и т.д.; сфера их использования различна – от антисептических добавок в косметические средства до купирования маниакального синдрома при маниакально-депрессивном психозе.
Особую значимость в сфере практического применения результатов исследования имеет производство аминокислот на основе ферментативного разложения диоксопроизводных имидазола (гидантоинов). Гидролиз производных гидантоина позволяет получать ряд оптически активных аминокислот. Ферментативный гидролиз ряда монозамещенных гидантоинов происходит с образованием N-карбамоиламинокислот. С помощью фермента подвергаются гидролизу гидантоиновые производные аланина, валина, лейцина, серина, фенилаланина; на гидролиз производных лизина и аспарагиновой кислоты он не влияет [7].
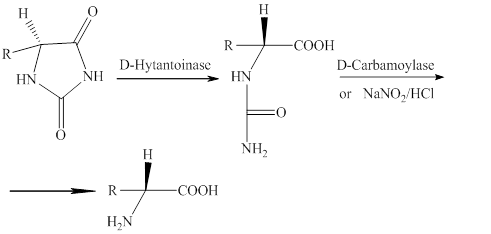
Вследствие сложившейся потребности органического синтеза в получении названных соединений, возникает необходимость в осуществлении реакций гетероциклизации с участием мочевин и α-оксокарбоновых кислот в мягких условиях.
Рецензенты:
Лыщиков Анатолий Николаевич, доктор химических наук, профессор, заведующий кафедрой общей, неорганической и аналитической химии химико-фармацевтического факультета ФГБОУ ВПО «Чувашский государственный университет им. И. Н. Ульянова, г. Чебоксары.
Лукин Петр Матвеевич, доктор химических наук, профессор, заведующий кафедрой химической технологии и защиты окружающей среды химико-фармацевтического факультета ФГБОУ ВПО «Чувашский государственный университет им. И. Н. Ульянова, г. Чебоксары.
Библиографическая ссылка
Козлов В.А., Новиков К.В., Кузьмина С.А., Мокеева Т.Г. КАРБАМИД И НЕКОТОРЫЕ α-ОКСОКАРБОНОВЫЕ КИСЛОТЫ И ИХ ЭФИРЫ ОБРАЗУЮТ ОКСОПРОИЗВОДНЫЕ ИМИДАЗОЛА В МЯГКИХ УСЛОВИЯХ // Современные проблемы науки и образования. 2013. № 2. ;URL: https://science-education.ru/ru/article/view?id=8780 (дата обращения: 07.03.2026).



