Введение
Лечебный эффект высокодозной химио- и радиотерапии у онкологических больных ограничивается развитием серьезных побочных эффектов, среди которых также особое место занимает депрессия кроветворения [2,5]. В связи с этим актуальна разработка новых гематомиелопротекторов, обладающих низкой токсичностью, возможностью длительного применения, способных уменьшать повреждение клеток крови, стволовых мультипотентных клеток костного мозга и ускорять восстановление гемопоэза [3,4,7], что существенным образом расширило бы возможности химио- и радиотерапии. С этой точки зрения для нас представляет научный интерес новый отечественный препарат дикарбамин (ОАО «ВалентаФарм», Россия, МНН – имидазолилэтанамидпентандиовой кислоты). Дикарбамин мало токсичен и не проявляет каких-либо побочных эффектов, оказывает защитное влияние на ряд показателей системы крови в условиях цитостатического воздействия [1,4,6], применяется в качестве средства сопровождения химиотерапии для снижения ее миелосупрессивных эффектов [1,6]. В условиях экспериментального радиогенного повреждения системы крови дикарбамин статистически значимо обеспечивает сохранность на достаточно высоком уровне циркулирующих эритроцитов, предупреждает развитие тяжелой послелучевой тромбоцитопении, уменьшает глубину пострадиационной лейкоцитопении, ускоряет процессы восстановления лейкоцитарного состава периферической крови до исходного уровня за счет сегментоядерных нейтрофилов и лимфоцитов [3].
Цель работы: изучение влияния дикарбамина при курсовом лечебно-профилактическом и лечебном режимах введения на клеточный состав кроветворной костномозговой ткани в условиях экспериментального радиационного повреждения.
Материалы и методы исследования
Исследование проведено в лаборатории кафедры общей и клинической фармакологии Медицинского института Пензенского государственного университета. Эксперименты были выполнены на 50 половозрелых кроликах-самцах породы Шиншилла массой 2,5–3,0 кг. Животных содержали на стандартном пищевом рационе вивария со свободным доступом к воде. Все манипуляции с животными проводились в соответствии с Правилами Европейской конвенции по защите позвоночных животных, используемых для экспериментальных и иных научных целей (ETSN 123, Страсбург, 18 марта 1986 г.) и были одобрены локальным этическим комитетом.
5. С учетом цели исследования было сформировано 5 групп животных. Группа № 1 (n=10) являлась интактной. Животные групп № 2 (п=10), № 3 (п=10), № 4 (п=10), № 5 (п=10) подвергались однократному воздействию ионизирующей радиации с помощью аппарата АГАТ-«С» в разовой очаговой дозе 5 Гр, расстояние от источника ионизации до ионизируемой поверхности составляло 90 см, процентная доза равнялась 94 %, а максимальная доза облучения составила 5,31 Гр. Дикарбамин (ОАО «ВалентаФарм», Россия) вводили перорально: животным группы № 3 в дозе 4 мг/кг дважды – через 1 ч и 24 ч после облучения, группы № 4 в дозе 15 мг/кг дважды – через 1 ч и 24 ч после облучения, группы № 5 в дозе 4 мг/кг ежедневно 5 дней до облучения и 10 дней после облучения. Для исследования костного мозга проводили пункцию подвздошной кости под местным обезболиванием раствором новокаина 2 % – 2,0 мл при помощи асептической аспирации иглой Кассирского и шприцом (обезвоженными) до начала эксперимента, на 3, 7, 10, 14, 21, 28 сутки. Из части полученного пунктата готовили мазки, другую – разводили для подсчета миелокариоцитов и мегакариоцитов. Производили цитологический анализ мазков пунктата. Рассчитывали индекс созревания нейтрофилов (ИСН), индекс созревания эритроцитов (ИСЭ): ИСН = промиелоциты+ миелоциты +метамиелоциты /палочкоядерные+ сегментоядерные нейтрофилы; ИСЭ =полихроматофильные+оксифильныенормоциты/ все клетки эритроцитарного ростка. Статистическую обработку результатов экспериментального исследования проводили с помощью пакета статистических программ: русифицированная версия программы STATISTICA 6.0 (StatSoft - Russia, 1999), BIOSTAT (S. A. Glantz, McGrawHill, перевод на русский язык - «Практика, 1998). Проверка нормальности распределения проводилась по критерию Шапиро – Уилка. Оценка равенства дисперсий производилась с помощью критерия Левена. Определялись основные статистические характеристики: среднее, стандартное квадратическое отклонение. Достоверность различий рассчитана с помощью Т-критерия Стьюдента в случае равенства дисперсий, его модификации (Т-критерий с раздельными оценками дисперсий) в случае неравенства дисперсий и с поправкой Бонферрони для множественных сравнений.
Результаты исследования и их обсуждение
В первую неделю после облучения происходило снижение клеточности у животных всех исследуемых групп. На фоне дикарбамина в первые дни после воздействия количество миелокариоцитов статистически значимо сократилось, затем началось интенсивное накопление клеток-предшественниц с восстановлением исходного уровня на 7-е сутки в опытных группах № 4, № 5 и на 14-е сутки – в группе № 3 (рис. 1). Классической пострадиационной динамики с опустошением кроветворной ткани после облучения, транзиторным подъемом за счет задействования сохранных очагов кроветворения, повторным уменьшением общего количества клеток отмечено не было. Абсолютное количество клеток-предшественниц в пробах оставалось на достаточно высоком уровне.
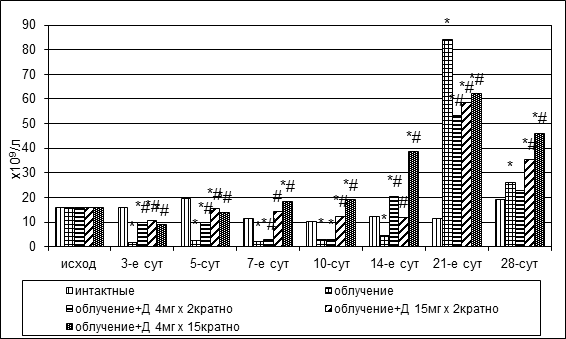

Рис. 1. Динамика абсолютного количества миелокариоцитов и мегакариоцитов в пунктате костного мозга кроликов при радиационном воздействии. Различия статистически значимы относительно:* – р<0,05 интактной группы; # – р<0,05 контрольной группы
После облучения без коррекции была выявлена пострадиационная костномозговая абсолютная мегакариоцитопения, сменившаяся абортивным подъемом и затем новым падением показателя. У животных, получавших дикарбамин, в первые 2 недели опыта отмечалось сокращение численности мегакариоцитов в среднем вдвое (рис. 1). Во второй половине месяца мегакариоцитарный росток был полностью восстановлен.
Воздействие ионизирующей радиации вызывало уменьшение количества митотически делящихся клеток кроветворной ткани костного мозга у животных всех групп ввиду индуцированных радиацией летальных повреждений миелокариоцитов, способных к пролиферации (рис. 2). У контрольной группы животных период абсолютного дефицита пролиферирующих предшественников продолжался 2 недели, численность митозов сократилась от 0,11±0,02х109/л до 0,017±0,011х109/л на 3-е (р1<0,05) и до 0,09±0,01х109/л на 14-е сутки (р1<0,05), в дальнейшем количество митотически делящихся клеток восстановилось. Период дефицита пролиферативных процессов в группе № 3 также продолжался 2 недели, однако значение показателя статистически значимо снижалось относительного такового в группе интактных животных всего в 2–3 раза.
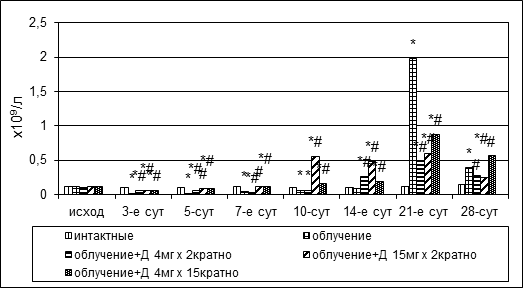
Рис. 2. Динамика абсолютного количества митозов в пунктате костного мозга кроликов при радиационном воздействии. Различия статистически значимы относительно: * – р<0,05 интактной группы; # – р<0,05 контрольной группы
Пострадиационное снижение митотической активности миелокариоцитов в группе № 4 наблюдалось только на 3-и сутки после облучения. Абсолютное количество митотически делящихся предшественников уменьшилось с 0,111±0,015х109/л до 0,06±0,008х109/л, однако уже на 7-й день было полностью восстановлено (0,12±0,02х109/л (р1=0,889, р2<0,05) и в дальнейшем не снижалось. Послелучевой дефицит пролиферирующих кроветворных предшественников в группе № 5 также наблюдался только на 3-и сутки, вместе с тем показатель оставался выше в 3 раза значения такового в контрольной группе (0,06±0,01х109/л, р,1<0,05, р,2<0,05), на 7-й день опыта абсолютное количество делящихся миелокариоцитов было полностью восстановлено – 0,09±0,02х109/л (р1=0,531, р2<0,05) и до конца эксперимента оставалось на достаточно высоком уровне – от 0,12±0,02х109/л до 0,88±0,07х109/л.
Радиационное повреждение вызывало костномозговую палочкоядерную и сегментоядерную нейтропению продолжительностью до двух – трех недель (рис. 3). В конце третьей недели отмечалось транзиторное увеличение количества палочкоядерных нейтрофилов, через неделю – повторное падение, содержание сегментоядерных нейтрофилов во второй половине опыта постепенно повышалось до 3,09±0,54х109/л.
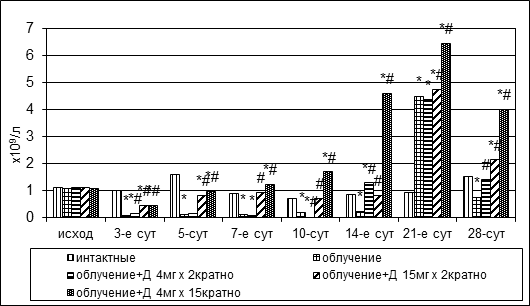
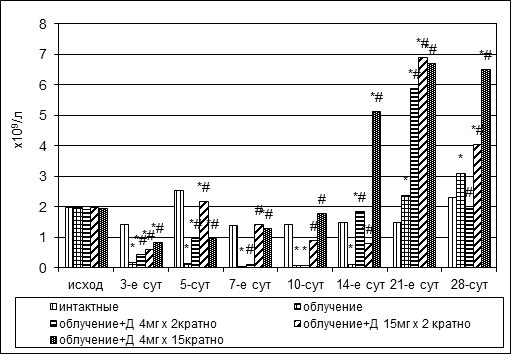
Рис. 3. Динамика абсолютного количества палочкоядерных и сегментоядерных нейтрофилов в пунктате костного мозга кроликов при радиационном воздействии. Различия статистически значимы относительно: * – р<0,05 интактной группы; # – р<0,05 контрольной группы
На фоне дикарбамина сокращение численности палочкоядерных и сегментоядерных нейтрофилов было менее выраженным, нежели в группе контроля, а дальнейшее накопление клеток – более интенсивным. Показатели достигли уровня интактных животных в опытных группах № 4, № 5 на 7-е сутки эксперимента, в группе № 3 – лишь на 14-е сутки (рис. 3).
Через 5 суток после радиационного повреждения в пунктате наблюдался относительный дефицит зрелых гранулоцитов, связанный, по-видимому, с гибелью клеток, составляющих пролиферативный гранулоцитарный пул, о чем свидетельствовало повышение ИСН до 1,51±0,22(р1<0,05) (0,85±0,016 у интактных животных) (рис. 4). В дальнейшем до конца третьей недели включительно показатель оставался повышенным в разной степени от 1,61±0,11 до 3,54±0,16, что было обусловлено, вероятно, уменьшением количества подлежащих дифференцировке гранулоцитов; на 28-е сутки ИСН снизился до 0,34±0,03, что свидетельствовало о наличии тенденции к восстановлению количественного состава пролиферативного и непролиферативного пулов.
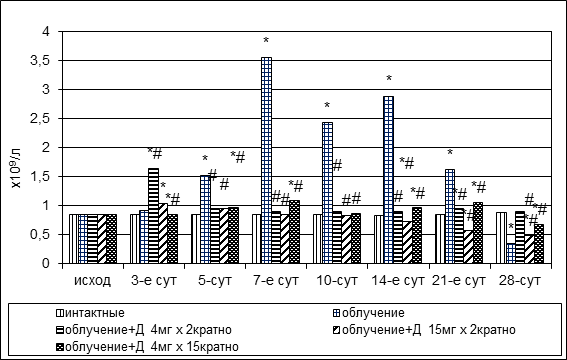
Рис. 4. Динамика ИСН в пунктате костного мозга кроликов при радиационном воздействии. Различия статистически значимы относительно: * – р<0,05 интактной группы; # – р<0,05 контрольной группы
ИСН у животных группы № 3 через 3 суток после повреждения повышался до 1,64±0,24 (р1<0,05, р2=0,223), в дальнейшем до конца эксперимента составлял 0,90±0,11 – 0,95±0,12. Значение индекса у животных группы № 4 через 3 суток после повреждения было равно 1,03±0,14 (р1<0,05, р2<0,05), к 5-м суткам повышалось до 0,95±0,21(р1<0,05, р2<0,05), затем снижалось, составив в конце наблюдения 0.49±0,13 (р1<0,05, р2<0,05). ИСН в группе № 5 через 3 суток после повреждения и использования дикарбамина составил 0,85±0,19 (р1>0,05, р2>0,05), оставался до конца эксперимента в пределах 0,67±0,12 – 1,08±0,21 (рис. 4). Таким образом, наблюдаемая динамика ИСН свидетельствовала о количественной и функциональной сохранности клеточного состава пролиферативных пулов вследствие эффективной цитопротекции дикарбамином клеток-мишеней ионизирующей радиации, что обеспечивало достаточность процессов пролиферации и дифференцировки в соответствующем ростке.
ИСЭ в контрольной группе животных с 5-х суток и до конца третьей недели не изменялся на фоне снижения абсолютного количества всех разновидностей эритрокариоцитов, что свидетельствовало о гибели части клеток ряда с одной стороны, с другой стороны – о наличии сохранных очагов кроветворения. Снижение ИСЭ к концу эксперимента от 0,64±0,07 до 0,57±0,06 (р=0,027) с одновременным накоплением компараментов эритроидного ряда свидетельствовало об оживлении пролиферативных процессов. На фоне дикарбамина статистически значимых изменений ИСЭ не отмечалось, что было расценено как адекватность компенсаторной регенераторной активностикроветворной ткани костного мозга.
В пределах лимфоцитарного ряда клеток цитопенический эффект наблюдался в первые 2 недели после облучения (рис. 5). Транзиторное увеличение данных клеток в пунктате было отмечено на 21-е сутки наблюдения. Дикарбамин удерживал количество лимфоидных элементов на 3-и сутки эксперимента на статистически более высоком уровне относительно группы контроля, а в дальнейшем способствовал более быстрому восстановлению их количества. Восстановление численности лимфоцитов в группах № 4 и № 5 произошло на 7-й день эксперимента, в группе № 3 – через 2 недели после облучения.
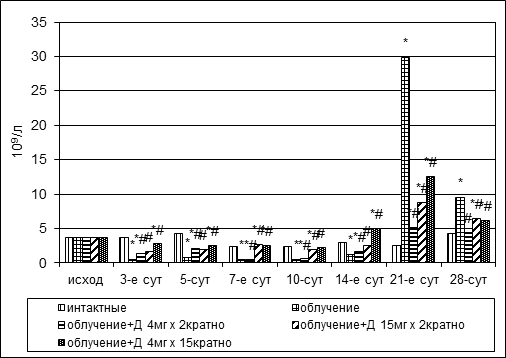
Рис. 5. Динамика абсолютного количества лимфоцитов в пунктате костного мозга кроликов при радиационном воздействии. Различия статистически значимы относительно: * – р<0,05 интактной группы; # – р<0,05контрольной группы
Выводы
1. Дикарбамин в различных режимах введения и дозах обеспечивал высокий уровень защиты пролиферирующих кроветворных предшественников в ранние сроки после лучевого воздействия, что выражалось в статистически значимом уменьшении глубины пострадиационного дефицита клеток, составляющих лимфоцитарный, моноцитарный, миелоидный, эритрокариоцитарный и мегакариоцитарный ряды.
2. Дикарбамин в изученных режимах введения и дозах сокращал период костномозговой постлучевой цитопении, способствовал нормализации процессов пролиферации и дифференцировки субпопуляций миелокароцитов; протективное действие препарата охватывало все ростки кроветворения. Динамика абсолютного количества митотически делящихся миелокариоцитов, индексов созревания нейтрофилов и эритрокариоцитов на фоне дикарбамина свидетельствовала о количественной и качественной сохранности клеточного состава пролиферативных пулов, достаточности процессов пролиферации и дифференцировки в соответствующих ростках.
3. Дикарбамин в лечебно-профилактическом режиме в дозе 4 мг/кг и лечебном режиме в дозе 15 мг/кг проявлял более выраженный миелопротекторный эффект, чем в лечебном режиме в дозе 4 мг/кг, что обусловлено, вероятно, более низкой курсовой дозой последней схемы введения.
4. Лечебный режим введения дикарбамина в дозе 15мг/кг может быть использован для реализации гемато- и миелопротекторного эффекта препарата в случае невозможности применения лечебно-профилактического режима.
Рецензенты:
Сипров А. В., д-р мед. наук, профессор кафедры фармакологии с курсом клинической фармакологии ФГБОУ ВПО «Мордовский государственный университет им. Н. П. Огарева», г. Саранск.
Микуляк Н. И., д-р мед. наук, профессор, зав. кафедрой «Физиология человека» ФГБОУ ВПО «Пензенский государственный университет», г. Пенза.
Библиографическая ссылка
Моисеева И.Я., Никишин С.А., Водопьянова О.А., Ионова С.А., Небольсин В.Е. СРАВНИТЕЛЬНОЕ ИССЛЕДОВАНИЕ МИЕЛОПРОТЕКТОРНОЙ ЭФФЕКТИВНОСТИ ДИКАРБАМИНА В РАЗЛИЧНЫХ ДОЗАХ И РЕЖИМАХ ВВЕДЕНИЯ В УСЛОВИЯХ ЭКСПЕРИМЕНТАЛЬНОГО ПОСТРАДИАЦИОННОГО КОСТНОМОЗГОВОГО СИНДРОМА // Современные проблемы науки и образования. 2013. № 2. ;URL: https://science-education.ru/ru/article/view?id=8766 (дата обращения: 07.03.2026).



