Введение
Cложные кислородные соединения висмута с кристаллической структурой силленита (КСС) обладают электрооптическими и магнитооптическими свойствами, что в сочетании с фотопроводимостью позволяет отнести их к перспективным оптоэлектронным материалам для создания электро- и магнитооптических модуляторов лазерного излучения, различных запоминающих устройств и т.д. [6]. Однако различные проблемы материаловедческого характера, возникающие при получении кристаллов требуемого в квантовой оптике качества, существенно ограничивают круг возможных применений этих материалов [2, 3]. Одной из них является проблема получения ферритной керамики заданного состава в условиях твердофазного синтеза.
В системе Bi2O3 – Fe2O3 образуется три инконгруэнтно плавящихся соединения с соотношением компонентов 25Bi2O3:Fe2O3, Bi2O3:Fe2O3 и Bi2O3:2Fe2O3 [7]. Феррит висмута BiFeO3 является мультиферроиком и рассматривается как один из наиболее перспективных материалов для спинтроники [4]. Особенности твердофазного синтеза этого соединения исследованы в [9]. Установлено, что высокотемпературный твердофазный синтез не позволяет получить образцы однофазного BiFeO3 из смеси исходных оксидов стехиометрического состава, отчасти потому, что вначале, при относительно низких температурах, в смеси образуется Bi25FeO39. Кроме того, феррит висмута Bi25FeO39 с КСС представляет значительный интерес как материал для магнитооптики, однако сложности получения монокристаллов этого соединения из расплава определяют необходимость изучения механизма его твердофазного синтеза.
Методики исследования
Воспроизводимость результатов твердофазного взаимодействия зависит от многих факторов, в частности, от размера и пространственного расположения частиц реагентов, содержания в них примесей, влаги, распределения температуры в объеме реагирующей смеси и т.д. Объективные данные о продуктах реакции, о механизме и кинетике процесса может дать только совокупность методов исследования. Поэтому для исследования твердофазного взаимодействия использовали метод свободной поверхности и метод радиоактивных изотопов (РАИ), а идентификацию фазового и химического состава исходных оксидов и продуктов реакции проводили с помощью рентгенофазового (РФА) и локального рентгеноспектрального (ЛРСА) анализов.
Метод свободной поверхности позволяет надежно определять положение фазовой границы при взаимодействии исходных оксидов, предварительно спрессованных в виде дисков (таблеток). В качестве указателя исходной границы в этом методе используется плоскость одной из таблеток, имеющих разные диаметры. Преимуществом метода является возможность изучения механизма реакции при минимальной толщине слоя продукта реакции. Кроме того, используя поверхность сначала одной, а затем другой таблетки системы, легко проконтролировать экспериментальные результаты.
Таблетки Bi2O3 и Fe2O3 получали прессованием оксидов в интервале давления 9.8•106 – 2,45 •108 Па. Оптимальную величину давления определили по его влиянию на коэффициент диффузии Bi2O3 в оксид железа (III) (рис. 1). При давлении 9.8•107 Па вклад поверхностной и граничной диффузии в процесс формирования диффузионной зоны минимален и в экспериментах обеспечивается преимущественно объемный характер диффузии Bi2O3 через реакционную зону.
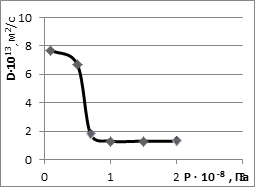
Рис. 1. Влияние давления предварительного сжатия оксидов на коэффициент диффузии в системе Bi2O3 – Fe2O3
Для устранения влияния паров воды (которую использовали как пластификатор при прессовании), а также возможных фазовых превращений на кинетику процесса, таблетки отжигали при максимально допустимых температурах до полной усадки образца. При таблетировании оксидов железа (III) и висмута температуры спекания составляли 1273 и 963 К, время спекания 10 и 7 часов соответственно. Для создания надежного контакта поверхности таблеток тщательно шлифовали.
Таблеточным методом твердофазные реакции изучали в том же интервале температур, что и синтез соединения с КСС в стехиометрической смеси 25Bi2O3:Fe2O3 в течение 1 – 8 суток. Размер реакционной зоны определяли на оптическом измерительном микроскопе МБИ-6. Относительная погрешность таких измерений составляла 7.5 % при величине надежности α=0.95.
Расчет диффузионных параметров системы Bi2O3 – Fe2O3 выполняли по уравнениям, справедливым для диффузии из полубесконечного образца в полубесконечный с применением радиоактивных изотопов 59Fe, 207Bi. Построение концентрационных кривых проводили авторадиографическим методом. Распределение элементов в диффузионной зоне, а также уточнение геометрии фронта реакции выполняли методом ЛРСА (МS-46, JXA-3) с использованием расфокусированного зонда (~6 мкм ).
Обсуждение результатов
В [2] показано, что в стехиометрической смеси 25Bi2O3:Fe2O3твердофазное взаимодействие сопровождается образованием как Bi25FeO39, так и промежуточной фазы BiFeO3. Исследование твердофазного взаимодействия при получении соединений со структурой силленита в других системах обнаружило влияние метастабильных фаз на эти процессы [2, 3, 10].
Контактный отжиг диффузионных пар Bi2O3 и Fe2O3 показал, что в системе преобладает односторонний перенос Bi2O3, связанный, по-видимому, с большей склонностью Bi2O3 к диссоциации молекул, чем Fe2O3. Это согласуется с величиной энергии диссоциации связей Bi-O и Fe-O: 342,6 и 463,3 кДж/моль соответственно [5]. После отжига оксиды легко разделялись, причем продукт реакционной диффузии оставался целиком на Fe2O3. Первоначальная локализация продукта реакции в поверхностном слое Fe2O3 затрудняла доставку висмута в объем таблетки Fe2O3, уменьшая со временем скорость взаимодействия компонентов (рис. 2).
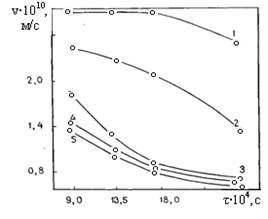
Рис.2. Зависимость скорости роста реакционной зоны от времени процесса в системе Bi2O3 – Fe2O3 для температур: 1 – 1013 К, 2 – 983 К, 3 – 953 К, 4 – 923 К, 5 – 893 К
На образце Bi2O3, диаметр которого больше диаметра образца Fe2O3, наблюдается углубление (рис. 3). Поверхность Bi2O3, как индикаторная плоскость, однозначно указывает направление диффузионного потока частиц. В Bi2O3 железо методами ЛРСА и РАИ не обнаружено.
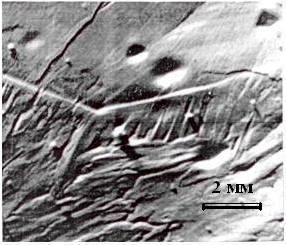
Рис. 3. Поверхность Bi2O3 после контактного отжига с Fe2O3
Увеличение температуры отжига интенсифицирует расширение реакционной зоны в диффузионных парах (рис. 4, 1–4), а линейность зависимости ![]() (рис. 4, кривые 5–9) указывает на диффузионный характер транспортировки реагентов в реакционную зону.
(рис. 4, кривые 5–9) указывает на диффузионный характер транспортировки реагентов в реакционную зону.
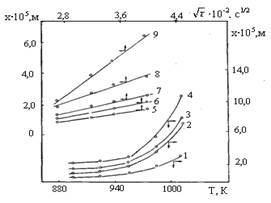
Рис. 4. Зависимость величины реакционной зоны в системе Bi2O3 – Fe2O3 от температуры (1–4) и времени отжига (5–9): t: 1 – 1,0; 2 – 1,5; 3 – 2,0; 4 – 3,0 сут. Т: 5-893; 6-923; 7-953; 8-983; 9-1013 К
Энергия активации реакции образованияBi25FeO39 (ЕК) и диффузионного перемещения компонентов системы (Ед) приведены в таблице.
Таблица
Энергетические характеристики диффузионной системы
|
Е, кДж/моль |
Температура отжига, К |
|
|
Т < 953 |
Т >953 |
|
|
ЕК ЕД |
38,6 60,3 |
167,9 443,5 |
При температуре около 953 К изменяется угол наклона кривых, отображающих температурную зависимость как условных констант скорости реакции образования Bi25FeO39, так и коэффициентов диффузии от обратной температуры, что связано, вероятно, с изменением механизма взаимодействия компонентов.
РФА продуктов взаимодействия диффузионной пары Bi2O3 – Fe2O3 показал, что он коррелирует с фазовым составом синтезированной при различных условиях стехиометрической смеси. Габитус кристалликов на поверхности Fe2O3 после контактного отжига с Bi2O3 аналогичен кристаллам на поверхностиобразцов 25Bi2O3:Fe2O3, спрессованных в таблетки и отожженных длительное время.
Следует отметить, что эта особенность в формировании фаз распространяется не только на термодинамически стабильные соединения Bi25FeO39 и BiFeO3, но и на метастабильные фазы, в частности, на γ - Bi2O3. Длительный отжиг стехиометрической смеси 25Bi2O3:Fe2O3 без периодической гомогенизации (72 ч; 1043 К) приводит к образованию γ* - Bi2O3. Послойный РФА диффузионной зоны пары Bi2O3 – Fe2O3 показал, что поверхность Fe2O3 после контактного отжига с Bi2O3 покрыта Bi25FeO39. Последующий слой по направлению к Bi2O3 и параллельный фронту реакции имеет состав BiFeO3. Формирование фаз в реакционной зоне, судя по концентрационному распределению висмута в Fe2O3, происходит следующим образом. При неравенстве парциальных коэффициентов диффузии оксидов висмута и железа рост слоя продукта сопровождается его перемещением в объем Fe2O3. Как показал количественный ЛРСА, содержание элементов во внешнем слое АВ соответствует соединению со структурой силленита Bi25FeO39, в среднем ВС – BiFeO3, а во внутреннем слое СД – монотонному уменьшению концентрации висмута с глубиной диффузионного слоя (рис. 5).
Используя представления о микромеханизме диффузии [1], можно предположить, что ионы висмута, входя в ячейку Fe2O3, вступают с ней в химическое взаимодействие в ближнем порядке, не нарушая однофазности оксида железа. И только по достижению ионами висмута концентрации, соответствующей стехиометрическому составу Bi25FeO39 или BiFeO3, возникает новая фаза, а граница (Bi2O3, Fe2O3) постепенно смещается в объем Fe2O3. Продолжающийся диффузионный транспорт висмута в объем реакционной зоны приводит к дестабилизации решетки BiFeO3 с последующим выделением фазы, обогащенной висмутом – феррита висмута Bi25FeO39 с КСС.
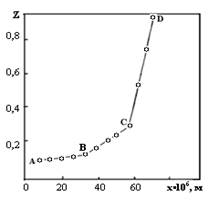
Рис. 5. Изменение функции ![]() с глубиной реакционной зоны в диффузионных парах Bi2O3 – Fe2O3
с глубиной реакционной зоны в диффузионных парах Bi2O3 – Fe2O3
Значения парциальных коэффициентов диффузии висмута в реакционной зоне: D(Bi25FeO39)=1,5•10-14м2/с; D(BiFeO3)=3,2•10-16м2/с; D(Bi2O3,Fe2O3)=1,3•10-17м2/с показывают, что транспорт висмута через Bi25FeO39 осуществляется с большой скоростью. Это подтверждает реальность рассуждений относительно последовательности расположения фаз в слое продукта реакции.
Таким образом, экспериментально установлено, что твердофазный синтез феррита висмута с КСС осуществляется в диффузионном режиме за счет преимущественного массопереноса составных частей оксида висмута.
Рецензенты:
Шиманский Александр Федорович, доктор химических наук, профессор, заведующий кафедрой композиционных материалов и физико-химии металлургических процессов Института цветных металлов и материаловедения ФГАОУ ВПО «Сибирский федеральный университет» Министерства образования и науки РФ, г. Красноярск.
Трифанов Иван Васильевич, доктор технических наук, профессор, зав. кафедрой управления качеством и сертификации ФГБОУ ВПО "Сибирский государственный аэрокосмический университет" Министерства образования и науки РФ, г. Красноярск.
Библиографическая ссылка
Ендржеевская - Шурыгина В.Ю., Жереб В.П., Скориков В.М. МЕХАНИЗМ ТВЕРДОФАЗНОГО СИНТЕЗА ФЕРРИТА ВИСМУТА BI25FEO39 // Современные проблемы науки и образования. 2013. № 2. ;URL: https://science-education.ru/ru/article/view?id=8733 (дата обращения: 07.03.2026).



