Введение
В последние годы литий-ионные аккумуляторы (ЛИА) рассматриваются как перспективные автономные источники тока с постепенно расширяющимся рынком сбыта [1–5]. Согласно маркетинговым исследованиям [5], в 1999 г. они занимали около 50 % рынка основных аккумуляторов (в стоимостном отношении) (30 % никель-металл-гидридный, 20 % никель-кадмиевый), в настоящее время доля их только выросла. Действительно, ЛИА по своим электрохимическим показателям (весовым и объемным) превосходит все известные типы аккумуляторов. Среднее разрядное напряжение ЛИА составляет 3,8 В. Верхнее ограничение напряжение при заряде – 4,2 В, нижнее при разряде – 2,5 В. Диапазон рабочих температур – минус 20 °С плюс 60 °С. Ток заряда –от С/10 до С. Токи разряда – от С/8 до 2С. ЛИА нашел широкое потребление в портативной электронике и электротехнике (сотовые телефоны, портативные компьютеры, видеокамеры, электроинструмент), в электромобилях.
Выпуск ЛИА начался в 1990 году с объявления компаниями «SonyEnergytecInc.» и «MoliEnergyLtd» [3,4] о выпуске элементов, основанных на системе углерод / LiCoO2 и углерод / LiNiO2. Исследователи [4] показали осуществимость системы углерод / Li1+XMn2O4. В 1991 году сразу несколько других компаний (Sanyo, Matsushita, Hitachi) продолжили разработку литий-ионной технологии.
Рассматриваемый ЛИА представляет собой систему “кресло-качалка”, в котором используются в качестве электродов две литиевые матрицы, ионы лития во время циклирования элемента могут быть интеркалированы и деинтеркалированы из одной матрицы в другую. Различие в химическом потенциале лития внутри каждой матрицы создает напряжение элемента.
Создание Li-ионного аккумулятора стало возможным после открытия явления интеркаляции (внедрения), суть которого заключается в возможности внедрения чужеродного атома (молекулы, иона, атома) в структуру материала (межплоскостное пространство, места дислокации дефектов). В случае применения слоистых соединений углерода образующиеся соединения внедрения получили название межслоевые соединения (МСС) [1].
Стехиометрия образующихся МСС углерода соответствует соединениям внедрения типа ХС24, ХС18, ХС12, ХС6, где Х внедренный атом (Li). Например, ХС18 означает, что на три ароматических кольца углерода приходится один атом внедренного вещества.
Согласно [1] в интервале потенциалов от 0,08 до 1 Вв LiхC6 наблюдается четыре ступеньки потенциала для электрода из кокса, хотя в литературе существует мнение о том, что процесс интеркаляции в аморфные материалы не имеет четко выраженных ступеней, при этом потенциал начала интеркаляции около 0,8 В. Каждая из ступеней соответствует обратимому поведению МСС углеродной матрицы.
Электрохимическая интеркаляция ионов лития в графитовые структуры протекает в области потенциалов 0,4 – 0,001 В (Li/Li+) (при потенциале ниже 0,25 В [1]), а в аморфные и мезофазные структуры в области 0,9 – 0,001 В [1]. Установлено, что глубина интеркаляции и активность интеркалированного лития (т.е. равновесный потенциал электрода) существенно зависит от степени графитизации материала.
Процесс интеркаляции простирается до области в немногие мВ относительно лития, то есть значительно ниже предела разложения наиболее общих электролитов. Разложение электролита приводит к образованию поверхностной защитной пленки, которая обеспечивает непрерывное действие карбонизированных анодов. С другой стороны, образование этой пленки сопровождается некоторой необратимой начальной ёмкостью, дающей в результате выделение газообразных продуктов, что является крайне нежелательным для эксплуатации и с точки зрения безопасности элемента.
При этом принципиальная возможность реализации обратимой электрохимической интеркаляции ионов лития в слоистую структуру углеродного материала без разрушения графитовых слоев определяется свойствами образующегося из продуктов восстановления компонентов электролита поверхностного слоя. Если образующийся поверхностный слой имеет преимущественно ионную проводимость (при пренебрежимо малой проводимости электронов), то он препятствует внедрению сольватированного иона лития. В противном случае, происходит либо отложение металлического лития на поверхности углеродных частичек в виде дендритов лития, либо интеркаляция объемных сольватированных ионов лития в структуру углеродного материала, приводящая к раздвижению углеродных слоев с разрывом связей (расслоением), что, в свою очередь, приводит к разрушению углеродного материала и электрода на его основе. Несмотря на то, что при внедрении десольватированного иона лития удельный объем LiC6 на 10 % больше объема исходного углеродного материала [4], напряжение углеродных слоев не достигает критической точки и поэтому данный электрод способен к многократному циклированию.
В качестве матрицы отрицательного электрода ЛИА широкое применение нашли всевозможные углеродсодержащие материалы [1] с широким спектром физико-химических характеристик. Наиболее оптимальными структурами материала отрицательного электрода является аморфная и мезофазная, которыми обладают коксы, пирографиты, антрациты, в отличие от высокоструктурированных графитов (природных, искусственных), применение которых затруднено вследствие разрушения электрода при циклировании.
Материалы на основе различных коксов, синтетических графитов, углеродных волокон, углеродной черни и продукты пиролиза различных веществ при соответствующем подборе электролита циклируются со значениями параметра Х в LiхC6, равным 0,42-0,63, 0,85-1,00, 0,40-0,54,0,88-0,93 и 0,73-2,15 соответственно, разброс величин связан с механизмом взаимодействия материалов с электролитом.
Выбор электролита непосредственно связан с выбором углеродного материала отрицательного электрода, поскольку от свойств образующегося на углеродном электроде поверхностного слоя из продуктов восстановления компонентов электролита зависит его циклируемость и удельные электрохимические характеристики.
В основном в качестве электролита используют следующие системы [1]: ЭК-ДЭК, хлор-ЭК и содержащий воду ДМК, в которых пассивирующая защитная пленка образуется на углеродном электроде при потенциале значительно выше (положительнее отн. Li/Li+) потенциала интеркаляции ионов лития. В таких растворителях, как ПК, ТГФ, МФ, углеродный электрод разрушается перед или в процессе интеркаляции. В ПК разрушение углеродного электрода происходит при потенциалах выше потенциала интеркаляции.
Разложение электролита сильно тормозится добавкой в электролит краун-эфиров [1] или добавкой в активную массу графитового электрода сажи с удельной поверхностью 40 м2/г. Разложение электролита тормозится в присутствии газообразного СО2, который способствует образованию Li2CO3 на поверхности углеродного электрода при более высоких потенциалах (отн. Li/Li+), чем потенциал интеркаляции.
Материалы и методы их исследования
Рабочие электроды испытывались в гальваностатическом режиме, при перемежающихся циклах заряда и разряда током той же плотности тока. Для обработки полученных результатов использовались представления хронопотенциометрии.
Для изготовления электродов в качестве материала связующего использовали раствор фторопласта ФП-2МE в N-метилпирролидоне, электропроводной добавки – ацетиленовый технический углерод А-437. Содержание связующего в положительном и отрицательном электродах, в пересчете на абсолютно сухое вещество, составляло 10 %, электропроводной добавки – 5 % для отрицательного и 12 % для положительного электрода.
Результаты исследования и их обсуждение
В таблице 1 приведены электрохимические характеристики материалов отрицательного электрода ЛИА в электролите на основе этиленкарбоната (LP71), а в таблице 2 в электролите на основе пропиленкарбоната (ПК). По приведенным в таблице 1 данным можно сделать вывод о том, что для практического использования в качестве анодного материала ЛИА могут быть рекомендованы материалы, производимые фирмой SuperiorGraphiteCo (USA) и углеродный материал CZ-50 (Япония), которые имеют хорошие емкостные характеристики и относительно небольшое значение (10 – 20 %) необратимой емкости.
Анализируя данные таблицы 2, можно сделать вывод о том, что приемлемыми результатами по числу рабочих циклов, обратимой и необратимой составляющей емкости обладают следующие материалы: образцы активных углей 1Б и 5Б спектрально-чистый графит, графитизированный войлок, углеткань. Использование электролита на основе ПК не позволяет достичь высоких результатов по числу рабочих циклов и по обратимой емкости при низких потерях на необратимые процессы.
Таблица 1. Удельная емкость анодных материалов ЛИА. Электролит LP71
|
Анодный материал |
Qразряда, мА·ч/г |
Qнеобр, мА·ч/г |
|
Углеродный материал ФГУП НИИЭИ |
340 |
108 |
|
ЭГ-15 (фракция до 50 мкм) |
351 |
110 |
|
ЭГ (фракция до 10 мкм) |
360 |
104 |
|
Терморасширенный графит ЦНИИМ |
311 |
178 |
|
Углеродный материал «FormulaBTSLA -1115» |
352 |
53 |
|
Углеродный материал «FormulaBTSLA -1020» |
354 |
54 |
|
Углеродный материал «FormulaBTSLA -1520» (3%сажи Eunsacco) |
353 |
58 |
|
Нанотрубки (1А) |
370 |
145 |
|
Нанотрубки (1В) |
370 |
168 |
|
Углеродный материал CZ-50 (NipponCarbon) |
360 |
36 |
Таблица 2. Экспериментальные данные интеркаляции – деинтеркаляции лития на углеродных материалах в электролите ПК-ДМЭ - 0,6 моль/дм3LiClO4
|
Материал |
№ цикла |
Qзар, мАч/ г |
Qразр, мАч/ г |
Qнеобр, мАч/ г |
Х , в |
LixC6 |
|
заряд |
разряд |
|||||
|
Войлок НТМ-200 |
1 5 |
380 110 |
140 98 |
240 12 |
1,02 0,29 |
0,37 0,25 |
|
Графит Курейского месторождения |
1 5 |
410 67 |
40 45 |
370 14 |
1,17 0,18 |
0,11 0,12 |
|
Активный уголь 1Б |
1 5 |
764 144 |
180 106 |
474 38 |
2,05 0,38 |
0,49 0,28 |
|
Активный уголь 5Б |
1 5 |
764 312 |
225 290 |
539 22 |
2,05 0,84 |
0,61 0,78 |
|
Графит спектрально-чистый С-3 |
1 5 |
432 142 |
135 128 |
297 14 |
1,16 0,38 |
0,36 0,34 |
|
Графит алмазного производства |
1 5 |
627 159 |
150 134 |
377 25 |
1,41 0,43 |
0,41 0,36 |
На характеристики электродов существенное влияние оказывает режим и условия обработки. В таблице 3 приведены электрохимические характеристики электродов из природного графита Завальевского месторождения в зависимости от предварительной обработки. Из данной таблицы видно, что более высокими электрохимическими характеристиками обладают электроды, прошедшие процедуру терморасширения (реструктурирования) (далее пенографит) с последующим кипячением в ацетоне. При этом величина данных характеристик зависит от содержания наночастиц. Показано, что наиболее высокой разрядной (обратимой) емкостью обладают электроды с содержанием наночастиц более 90 %, заряженных в первом цикле по методу короткого замыкания.
Таблица 3. Электрохимические характеристики электродов из природного графита Завальевского месторождения в зависимости от обработки
|
Стадии обработки |
Емкость, мАч/г 1 цикл |
Емкость, мАч/г, 30 цикл |
||||||
|
Qзар |
Qобр |
Qн/б |
Э, % |
Qзар |
Qобр |
Qн/б |
Э, % |
|
|
Исходный |
407 |
29 |
378 |
7,1 |
6,7 |
5,2 |
1,5 |
77,6 |
|
Модифицированный |
409 |
37 |
372 |
9,0 |
25,9 |
25,1 |
0,8 |
96,9 |
|
Деструктурированный |
431 |
139 |
292 |
32,3 |
159,0 |
157 |
2 |
98,7 |
|
Обработка ацетоном деструктурированного |
417 |
218 |
199 |
52,3 |
267 |
265 |
2 |
99,3 |
Использование жидких электролитов представляет определённые неудобства, связанные, в частности, с явлениями, имеющими место при аварийной разгерметизации корпуса, а именно – пожароопасностью, возможностью отравления и т.п.
Для предотвращения нежелательных последствий необходимо исключить контакт с внутренними компонентами. Вдох паров электролита может быть опасен. Материал может реагировать с водой, испуская малые количества газообразного фтористого водорода.
Представляется перспективным замена жидкого электролита на твёрдый. Известны попытки разместить твёрдый электролит в полимерной плёнке [6], что существенно упрощает систему, но не устраняет необходимость пропитки пористых активных тел жидким электролитом.
Дальнейшим развитием способов использования твёрдого электролита может явиться полный отказ от жидкого электролита и размещение частиц твёрдого электролита в матрице активных материалов обоих электродов. При этом разделитель катода и анода может быть либо плёночным на основе полимерной плёнки с включёнными в неё частицами твёрдого электролита.
В качестве объекта исследования был избран положительный электрод состава: активное вещество – LiCoO2, связующее – фторопласт Ф2МЕ, растворитель для связующего – N-метилпирролидон, электропроводная добавка – сажа марки А437, твёрдый электролит Li1,3Al0,3Ti1,7(PO4)3 (ТЭ).
В качестве основы полимерного электролита был использован полимер БНКС-28АМН (бутадиен-нитрильный каучук синтетический), а также акрилат R280, а соли – LiBF4.
Циклирование макетов литий-ионого аккумулятора с гель-полимерным электролитом (БНКС) и катодом, содержащим ТЭ в объеме 3 %, показало, что они способны к многократному циклированию с емкостью порядка 3 Ач, как это показано на рисунке 1.
Также экспериментально доказано, что на основе промышленных полимеров (акрилата марки R280, БНКС-28АМН) при использовании раствора LiClO4 в смеси растворителей (пропиленкарбоната с диметоксиэтаном) с концентрацией 0,075-1,2 моль/дм3 может быть изготовлен гель-полимерный электролит, использование которого в литий-ионном аккумуляторе позволяет получить результаты, сходные с характеристиками ЛИА с жидким электролитом марки LP70 (рисунок 2).
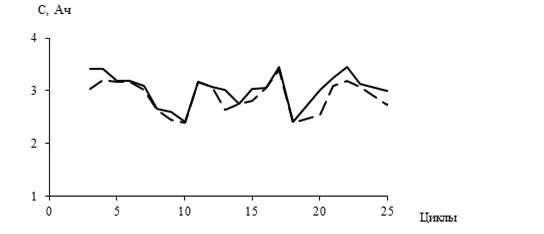
Рисунок 1. Зависимость зарядной ( - ) и разрядной (--) емкостей ЛИАот цикла
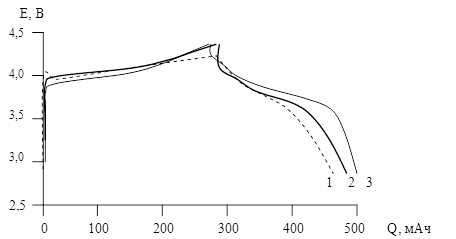
Рисунок 2. Зарядно-разрядные кривые 5-го цикла ЛИА F300 (СZ-50/LiCoO2) в зависимости от электролита: 1 – гелевый на R280; 2 – гелевый на основе БНКС-28АМН; 3 – LP-70
Зависимость эквивалентной электропроводности гель-полимерного электролита на основе акрилата марки R280 от концентрации LiClO4 в температурном интервале от 25 до 140 º С носит линейный характер. Из зависимости lnλ от 1/T было найдено, что при повышении концентрации LiClO4 от 0,075 до 1,2 моль/дм3 энергия активации процесса проводимости снижается почти вдвое с 6,35 до 3,38 кДж/моль.
Заключение
1. На удельные электрохимические характеристики отрицательного электрода существенное влияние оказывает природа исходного углеграфитового материала и условия их обработки, а также свойства образующегося на его поверхности слоя.
2. Для промышленного использования в качестве материала отрицательного электрода ЛИА можно использовать спектрально-чистый графитиуглеродный материал CZ-50.
3. Массогабаритные электрохимические характеристики литий-ионных аккумуляторов с гель-полимерными электролитами на их основе акрилата R280 и БНКС-28АМН соизмеримы с показателями аккумуляторов с жидким электролитом.
4. Показано, что введение ионных проводников (твердых электролитов) в электроды литий-ионного аккумулятора способствует повышению их электрохимических характеристик.
Работа выполнена в рамках госбюджетной темы № г/р01201059376 при финансовой поддержке Российского фонда фундаментальных исследований (грант 11-03-12094).
Рецензенты:
Патрушева Т. Н., д.т.н., профессор, профессор кафедры приборостроения и наноэлектроники Сибирского федерального университета, г. Красноярск.
Пантелеев В. И., д.т.н., профессор, зав. кафедрой электротехнических комплексов и систем Политехнического института Сибирского федерального университета, г. Красноярск.
Библиографическая ссылка
Чудинов Е.А., Ткачук С.А., Бахвалов В.Г., Кокорин А.Н., Шишко В.С. КОМПОЗИЦИОННЫЕ МАТЕРИАЛЫ ДЛЯ ЛИТИЙ-ИОННОГО АККУМУЛЯТОРА // Современные проблемы науки и образования. 2013. № 2. ;URL: https://science-education.ru/ru/article/view?id=8652 (дата обращения: 07.03.2026).



