Введение
Для человека свойственна высокая индивидуальная вариабельность в обонятельной чувствительности. Разнообразие отмечается как в отношении общей остроты обоняния, так и в отношении интенсивности восприятия и качественной оценки запаха некоторых веществ. Достаточно хорошо известно явление специфической аносмии, или «запаховой слепоты», под которым понимают неспособность здорового человека с нормальной общей остротой обоняния распознавать запах определенного вещества в той концентрации, которая доступна для большинства людей [3, 9]. Всего описано около десяти специфических аносмий к различным группам химических соединений, среди которых у человека наиболее распространена специфическая аносмия к летучему стероиду андростенону (5α-андрост-16-ен-3-ону). Это явление притягивает к себе интерес ученых уже более полувека, представляя собой уникальную модель, позволяющую раскрыть глобальные механизмы функционирования обонятельного анализатора млекопитающих. Накопленные данные свидетельствуют о том, что обонятельная чувствительность к андростенону (АНД) в значительной мере контролируется такими факторами, как генотип, пол, возраст и индивидуальный опыт, краткому рассмотрению которых посвящен данный обзор.
Вариабельность в обонятельной чувствительности к андростенону у человека
Согласно данным масштабных зарубежных исследований, от 30 до 50 % индивидуумов в популяции обладают специфической аносмией к андростенону [8, 15]. По нашим оценкам, в европейской части России АНД (3.13х10-3 % р-р в минеральном масле) не детектируют чуть меньше половины (49 %) опрошенных [1, 2]. Интересно, что чувствительные к АНД люди описывают этот запах по-разному. Индивидуумы с низкими порогами детекции чаще характеризуют его как неприятный, напоминающий мочу или пот запах, тогда как люди с высокими порогами чувствительности – как приятный, сладковатый, мускусный или цветочный запах. Дихотомическое распределение порогов обонятельной чувствительности к андростенону в экспериментальной выборке Дж. Лейбоуз и Ч. Вайсоки [27] представлено на рис.1.
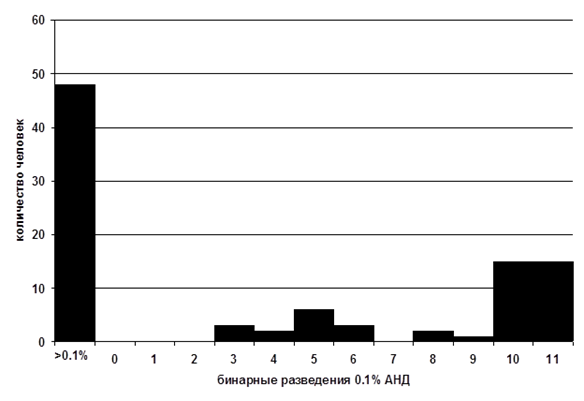
Рис. 1. Распределение порогов обонятельной чувствительности к андростенону в выборке испытуемых из США (по [27])
Функциональное значение специфической аносмии к АНД у человека непонятно. Андростенон (5α-андрост-16-ен-3-он) – С19-стероид гонадного происхождения, один из наиболее известных классических феромонов. У рецептивных самок свиней АНД способствует принятию характерной позы лордоза [32]. Этот стероид присутствует в продуктах из свинины, сельдерее, трюфелях. Соединение также обнаруживается в моче, плазме крови и подмышечных выделениях человека [17]. АНД и близкий ему по структуре стероид андростадиенон предполагают в качестве кандидатов на роль модуляторных феромонов человека, однако это остается недоказанным. В литературе описывают влияние андростенона на настроение, сексуальное поведение и сексуальную привлекательность у людей [12, 14, 30].
Уже в самых ранних работах, посвященных изучению явления специфической аносмии у человека [8, 20], была выдвинута гипотеза о том, что каждой разновидности аносмии соответствует генетический дефект специализированной обонятельной рецепторной клетки. Позднее в исследованиях на близнецах и при анализе родословных было подтверждено, что обонятельная чувствительность к андростенону в значительной мере определяется генетическими факторами. В работе Ч. Вайсоки и Г. Бичама [43] совпадение по способности или неспособности распознавать запах АНД в парах идентичных (монозиготных, однояйцовых) близнецов составило 100 %, тогда как в парах неидентичных (дизиготных, разнояйцовых) близнецов лишь 61 %. Коэффициент корреляции между порогами чувствительности к АНД у однояйцовых близнецов был равен 0.95, а у разнояйцовых – 0.22, что подтверждает значимость вклада генетических факторов. Близкие по значению корреляции были получены на другой выборке близнецов независимой группой исследователей [19]. Анализ семейных родословных (67 семей из окрестностей г. Филадельфия, США) показал сложный характер наследования обонятельной чувствительности к АНД. Исследователями рассматривалась гипотеза, объясняющая наблюдаемое распределение через возможное сцепление признака с X-хромосомой, однако дальнейшего подтверждения и развития она так и не получила [46].
На обонятельную чувствительность к андростенону оказывают влияние пол, возраст и индивидуальный обонятельный опыт. Так, было описано значительное снижение чувствительности к АНД и близкому по структуре стероиду андростадиенону с возрастом, в особенности у мужчин в период полового созревания [13, 21, 45]. Доля специфических аносмиков по отношению к АНД мужского пола в возрастной группе 15–20 лет в три раза превышает таковую в возрастной группе 9–14 лет [13]. Более того, в отношении АНД был описан феномен индукции обонятельной чувствительности у человека. В исследовании Ч. Вайсоки половина испытуемых со специфической аносмией к АНД после ежедневных принюхиваний (трижды в день по 3 мин) приобрела чувствительность к запаху в течение одной-трёх недель после начала экспозиции [44]. У изначально чувствительных к АНД людей также снижаются пороги чувствительности к этому веществу после повторных предъявлений запаха [41]. Полагают, что в основе проявления индуцированной чувствительности к запахам может лежать два механизма: периферический (реализуется на уровне рецепторного звена обонятельного анализатора) и центральный (за счет центральных влияний). В пользу периферического механизма пластичности у человека говорят исследования, выполненные с отведением электроольфактограмм от обонятельного эпителия человека: амплитуда электрофизиологического ответа возрастает в процессе экспозиции к АНД наряду с индукцией обонятельной чувствительности к стероиду у людей, исходно малочувствительных к андростенону [41]. Возможно, центральные влияния также стимулируют индукцию обонятельной чувствительности. Так, экспозиция нечувствительных испытуемых к АНД в условиях эксперимента с одной «выключенной» ноздрей приводила к снижению порогов чувствительности к АНД в одинаковой мере в обеих ноздрях [28].
В исследовании, выполненном на впечатляющей своим объемом выборке близнецовых пар (всего 917 человек из 4-х стран), был оценен вклад генетических и средовых факторов в вариабельность обонятельной чувствительности к АНД [24]. В основе анализа лежало допущение о том, что монозиготные близнецы имеют полностью идентичный набор генов, а дизиготные – только наполовину идентичный, в то время как обе разновидности близнецовых пар в одинаковой степени подвержены действию средовых факторов. По результатам данной работы, было получено, что аддитивные генетические эффекты объясняют 28 % фенотипической вариабельности в интенсивности восприятия запаха АНД и 21 % в отношении оценки приятности/неприятности запаха. Возможно, не слишком высокие оценки вклада генетических факторов явились следствием погрешности в определении чувствительности при помощи “scratchandsniff” (потри и понюхай) тестов, которые в большинстве случаев проводились дистанционно, в неконтролируемых условиях. Однако для запаха лимона, использованного в том же исследовании в качестве контроля, роль генетических факторов вообще оказалась пренебрежимо мала.
OR7D4 – рецептор андростенона у человека?
Наиболее значимым событием в области хемосенсорных наук за последние десятилетия стало открытие обширного семейства генов обонятельных рецепторов [11]. Позднее, в 2004 году эта работа была удостоена Нобелевской премии в области физиологии и медицины. Обонятельные рецепторы (ОР) по своей структурной организации, способности связываться с G-белками и активировать их, были отнесены к суперсемейству семидоменных трансмембранных белков-рецепторов, ассоциированных с G-белками (GPCR) [22, 26]. По всей видимости, связывание с одорантами (запаховыми сигналами) и активация ОР происходит согласно известным принципам взаимодействия лиганд-рецепторов. Особенно впечатляет широта спектра обонятельных рецепторов. В геноме мыши насчитывается около 1000 функциональных генов ОР [47, 48], у человека их значительно меньше – около 350 [16, 50]. В целом, у млекопитающих гены ОР составляют 3–5 % от общего числа генов в организме. Несмотря на то, что количество функциональных обонятельных рецепторов велико, число запахов, которые мы можем детектировать, несравнимо больше. На основании того, что существует множество обонятельных рецепторов с уникальным спектром лигандов, и того, что каждое пахучее вещество распознается многими типами рецепторов, был сделан вывод о существовании комбинаторного принципа кодирования сигнала на уровне рецепторного звена обонятельного анализатора [29, 34].
Относительно недавно была разработана методика функциональной экспрессии отдельных генов обонятельных рецепторов в культуре клеток [7, 49], которая позволила исследователям протестировать invitroответ на стимуляцию андростеноном и близким по структуре андростадиеноном более 85 % всего набора вероятных обонятельных рецепторов человека [23]. В результате для дальнейшего подробного исследования был выбран рецептор OR7D4, дававший наиболее выраженный ответ на предъявленные стероиды. Наиболее часто встречающийся в популяции продукт аллельного варианта гена этого рецептора-RT избирательно реагировал на стимуляцию обоими стероидами. Продукт другого аллельного варианта гена-WM, отличающийся всего двумя аминокислотными заменами, не давал ответа ни на один из 66 протестированных одорантов. Благодаря комбинации молекулярно-биологических и психофизических методов, Келлеру (Keller) и соавт. удалось показать, что испытуемые с генотипами RT/WM или WM/WM менее чувствительны к запахам АНД и андростадиенона, а также оценивают этот запах как более приятный, чем испытуемые, обладающие генотипом RT/RT. Несмотря на то, что при проведении статистического анализа исследователями были учтены наблюдавшиеся гендерные и этнические различия в обонятельной чувствительности, генотип OR7D4 объяснил лишь 19 % вариабельности в интенсивности восприятия и 39 % вариабельности в отношении качественной характеристики запаха стероидов. В свете современной теории комбинаторного кодирования запаха кажется сомнительным представление о том, что летучие стероиды детектируются исключительно одним типом обонятельных рецепторов. Однако данное исследование заслуживает особого внимания как первая экспериментальная попытка связать между собой функционирование обонятельного рецептора invitro и восприятие запахов человеком. Значимость OR7D4как генетического фактора, определяющего обонятельную чувствительность к АНД, была подтверждена в работе другой независимой группы ученых [25]. В этом же исследовании была предпринята попытка провести анализ ассоциаций между данными по чувствительности к андростенону у близнецовых пар и их генотипами, определенными при помощи 2,3 млн SNP (single nucleotide polymorphism – одиночный нуклеотидный полиморфизм) маркеров, расположенных по всему геному. Авторы работы выявили наиболее значимую ассоциацию фенотипов с участком на 9 хромосоме человека (rs10966900), где нет генов обонятельных рецепторов. Сами исследователи приводят несколько объяснений своим результатам: 1) использованные snp маркеры покрывали лишь 38 % генов обонятельных рецепторов, и, следовательно, рецептор стероидов мог оказаться «вне поля зрения»; 2) существуют другие генетические факторы помимо генов обонятельных рецепторов, которые контролируют обонятельную чувствительность к летучим стероидам.
Генетическая модель специфической аносмии к летучим стероидам
Значительный вклад генетических факторов в вариабельность обонятельной чувствительности к летучим стероидам подтверждается существованием модели специфической аносмии к андростенону, разработанной на основе инбредных линий лабораторных мышей [37]. У мышей лабораторных линий описаны и другие крайние варианты обонятельной чувствительности, соответствующие некоторым специфическим аносмиям у человека [18, 31, 42]. Модель специфической аносмии к АНД была разработана при сотрудничестве Монелловского центра химических чувств (США) и ИПЭЭ РАН на линиях инбредных мышей – СВА/J и NZB/B1NJ, выбранных при предварительном скрининге из 28 доступных на тот момент линий Джексоновской лаборатории. Мыши линии СВА/J более чем в 2000 раз чувствительнее к андростенону, чем мыши линии NZB/B1NJ[37]. Пороги обонятельной чувствительности мышей на уровне поведения были определены с использованием трех различных методов, которые показали сходные значения для минимальных детектируемых концентраций [38]. У животных также отмечается разница в чувствительности между самками и самцами (самки имеют более высокие пороги детекции). Как и для людей, для мышей линий CBA/J и NZB/B1NJ был показан эффект индукции обонятельной чувствительности к андростенону, а также к его аналогам [35]. Через 3 недели экспозиции к этому стероиду в режиме 16 часов в сутки чувствительность к андростенону у семинедельных мышей линии CBA/J возросла в 200–400 раз, у мышей линии NZB/B1NJ в 64–128 раз [6]. Экспозиции к андростенону мышей линии CBA/J в том же режиме в раннем онтогенезе (14–28-ой день развития) привели к увеличению чувствительности к андростенону в возрасте 7–9 недель в 600 раз по сравнению с животными контрольной группы [36, 39]. В процессы индукции чувствительности к АНД у мышей вовлечены как основная обонятельная, так и вомероназальная системы [40].
На основе классического генетического скрещивания линий NZB/B1NJ и CBA/J в ходе совместной работы ученых из Монелловского Центра (США) и ИПЭЭ им. А. Н. Северцова РАН был проведен анализ связей между фенотипом (чувствительностью к андростенону) и ДНК-маркерами (99 микросателлитных, 41 SNP) [1, 5]. Анализ фенотипов гибридов F2 показал сложный характер наследования: распределение порогов чувствительности для всей выборки было отлично от нормального, были отмечены достоверные различия между чувствительностью к андростенону у самок и самцов, а также у отдельных групп реципрокных гибридов. Поэтому нами был проведен анализ локусов как для всей выборки гибридов, так и в отдельности для самцов и самок, с включением ковариат при помощи алгоритмов, включенных в программу R/QTL [10]. При анализе ассоциаций между порогами обонятельной чувствительности к андростенону и ДНК-маркерами выявлены предположительные (p<0.63) локусы, контролирующие чувствительность к андростенону на 2 (rs3023694), 12(rs3684371) и 17 (rs3675244) хромосомах. Эти 3 локуса аддитивно объясняют 25 % фенотипической вариабельности признака. При анализе, выполненном для отдельных групп животных с включением ковариат, помимо ряда предположительных локусов, был обнаружен достоверный (p<0.05) локус на 10 хромосоме (D10Mit14) у самцов, объясняющий распределение порогов внутри групп малочувствительных и высокочувствительных животных, а также достоверное эпистатическое взаимодействие между маркерами на 2 хромосоме (D2Mit266) и X хромосоме (rs3723498) у самок (LODfull p<0.05, LODint p<0.05).Нами был проведен поиск обонятельных рецепторов, варианты которых могли бы объяснять специфическую аносмию к андростенону, в областях найденных локусов по базе данных PosMed. Так, были обнаружены рецепторы на 2, 11, 10, 1 и X хромосомах мыши. Обонятельные рецепторы в геноме расположены кластерами [48], что не позволяет соотнести полученные нами сцепления с отдельными генами. Помимо рецепторных дефицитов на чувствительность к андростенону могли бы оказать влияние и другие факторы, например, вариации в центральном звене обонятельного анализатора или поведенческие особенности животных (пороги чувствительности к андростенону были определены с использованием методики обучения). При поиске в заданных областях по ключевому слову «olfaction» – «обоняние» в базе данных PosMed было обнаружено большое количество генов. Например, среди этих генов на 12 хромосоме рецептор соматостати на Sstr1 и каталитическая субъединица фосфоинозитид-3-киназы Pik3cg. Соматостатин – важный нейромодулятор в структурах обонятельной системы, а фосфоинозитид–3-киназа, по всей видимости, принимает участие в передаче обонятельного сигнала на уровне обонятельных сенсорных нейронов [33]. На 17 хромосоме, локус на которой в большей степени характерен для самок, расположены гены рецепторов Lhcgr и Fshr. В то же время хорошо известен тот факт, что обонятельная чувствительность самок меняется в зависимости от стадии эстрального цикла. Интересно, что малочувствительные кАНД мыши линии NZB/B1NJ имеют очень высокий уровень агрессивности по сравнению со многими другими инбредными линиями и, в частности, с CBA/J. Мы также провели QTL-анализ показателей межсамцовой агрессии на этой модели [4]. Доверительные интервалы для достоверного локуса на 10-ой хромосоме (D10Mit14), частично объясняющего чувствительность к андростенону, и локуса, выявленного для показателей межсамцовой агрессии на той же хромосоме (rs3693721), перекрываются, что указывает на сцепление генов или плейотропный эффект. Повышенная агрессивность и специфическая аносмия к летучим стероидам, по всей видимости, являются отчасти генетически связанными признаками.
Мы также соотнесли наши результаты анализа ассоциаций с описанными выше данными о генетических факторах, полученными Келлером с соавт. [23] и Кнаапила с соавт.[25]. Гомолог гена OR7D4 у мыши – Olfr867 расположен на 9 хромосоме (19.8 Мб). Находившийся в ближайшем положении к Olfr867 в нашем исследовании SNP маркер (rs3683183, 9 хромосома 20.9 Мб) не объяснял наблюдаемой вариабельности в чувствительности к андростенону у гибридов F2 (LOD оценка 0.8, ANOVA p=0.21). Выявленные в работе Кнаапила с соавт. наиболее значимые локусы имеют соответствующие гомологичные участки на 4 и на 12 хромосоме мыши. Если на 4 хромосоме мыши нами не было выявлено значимых сцеплений, то на 12 хромосоме гомолог гена AHR(15.78 cM), вблизи которого был расположен статистически значимый пик в популяции человека, хорошо попадает в определенный нами интервал локуса (0-26 сМ, пик 10.6 сМ). Генов обонятельных рецепторов, как уже обсуждалось выше, в этом интервале нет. Тем не менее сопоставление результатов исследований, касающихся генетической регуляции обонятельной чувствительности кАНД у людей и у линий лабораторных мышей, указывает на перспективность детального изучения роли локуса на 7 хромосоме человека.
Заключение
Специфические аносмии концептуально представляют собой исключительно интересную модель для разноплановых исследований обонятельной чувствительности человека и животных. Наиболее подробное научное описание специфической аносмии на сегодняшний день дано на примере аносмии к феромону хряка андростенону. Вариабельность в детекции запаха летучего стероида андростенона находится под влиянием таких факторов, как генотип, пол, возраст, индивидуальный опыт. Однако более конкретные генетические и физиологические механизмы, за счет которых реализуются эти влияния, ещё во многом не раскрыты. Можно достаточно уверенно сказать, что индивидуальное разнообразие в чувствительности к летучим стероидам, в частности, к андростенону и близкому ему по структуре андростадиенону, связано с вариациями генов обонятельных рецепторов, в том числе с аллелями гена OR7D4. Но при этом ряд данных, полученных как на человеке, так и на животных, позволяет предположить, что в регуляцию вовлечены и другие генетические факторы, природу которых ещё только предстоит определить.
Работа выполнена при поддержке грантов МК-709.2012.4 и РФФИ 12-04-32079мол_а.
Рецензенты:
Бутовский Руслан Олегович, доктор биологических наук, профессор, программный директор Фонда «Устойчивое Развитие», г. Москва.
Блохин Геннадий Иванович, доктор с-х наук, профессор, зав. кафедрой зоологии ФГБОУ ВПО РГАУ-МСХА им. К. А. Тимирязева МСХ РФ, г. Москва.
Библиографическая ссылка
Ключникова М.А., Вознесенская В.В. РОЛЬ ГЕНЕТИЧЕСКИХ И НЕГЕНЕТИЧЕСКИХ ФАКТОРОВ В РЕГУЛЯЦИИ ОБОНЯТЕЛЬНОЙ ЧУВСТВИТЕЛЬНОСТИ К АНДРОСТЕНОНУ // Современные проблемы науки и образования. 2013. № 2. ;URL: https://science-education.ru/ru/article/view?id=8643 (дата обращения: 21.01.2026).



